吉列替尼治疗FLT3突变的复发或难治性急性髓系白血病的应用研究*
饶洋
(南阳医学高等专科学校第一附属医院 血液内科,河南 南阳 473000)
急性髓细胞白血病(AML)为一种以髓细胞异常增生、分化为主要发病特征的恶性、克隆性血液疾病,因机体造血功能低下,此类患者循环系统中可蓄积大量未成熟的造血前体细胞,并出现不同程度的感染、贫血或出血症状[1]。Fms 样酪氨酸激酶3(FLT3)为一种可调节白血病母细胞存活或分化的跨膜酪氨酸激酶,相关数据显示,临床约有30% 的AML 患者可存在FLT3 基因突变,其中主要包括FLT3 酪氨酸激酶结构域(TKD)及FLT3 跨膜区内部串联重复(ITD)突变两种类型,前者可影响7%左右AML 患者,后者可影响30%左右AML 患者[2-3]。目前临床尚未明确FLT3 基因突变的具体原因,但考虑与AML 患者化疗期间产生的耐药反应相关[4]。与普通AML患者相比,FLT3 基因突变的AML 患者对传统化疗方案的敏感性较差,经标准一线化疗治疗后,此类患者3 年内生存率仍不足20%[5]。吉列替尼为美国食品药物管理局批准用于治疗FLT3 基因突变,以及复发、难治性AML 的第二代FLT3 抑制剂,作为一种格列吡嗪的衍生物,此药可对TKD及ITD 激活突变的FLT3 产生选择性的抑制效果[6]。本研究旨在观察吉列替尼治疗FLT3 突变型复发或难治性AML 的效果及安全性。
1 资料与方法
1.1 一般资料
本文为前瞻性研究,病例纳入南阳医学高等专科学校第一附属医院2020 年6 月至2022 年4月收治的85 例FLT3 突变型AML 患者,经数字表法将其分为常规组(42 例)和试验组(43 例)。常规组中男22 例,女20 例,年龄20~60 岁,平均(40.23±5.16)岁,诊断类型[7]:25 例为复发型,17 例为难治型,FLT3 基因突变类型[8]:12例为FLT3-TKD 突变,30 例为FLT3-ITD 突变,入院时卡氏评分(KPS)[9]基线值70~80 分,平均(75.25±5.36)分;试验组中男22 例,女21 例,年龄22~58 岁,平均(41.16±5.23)岁,诊断类型:23 例为复发型,20 例为难治型,FLT3 基因突变类型:13 例为FLT3-TKD 突变,30 例为FLT3-ITD 突变,入院时KPS 评分基线值72~78分,平均(75.33±5.22)分,两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本次研究已获得医院伦理委员会批准(2212Q)。
纳入标准:①入组患者均符合AML 诊断要点,经评估确认为复发、难治性AML;②符合靶向治疗指征;③入院时KPS 评分基线值均≥70 分,预计生存周期≥1 年;④均知情、同意参与此次研究。
排除标准:①其他类型恶性肿瘤者;②有感染性疾病或免疫缺陷性疾病者;③有其他血液学疾病或凝血机制障碍者;④精神状态不佳或存在认知障碍者。
1.2 方法
常规组入院后均采用VAA 方案继续化疗,用药包括维奈克拉、阿扎胞苷、阿糖胞苷,首日取100 mg 维奈克拉(AbbVie Ireland NL B.V.,HJ20200054,50 mg)口服,1 次/天,第2 天用药剂量增加至200 mg/次,1 次/天,第3~7 天按400 mg/次,1 次/天服药;第1~7 天按100 mg 次,1 次/天剂量口服阿扎胞苷(正大天晴药业集团,H20193278,100 mg);第1~14 天按50 mg/次,1 次/天剂量经皮下注射阿糖胞苷(浙江海正药业,H20054695,100 mg/mL),14 d 为一个疗程,连续治疗3 个周期后评估疗效。试验组采用予以吉列替尼(Astellas Pharma Inc.,HJ20210009,40 mg)辅助治疗,按120 mg/次,1 次/天剂量口服本品,7 d为1 个周期,其余化疗方案同常规组,连续治疗3个周期后评估疗效。
每次治疗结束后即转入普通病房,需每日应用紫外线照射病房至少30 min 进行消毒,后予以患者服用托烷司琼(湖北舒邦药业有限公司,H20060696,50 mg)止吐,予以浓度为1% 的聚维酮碘溶液(成都永安制药有限公司,H51020113,200 mL)漱口,予以高额锰酸溶液坐浴预防肛周感染,同时予以服用阿莫西林(华北制药股份有限公司,H13020729,0.125 g)等广谱抗生素进行常规抗感染治疗,密切关注患者血象,若血红蛋白(Hb)水平不足60 g/L、血小板计数低于20×109/L 需及时予以血小板输注治疗。所有患者治疗3 个周期后,开展为期1 年随访。
1.3 观察指标
①比较两组治疗前后的β2 微球蛋白(β2-MG)变化情况。评估方法:以2 mL 外周静脉血为检测样本,按3 000 r/min、半径0.5 cm 离心5 min 后,经酶联免疫吸附试验检测,检测设备为Thermo Varioskan LUX 多功能酶标仪(上海赛默飞世尔,沪械注准20182400073),分别于治疗前、1 个周期、2 个周期、3 个周期后等不同时间点检测,治疗后β2-MG 水平越低越好。②比较两组治疗后的总有效率。评估方法:参考《血液病诊断及疗效标准》[10]相关内容。若治疗后PLT≥100×109/L 且可停止输血时即可判定为完全缓解(CR),若未达到CR 标准但经血象检查可见原始幼稚髓细胞占比在5%~20% 以内时判定为部分缓解(PR),若治疗后未达到CR 或PR 标准时及判定为治疗失败(NR),取CR、PR 百分比之和为总有效率。③比较两组治疗后的生存情况。评估方法:评估指标包括中位无进展生存期(PFS)、中位总生存期(OS),自随机分化开始,任何原因导致患者病情进展记录为PFS,任何原因导致患者死亡记录为OS[11]。④随访期间,比较两组病情复发率及死亡率,及血细胞减少(血小板、中性粒细胞、白细胞)、消化道反应(腹胀腹泻、恶心呕吐)、脏器功能异常(心、肝、肾等)等毒副反应发生情况,并根据NCI-CTCAE[12]比较两组患者的毒副反应分级情况。
1.4 统计学方法
数据均采用软件SPSS22.0 处理,计数资料以百分率(%)表示,用χ2检验,等级资料用比率Z值检验,计量资料以均数±标准差()表示,用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后的β2-MG 水平比较
两组治疗前β2-MG 水平,差异无统计学意义(P>0.05);在不同治疗方案下,试验组治疗1 个周期后、2 个周期后、3 个周期后的β2-MG 水平均低于常规组,差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后的β2-MG 水平比较(,mg/L)

表1 两组患者治疗前后的β2-MG 水平比较(,mg/L)
注:†与治疗前比较,P<0.05。
2.2 两组患者治疗总有效率比较
试验组治疗后的总有效率88.37%(38/43)高于常规组69.05%(29/42),差异有统计学意义(Z=2.180,P=0.029),见表2。
2.3 两组患者生存情况比较
随访期间,试验组的中位PFS、中位OS 均高于常规组,差异有统计学意义(P<0.05),见表3。
表3 两组患者生存情况比较(,个月)

表3 两组患者生存情况比较(,个月)
2.4 两组患者预后情况比较
随访期间,试验组的病情复发率及死亡率均低于常规组,差异有统计学意义(P<0.05),见表4。
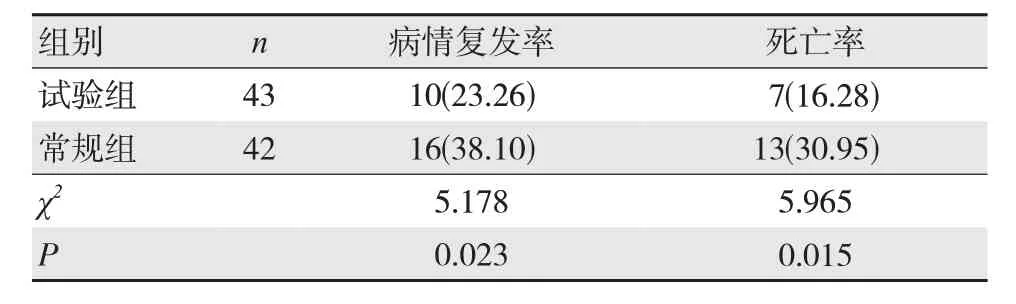
表4 两组患者预后情况比较 [n(%)]
2.5 两组患者毒副反应发生情况比较
随访期间,试验组的毒副反应发生率46.51%(20/43)略高于常规组42.86%(18/42),差异无统计学意义(χ2=0.270,P=0.604),见表5。
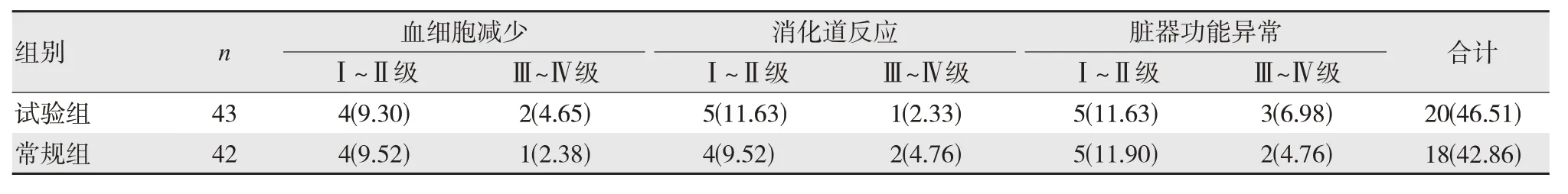
表5 两组患者毒副反应发生情况比较 [n(%)]
3 讨论
FLT3 基因突变为AML 患者的常见基因突变类型,由于对传统化疗方案的敏感性较差,此类患者极易进展为复发、难治性AML。目前临床针对复发、难治性AML 多采取含阿扎胞苷、阿糖胞苷在内的去甲基化治疗,但上述疗法的不良反应大,部分患者可因发生严重骨髓抑制而死亡[13]。FLT3 抑制剂为治疗FLT3 突变型AML 的主要靶向药,目前已被批准用于临床的FLT3 抑制剂主要包括索拉非尼、吉列替尼等,前者为第一代FLT3 抑制剂,能通过作用于酪氨酸激酶受体(TKI)而抑制FLT3 等多种激酶活性,但作为一种多靶点TKI,索拉非尼治疗FLT3 阳性AML 患者的效果并不理想[14-15]。吉列替尼为第二代FLT3 抑制剂,与索拉非尼相比,此药对TKD、ITD 激活突变型FLT3 具有选择性抑制作用,脱靶效应小,能有效抑制突变相关的癌细胞增殖、存活[16]。
β2-MG 为一种非主要组织相容性复合物编码的轻链部分,主要有淋巴细胞产生,在多种恶性血液系统疾病中均可呈高水平表达。研究指出,AML 患者的白血病细胞抗原致敏淋巴细胞数增加会促使β2-MG 合成速度加快、合成数量增加,其表达水平与AML 的病情进展及预后均有密切关联[17]。本研究结果显示,试验组治疗后的治疗1个周期后、2 个周期后、3 个周期后的β2-MG 水平均低于常规组。FLT3 为一种被造血干细胞、前体细胞的跨膜配体激活的受体酪氨酸激酶,FLT3 活化可促使细胞增殖、分化,当TKD、ITD基因突变则可导致FLT3 过度活化及造血干细胞恶性增生[18]。相关细胞试验表明,吉列替尼对野生型FLT3 及ITD 突变FLT3 的半数抑制浓度在0.7~5 nmol/L 不等,但通过酶谱试验得知,此药对AXL 受体酪氨酸激酶也有一定抑制效果,而AXL可调节FLT3 活性,即吉列替尼能通过直接、间接抑制FLT3 激活而增加AML 患者的临床获益[19]。故本研究中,试验组治疗后的总有效率较常规组更高。目前尚未见其他学者开展吉列替尼治疗复发、难治性FLT3 突变AML 的临床对照试验,但李可昕等[20]通过应用吉列替尼治疗1 例FLT3-ITD突变的难治性AML 后结果显示,此病例治疗21 d后首次达到CR,提示吉列替尼联合VVA 治疗效果显著,随患者治疗期间发生了骨髓抑制,但未并发其他症状,其肝、肾、凝血功能均未见明显异常。本研究中,试验组治疗后的中位PFS、中位OS 均高于常规组,提示吉列替尼对延长FLT3 突变的复发、难治性AML 生存周期也有积极影响。虽然吉列替尼也有一定毒副作用,但两组随访期间的毒副反应发生率差异无统计学意义,提示吉列替尼在增强AML 患者治疗效果同时,未明显增加用药风险。
综上所述,吉列替尼能下调FLT3 突变复发、难治性AML 患者的β2-MG,对提升治疗效果、延长生存周期均有积极意义,联合应用此药未明显增加药物毒副反应,安全性较高,具有一定推广价值。但本研究所选研究例数较少,且研究重在观察患者的近期疗效及远期预后,尚未对吉列替尼的药理作用进行深入探讨,未来临床可依据本研究成果,通过开展动物实验或细胞试验进一步探讨吉列替尼的作用机制。

