基于转录组探究外源水杨酸对条锈菌侵染小麦幼苗的缓解效应及差异表达基因分析
齐学礼 李 莹 李春盈 韩留鹏 赵明忠 张建周,*
研究简报
基于转录组探究外源水杨酸对条锈菌侵染小麦幼苗的缓解效应及差异表达基因分析
齐学礼1,**李 莹2,**李春盈3韩留鹏1赵明忠1张建周3,*
1河南省作物分子育种研究院, 河南郑州 450002;2河南农业大学学报编辑部, 河南郑州 450002;3河南省农业科学院小麦研究所, 河南郑州 450002
为探究外源水杨酸提高小麦条锈病抗性的作用机制, 本文将周麦18分为未处理的小麦幼苗(对照)、条锈菌侵染的小麦幼苗(SR)和水杨酸处理条锈菌侵染的小麦幼苗(SA-SR), 对处理15 d后的小麦幼苗进行抗病性鉴定、氨基酸含量检测、转录组测序及荧光定量分析鉴定。结果表明: 外源水杨酸能够显著降低条锈菌对小麦幼苗的致病力; SR组叶片中氨基酸含量普遍降低, 而经过水杨酸预先处理的SA-SR组与Control无显著差异, 说明小麦条锈病造成叶片中氨基酸的含量显著降低; 通过GO富集分析发现, SR和SA-SR组的差异基因在与光合作用相关的生物过程中富集, 涉及的细胞组分包括叶绿体和类囊体等, KEGG通路富集分析显示, SR和SA-SR两个分组均在MAPK信号通路和次生代谢物的生物合成中显著富集, 在植物的抗病或抗逆中发挥重要作用。
小麦条锈病; 水杨酸; 氨基酸; 转录组
小麦条锈病是全世界范围内分布最广泛且影响最大的小麦病害之一, 在中国的小麦种植区是重要的监测和防治对象。小麦条锈病是由条形柄锈菌(f. sp., Pst)引起的一种低温气传真菌性病害[1], 叶片是主要发病部位, 严重时对叶鞘、茎秆、穗部以及芒和颖壳都会造成危害。流行年份会造成20%~30%的减产, 甚至是50%~60%或绝收, 中国是条锈病最大的流行区[2]。小麦条锈病的防治主要是以种植抗病品种为主, 辅以药剂和栽培防治, 但抗病品种的培育周期较长, 药剂防治效果虽立竿见影, 但对人畜有害, 且农药残留不利于生态环境可持续发展, 还可能会引起病原菌的耐药性。然而, 诱导抗病则从一个全新的视角出发, 通过刺激、胁迫或外力引发植物的天然防御机制, 进而使植物能够免受或减轻病原物的危害, 也弥补了抗病育种和药剂等防治策略的不足。
水杨酸(salicylic acid, SA)是在高等植物体内合成的一种小分子酚类物质, 在调节植物生长发育的过程中发挥重要作用, 另外还参与植物对病原菌的防御反应[3], 是一种激活抗病性的关键信号。过去的报道主要侧重于水杨酸在植物抗寒[4]、抗旱[5]、抗盐碱[6]等方面的作用机理。White等[7]证实用水杨酸、乙酰水杨酸(阿司匹林)或苯甲酸等处理烟草能够诱导病程相关蛋白的合成从而产生对烟草花叶病毒(TMV)的抗性。在真菌病害方面, 通过采用1.0 mmol L–1水杨酸浸种并施用生物源物质或生防菌剂, 能够实现黄瓜白粉病65.24%和71.92%的防病率[8]。近年来小麦抗病研究发现, 发现通过启动水杨酸以及茉莉酸(jasmonic acid, JA)信号途径上相关的抗性基因可获得小麦对赤霉病的抗性[9]; 小麦在与叶锈菌的相互作用中引起了氧化应激反应, 而水杨酸能够通过减轻病原菌诱导的氧化过程, 减轻小麦叶锈病的侵染[10]; 另外, 在接种条锈菌后, 水杨酸合成的两个关键基因和的相对表达量显著上调, 从而说明水杨酸参与了小麦对条锈病的抵抗作用[11]; Liu等[12]发现非编码RNA SABC1能够招募PRC2复合体, 增加临近基因NAC3的H3K27me3修饰, 从而抑制NAC3的转录, 而NAC3在激活水杨酸合成酶ICS1的表达以及促进SA合成中发挥重要作用, 正调控植物对细菌和病毒的免疫, 植物SABC1在被细菌或病毒侵染时积累降低, 其对NAC3的抑制作用降低, 从而激活NAC3和ICS1的表达, 增加植物抗性; 刘佳慧等[13]发现水杨酸信号通路在抑制芜菁花叶病毒(TuMV)的侵染中具有重要的作用, 而TuMV的NIb蛋白能够靶向水杨酸受体NPR1, 阻止NPR1与SUMO3的相互作用及修饰, 并导致后续苏木化修饰依赖的磷酸化过程不能进行, 从而抑制水杨酸介导的植物抗病毒信号通路, 以促进病毒的侵染。然而, 对外源水杨酸提高小麦抗条锈病在分子水平上的系统性报道较少。
本研究以半冬性小麦品种周麦18为试验材料, 结合氨基酸含量、转录组测序等数据, 对小麦幼苗接种条锈病菌和外源水杨酸诱导小麦的抗病性进行了系统性分析, 从而解析水杨酸提高小麦对条锈菌抗性的分子机制。
1 材料与方法
1.1 试验材料
供试小麦品种为周麦18, 供试小麦周麦18是我国黄淮冬麦区南片的主栽品种之一, 代表性强, 且苗期中感条锈病, 成株期中抗条锈病, 由河南省作物分子育种研究院小麦分子育种室提供; 小麦条锈菌为我国小麦条锈菌流行小种CYR32, 由河南省作物分子育种研究院小麦分子育种室提供; 水杨酸(天津化学试剂六厂, 分析纯), 先用少量 95%的酒精进行溶解, 再用浓度为1 mol L–1的NaOH将溶液的pH值调至6.8左右, 随后可用蒸馏水将其配制成50 mmol L–1的母液, 待试验时再用蒸馏水稀释至1 mmol L–1。
1.2 试验方法
1.2.1 幼苗的培养和处理 挑选籽粒发育良好、颜色形状一致的周麦18种子16粒, 催芽后播种在7 cm × 7 cm的小花盆内。待小麦幼苗长至二叶一心期, 即第1叶完全展开时, 分为两组进行喷雾(喷雾时加0.05%的Tween 20): (1) 水杨酸处理预接种条锈菌幼苗(SA-SR): 用1 mmol L–1的SA对叶面进行喷雾, 直至叶面上布满均匀微小雾点; (2) 预接种条锈菌的小麦幼苗(SR): 用蒸馏水进行喷雾。每个处理3盆, 重复3次。3 d后, 采用抖粉法[14]接种SA-SR组和SR组小麦幼苗, 后置于10℃黑暗保湿24 h, 于温室(平均温度12~20℃, 光照10~12 h d–1, 光强100~160mmol m−2s−1(换算成国际单位))诱导发病, 培养15~18 d后, 待SR组充分发病时调查反应型[15], 0~6级为抗病, 7~9级为感病(图1)。同时调查小麦发病病情指数。

图1 小麦苗期条锈病反应型鉴定标准(0~9级)
1.2.2 氨基酸含量测定[16]称取2.0 g小麦叶片于水解管中, 加入6 mol L–1盐酸溶液10~15 mL以及苯酚3~4滴。将水解管放入冷冻剂3~5 min后抽真空, 充入氮气, 重复3次后, 进行封口操作(充氮气状态下)。
将水解管放在的水解炉内(110±1)℃, 水解22 h后, 取出冷却至室温。水解液过滤至50 mL容量瓶内, 用水少量多次对水解管进行冲洗, 随后移入50 mL容量瓶内, 定容。吸取1.0 mL滤液至15 mL试管内, 用试管浓缩仪进行减压干燥(40~50℃), 残留物用1~2 mL水溶解, 减压干燥。在干燥后的试管内加入柠檬酸钠缓冲液(pH 2.2)进行溶解, 振荡混匀,采用0.22 μm滤膜进行过滤, 转移至进样瓶, 高效液相色谱仪测定。
1.2.3 RNA提取、文库构建及测序 采用TRIzol法提取总RNA, 提取后利用1%琼脂糖凝胶电泳、NanoDrop分光光度计和Bioanalyzer 2100 system等仪器完成RNA纯度和完整性检测。样品检测合格后, 由北京中科华章生物科技有限公司进行后续建库和测序。
1.2.4 数据获取及差异分析 测序获得fastq格式的原始数据(raw data)。为提高数据分析可靠性,使用软件Trimmomatic v0.33[17]过滤带接头以及含 N 比例超过10%的低质量reads, 获得clean data 128.34 Gb。利用STAR v2.5.2b[18]软件将clean data定位到小麦的参考基因组Triticum aestivum genome assembly iwgsc_refseqv1.0Submitted by IWGSC (August 2018) GenBank: GCA_900519105.1上。使用HTSeq[19]软件计算基因read counts数后, 使用软件DESeq2对其进行分析, 按照-value < 0.05 & |log2FC|≥1的阈值进行差异mRNA筛选。使用R软件进行聚类热图、PCA分析、样本间pearson相关系数计算。
1.2.5 基因的GO与KEGG富集分析及转录因子分析 对筛选出的差异基因进行GO和KEGG功能注释富集分析。富集分析使用R包进行应用超几何检验, GO富集分析使用GOseq包, KEGG使用KOBAS 3.0富集分析, 找出在差异表达基因中显著富集的pathway或者term。
1.2.6 差异基因的qRT-PCR验证 为验证转录组测序数据的可靠性, 以小麦GAPDH基因作为内参, 选择10个差异表达基因进行qRT-PCR验证, 所选基因功能涉及叶绿体、类囊体以及光合作用, 特异性引物序列见表1。采用SYBR法进行荧光定量分析, 重复3次, 采用2–ΔΔCt法计算基因的相对表达量[16], 并采用R包ggplot2_3.4.2进行RNA-seq和qRT-PCR的spearman相关性分析, 相关性越高(> 0.8,<0.05), 说明PCR与RNAseq的一致性越高。

表1 实时荧光定量PCR所用引物
1.2.7 数据处理 采用Microsoft Excel 2010对试验数据进行统和与整理, 方差分析等则采用SPSS 22.0软件。
2 结果与分析
2.1 不同处理小麦苗期抗病性鉴定
周麦18小麦幼苗接种条锈病菌的SR组和经过水杨酸处理的SA-SR组对CYR32的反应型见图2, SR组对CYR32表现感病, SA-SR组对CYR32表现抗病。
病情指数SA-SR在6.5~9.0之间, 而SR则在27~45之间。因此, 从小麦条锈病的病情指数来看, SR组发病率较重, 而经过水杨酸处理的SA-SR组发病轻, 差异极显著(<0.01), 说明水杨酸能够缓解条锈菌对小麦的侵染程度。
2.2 氨基酸含量统计分析
根据氨基酸含量统计箱线图可以发现(图3), SR与对照组相比, 多种水解氨基酸的含量均有不同程度的下降, 其中丝氨酸、苯丙氨酸和异亮氨酸的含量下降显著(<0.05); 而SA-SR组小麦叶片中氨基酸含量与对照无显著差异。由此可见, 小麦条锈病显著降低了植株氨基酸的含量, 而外源喷施水杨酸后可缓解氨基酸的降低程度, 从而在一定程度上提高对小麦条锈病的抵御能力。

图2 SR组和SA-SR组对CYR32的反应情况
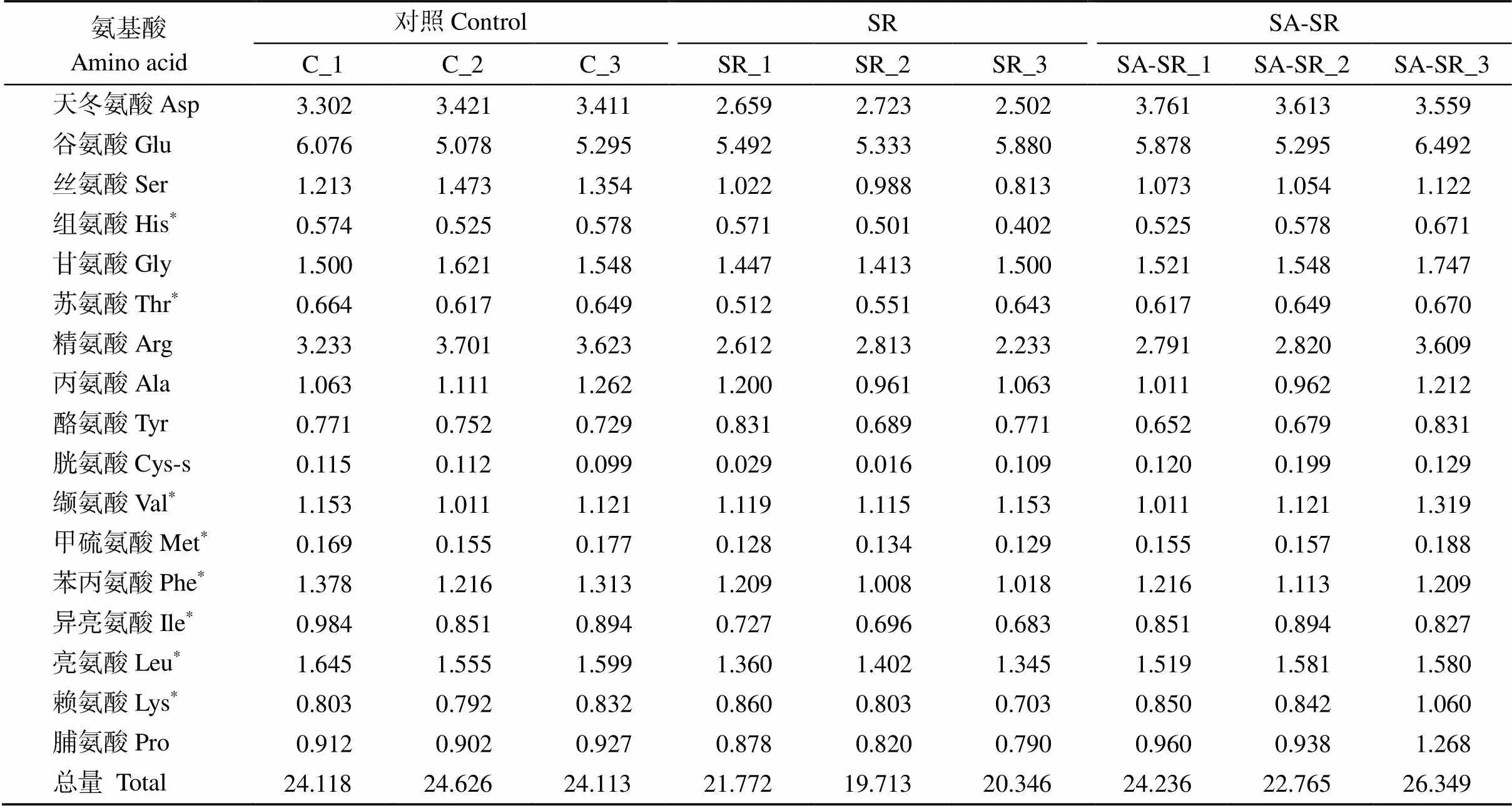
表2 3个分组中小麦叶片水解氨基酸含量
*represents the essential amino acids.
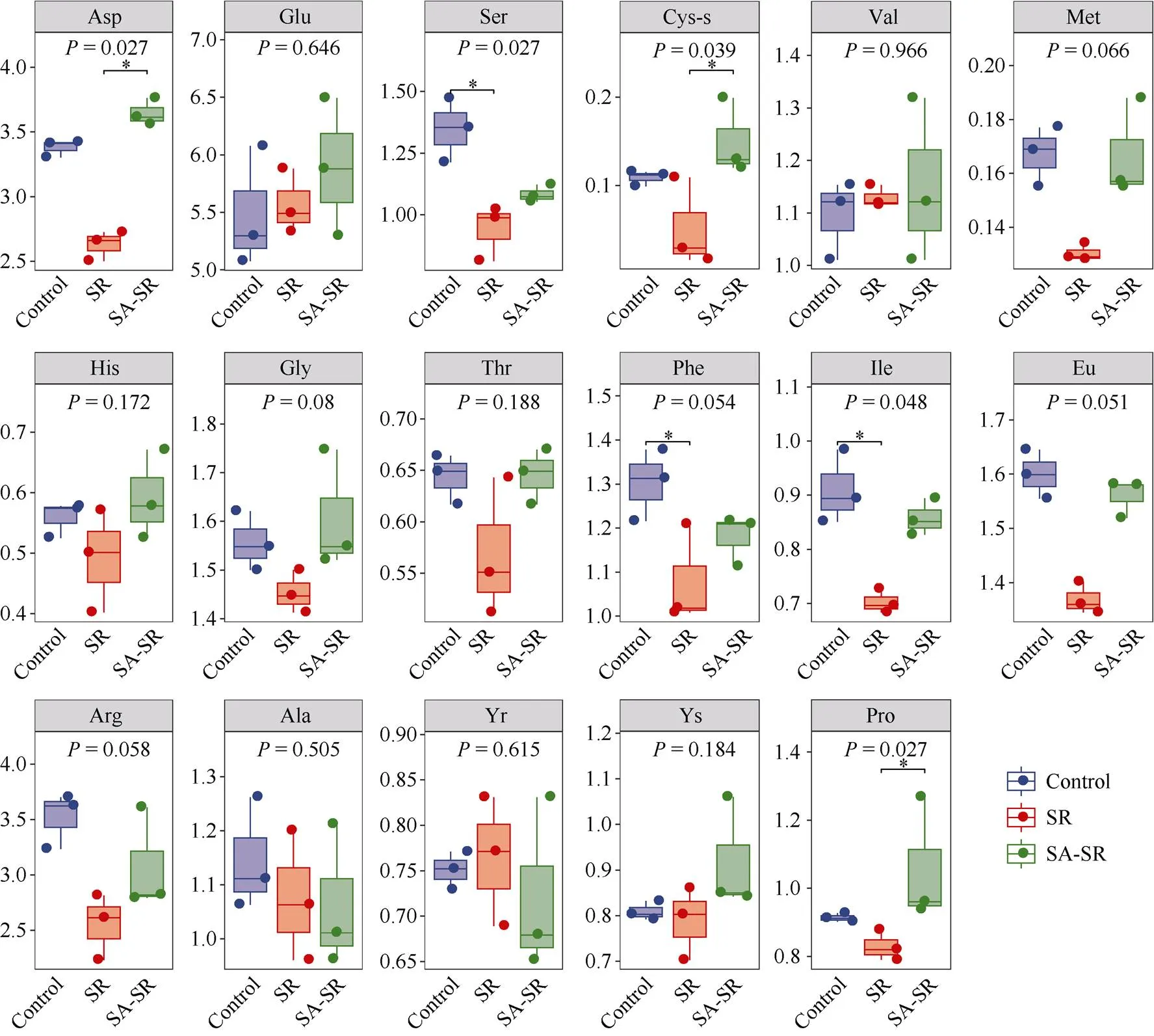
图3 3个分组中小麦叶片17种水解氨基酸含量差异比较
2.3 转录组测序数据质量
本研究通过Illumina Novaseq 6000高通量测序获得原始数据(raw data), 数据量为128.69 Gb, 过滤得到有效数据(clean data), Q20为98.15%~98.53%, GC含量在54.67%~55.72%, 比对率在96.08%~ 96.84%, 表明整体测序质量好, 后续分析有很高的reads利用率(表3)。
2.4 相关性分析
皮尔逊(Pearson)相关性分析显示3个分组的组内以及组间的生物学重复性较高(图4-a)。PCA分析发现, 不同分组组间的表达量水平有明显的差异(图4-b)。结果表明, 对照、SR以及SA-SR组的RNA-seq数据可靠, 可进行进一步分析。
2.5 差异表达基因分析
SR与对照、SR与SA-SR的差异基因分析结果表明, SR与对照相比, 总共得到18,002个差异表达基因, 10,728个上调, 7274个下调(图5-a)。SA-SR与SR相比, 总共得到20,089个差异表达基因, 7404个上调, 12,685个下调(图5-b)。两个组合间的venn图(图6-a)发现有7825个差异表达基因。通过对共有差异基因进行聚类分析(图6-b), 发现共有基因的转录因子主要集中bHLH (427)、WRKY (326)、B3 (238)、FAR1 (222)、ERF (202)等, 上述转录因子在植物的抗病性、抗逆性、生长发育以及信号转导等过程中发挥着重要作用。
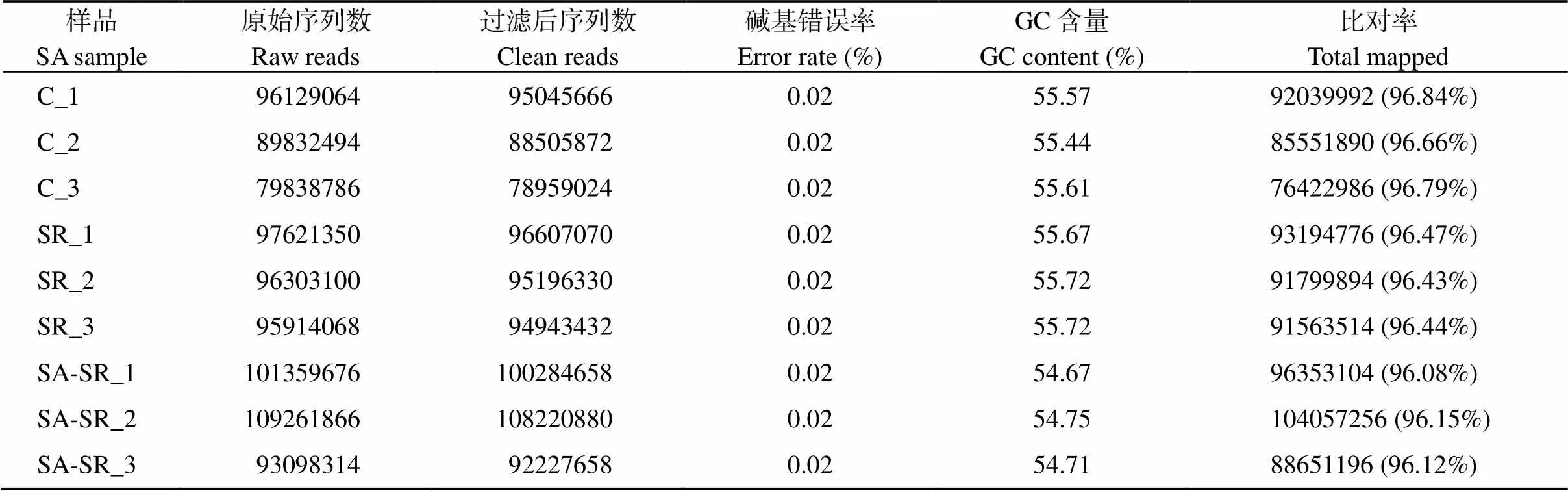
表3 转录组数据统计表
C: 未处理的小麦幼苗; SR: 条锈病小麦幼苗; SA-SR: 水杨酸处理条锈病幼苗。
C: the untreated wheat seedlings; SR: stripe rust wheat seedlings; SA-SR: salicylic acid treatment of strip rust seedlings.
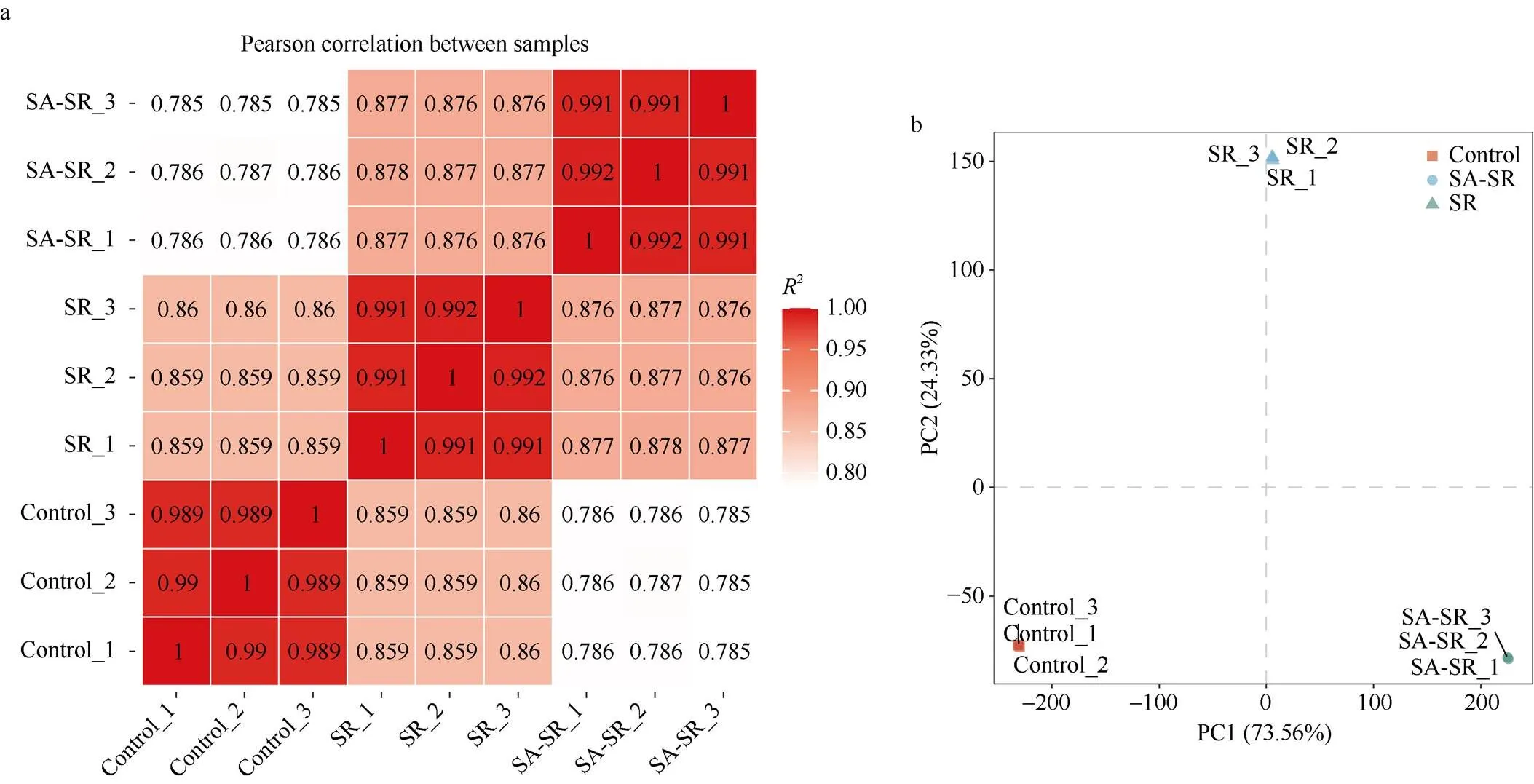
图4 不同样本之间的转录组测序数据相关性分析
a: 组内和组间皮尔逊相关性分析; b: 组间基因表达量PCA分析。
a: Pearson correlation analysis within and between groups; b: PCA analysis of gene expression levels between groups.
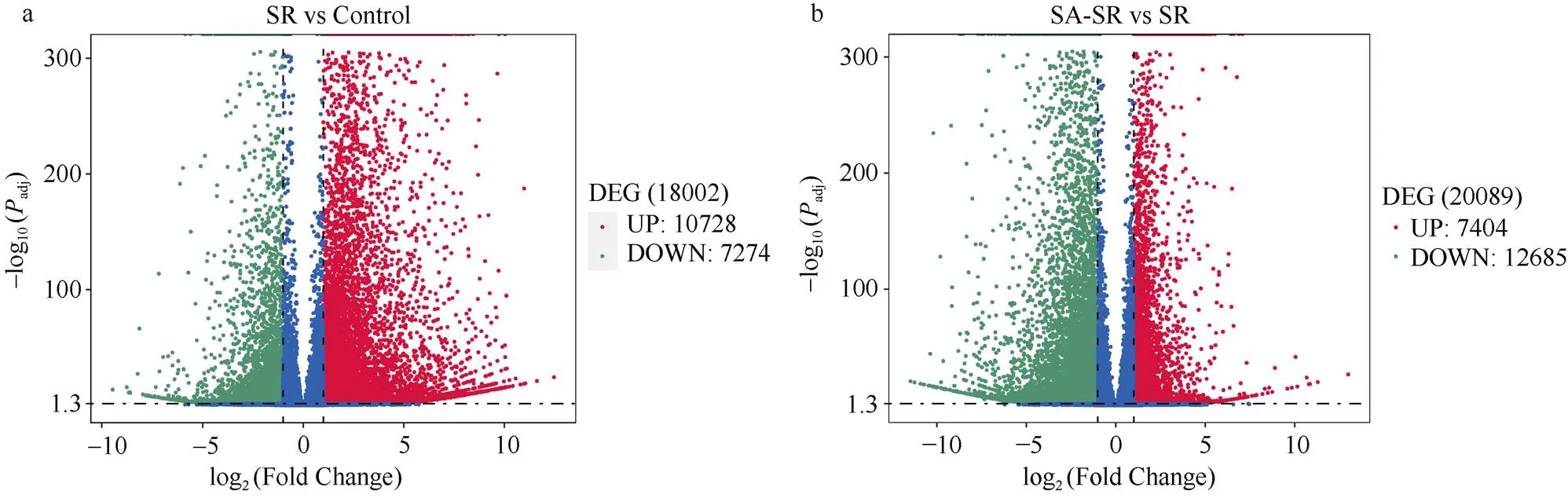
图5 差异表达基因火山图
a: SR与对照; b: SR与SA-SR.
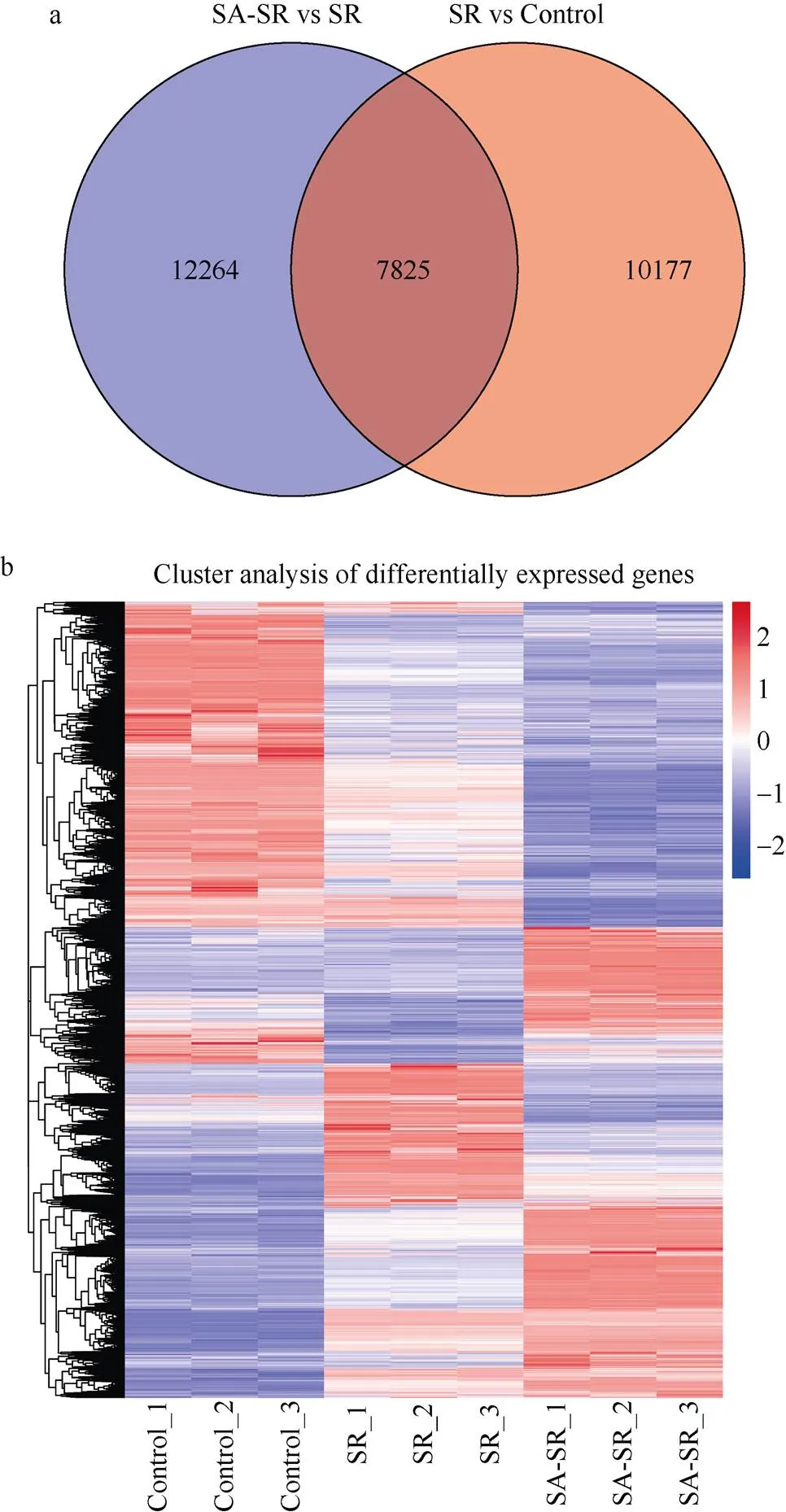
图6 不同组合中DEGs分析
a: 共有差异基因聚类情况; b: SA-SR和SR、SR和对照比较组之间差异表达基因的韦恩图。
a: clustering of genes that share differences. b: Venn diagram showed the number of DEGs between SA-SR vs SR and SR vs Control.
2.6 GO与KEGG富集分析
GO富集分析表明, SA-SR与SR分组的差异基因显著富集的前10个子类集中在细胞组分和生物过程上(表4), 细胞组分中质体(plastid)富集程度最高, 其次为叶绿体(chloroplast)、类囊体(thylakoid)、类囊体膜(thylakoid membrane)等。生物学过程集中在光合作用(photosynthesis), 相关的上下调基因分别有34个和236个(图7-a); SR与对照分组的差异基因显著富集的前10个子类集中在生物过程和分子功能上(表5), 生物过程中肉桂酸生物合成过程(cinnamic acid biosynthetic process)和肉桂酸代谢过程(cinnamic acid metabolic process)富集程度最高, 其次为蛋白质磷酸化(protein phosphorylation), 和磷酸化(phosphorylation)。分子功能主要集中在苯丙氨酸解氨酶活性(phenylalanine ammonia-lyase activity)上, 其次是蛋白激酶活性(protein kinase activity)(图7-b)。
KEGG富集分析表明, 差异表达基因主要参与新陈代谢(Metabolism)这一大类。其中SA-SR与SR分组中, 极其显著富集的通路包括碳代谢(Carbon metabolism), 次生代谢物的生物合成(Biosynthesis of secondary metabolites), α-亚麻酸代谢(alpha-Linolenic acid metabolism), 泛醌以及MAPK-植物信号通路(MAPK signaling pathway-plant) (图8-a); 在SR与对照分组中, 极其显著富集的通路包括植物激素信号转导(Plant hormone signal transduction), α-亚麻酸代谢(alpha-Linolenic acid metabolism), MAPK信号通路-植物(MAPK signaling pathway- plant), 植物-病原体相互作用(Plant-pathogen interaction) (图8-b)。
综上所述, 在SA-SR与SR分组以及SR与对照分组中均显著富集的信号通路有: MAPK信号通路-植物(MAPK signaling pathway-plant)、α-亚麻酸代谢(alpha- Linolenic acid metabolism)、次生代谢物的生物合成(Biosynthesis of secondary metabolites)、泛醌和其他萜类化合物-醌生物合成(Ubiquinone and other terpenoid- quinone biosynthesis)等。
2.7 差异表达基因的荧光定量验证
为对转录组测序结果准确性进行验证, 采用qRT- PCR, 对10个注释到与叶绿体、类囊体以及光合作用相关的DEGs的表达量进行检测, 结果表明, 相关基因表达水平与RNA-Seq结果一致, 相关系数达到=0.78 (图9), qRT-PCR分析的结果证实转录组测序结果可靠。
3 讨论
本研究通过提前喷施水杨酸后接种小麦条锈菌的方法, 发现喷施水杨酸能够显著降低小麦幼苗条锈病的病情指数并提高其抗性, 说明水杨酸在一定程度上诱导小麦产生了抗病性, 与前人研究结果一致, 但生产中实现大规模应用所需浓度和剂量仍需进一步探究。
另外, 本研究通过对氨基酸含量检测发现, 小麦感染条锈病后叶片中氨基酸的含量普遍下降, 其中丝氨酸、苯丙氨酸和异亮氨酸的含量下降显著; 而提前喷施水杨酸的小麦叶片在感染后氨基酸含量与健康叶片无显著差异。已有研究表明, 水杨酸处理人参后接种人参锈腐菌, 脯氨酸的含量与仅接种人参锈腐菌的处理相比呈现升高趋势, 提高了人参抗锈腐病的能力[20]。由此可见, 条锈病显著降低了小麦植株氨基酸的含量。
转录组测序结果中, GO分析显示经过水杨酸处理与未处理的小麦条锈病幼苗的差异基因主要富集在与光合作用相关的生物过程中, 涉及的细胞组分包括叶绿体和类囊体, 上述细胞组分在植物的光合作用中发挥重要作用。小麦条锈幼苗(SR组)中与叶绿体和光合作用相关的基因分别上调663和263, 差异极显著。这可能是因为小麦叶片感染条锈菌后产生“黑洞效应”, 导致有效的光合作用面积减少, 另外气孔遭到破坏, 蒸腾作用增强, 影响叶绿素合成[21], 而植株为了通过光捕获实现有效的光合作用, 提高了光系统相关基因的表达, 从而提高叶绿素的含量和叶片的光捕获效率[22], 导致条锈病小麦幼苗中与光合作用及叶绿体等相关组分的基因显著上调。

表4 SA-SR vs SR前10个显著富集的GO term
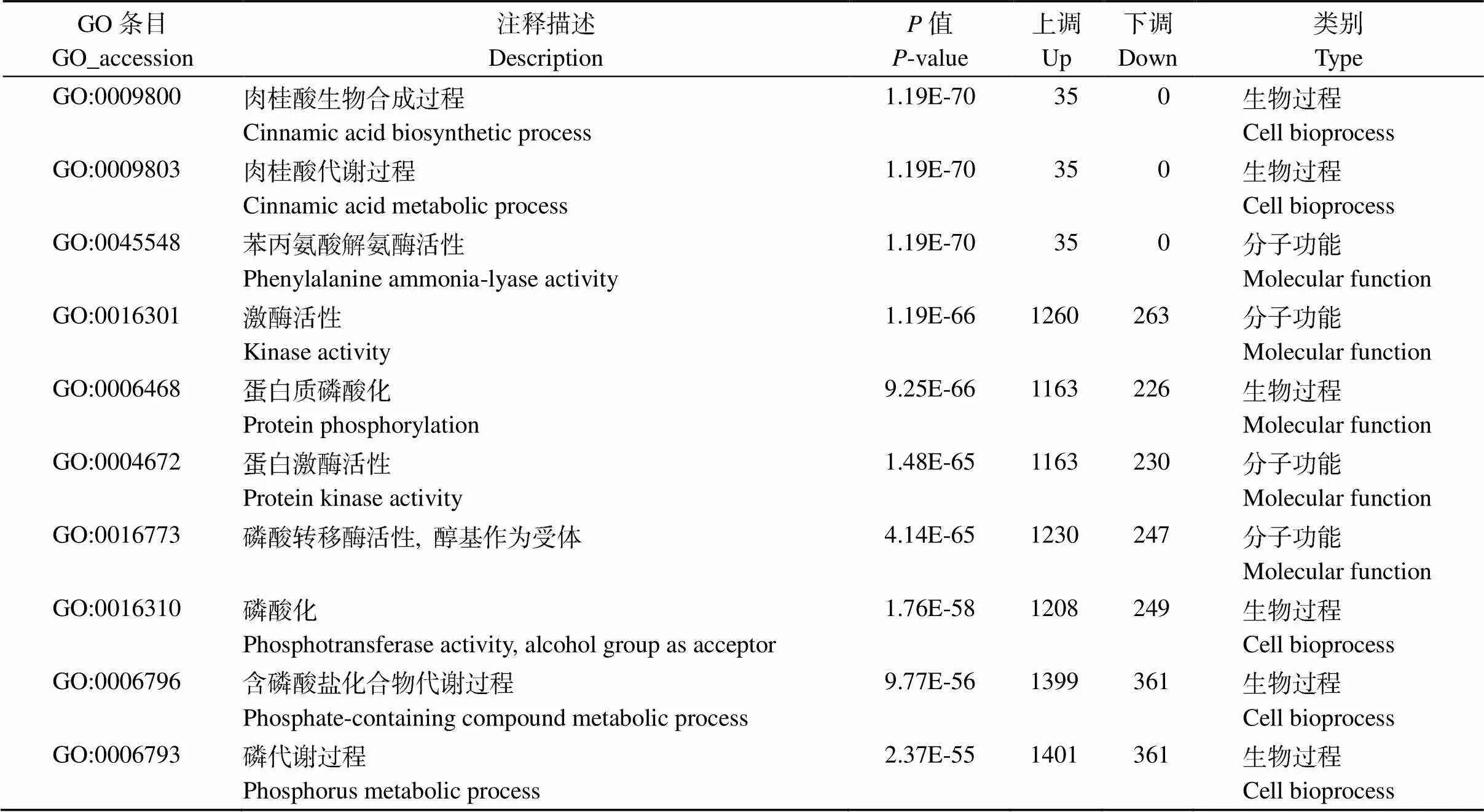
表5 SR与对照分组前10个显著富集的GO term

图7 不同组合中差异表达基因的GO富集分析
a: SA-SR vs SR; b: SR vs Control.
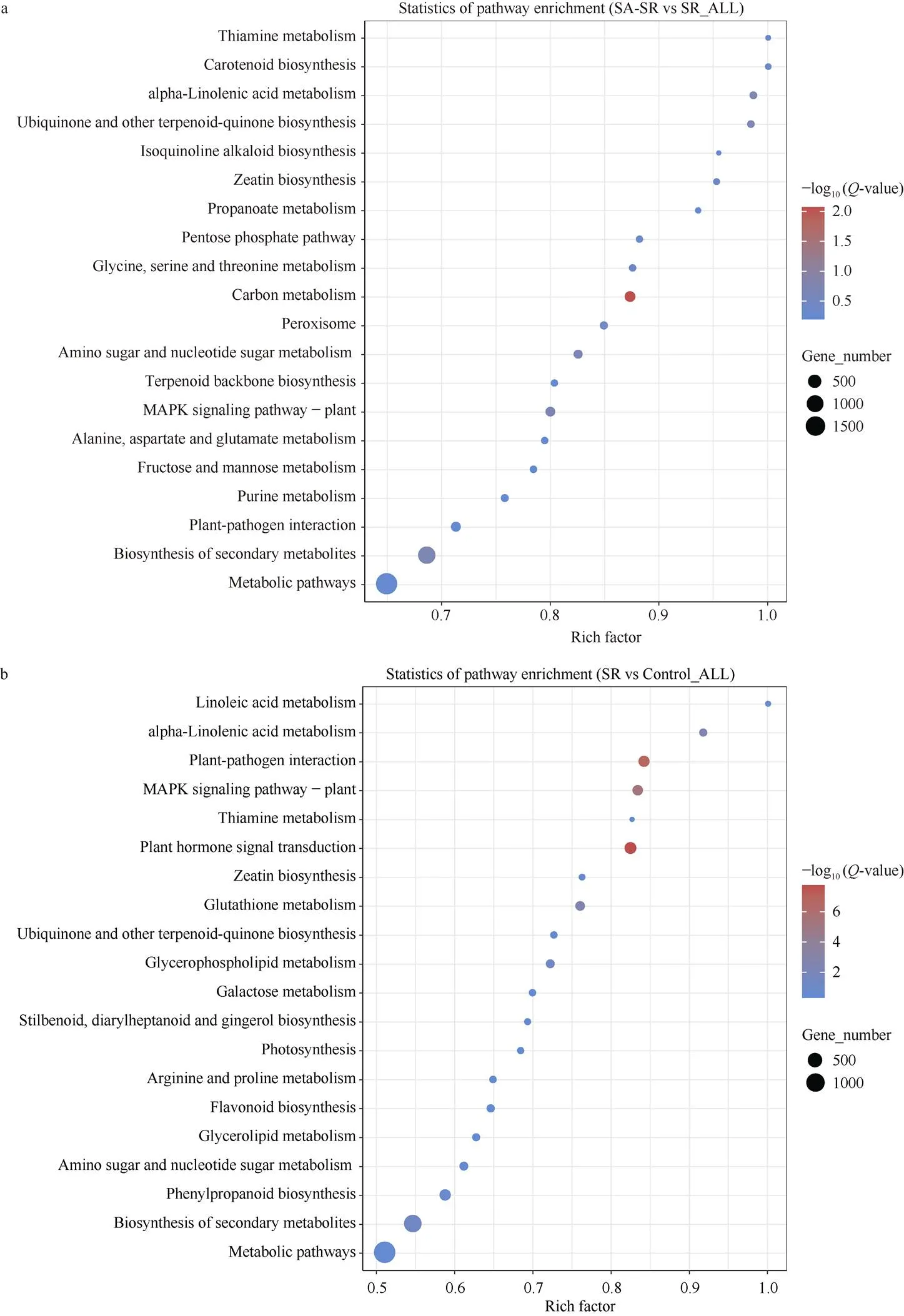
图8 两个比较组合差异基因的KEGG通路
a: SA-SR vs SR差异表达基因的KEGG通路富集分析; b: SR与对照分组差异表达基因的KEGG通路富集分析。
a: KEGG pathway enrichment analysis of differentially expressed genes in SA-SR vs SR. b: KEGG pathway enrichment analysis of differentially expressed genes in SR vs Control.
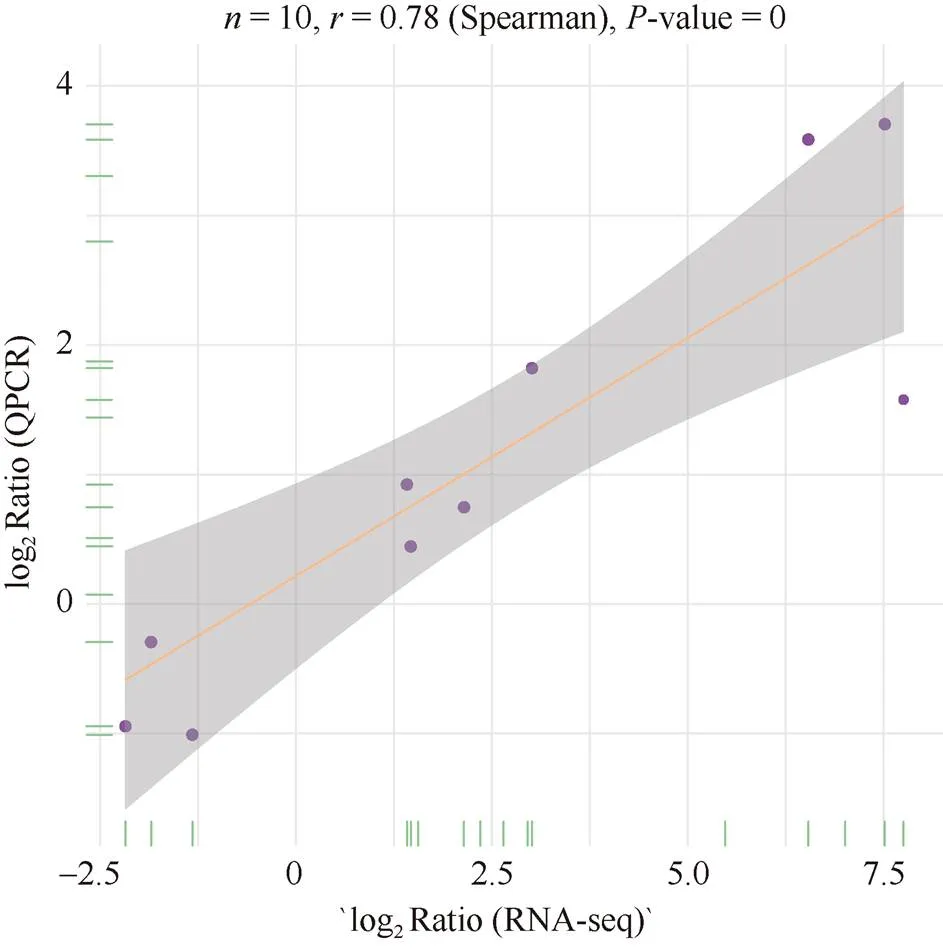
图9 RNA-seq和qRT-PCR的spearman相关性分析
本研究通过KEGG通路分析发现差异基因主要富集在次生代谢物的生物合成通路上。现有研究表明, 植物在生物和非生物胁迫情况下, 能够通过积累次生代谢物来提高防御能力[23], 而GO富集分析发现, 条锈病幼苗中苯丙氨酸解氨酶(PAL)基因表达量显著上调, 该酶是植物体内次生代谢物合成途径苯丙烷类代谢的限速酶及关键酶, 在植物抗病性中发挥着重要作用[24], 在PAL的作用下, 莽草酸途径中莽草酸的转化物苯丙氨酸生成具有杀菌作用的反式肉桂酸, 这与GO富集分析中肉桂酸的生物合成与代谢相关的基因显著上调吻合。由此可见, 感染条锈菌可能影响小麦次生代谢物生物合成过程中PAL的合成从而促进肉桂酸的产生来增强对小麦条锈菌的抗病能力。另有研究证实, 水杨酸处理可提高烟草、辣椒等植物体内PAL、CAT等抗性关键酶的活性, 增强植株对病原微生物的抵抗能力[25-26]。
除上述通路外, MAPK信号通路-植物同样显著富集。该信号通路主要参与植物的生长发育、生物和非生物胁迫反应、激素信号转导等过程[27]。丝裂原活化蛋白激酶(MAPK)是蛋白激酶的一种, 在所有真核生物中均可表达。当外源信号刺激植物后, 种机制被激活从而可促分裂原活化蛋白的激酶[28]。被磷酸化的MAPK可继续激活下游蛋白激酶和转录因子等底物, 如WRKY等。本研究发现小麦条锈病幼苗与对照组相比, 激酶活性及蛋白磷酸化相关基因的表达量显著上调, 并通过对共有差异基因进行植物转录因子分析, 发现主要集中在bHLH (427)、WRKY (326)等转录因子上, 上述激酶或转录因子调控相应功能基因的表达, 使植物细胞对外源信号产生特定的生理生化反应来应对环境变化[29]。关于小麦的MAPK信号通路研究较为滞后, 已有研究表明, TaMAPK4在经过水杨酸处理以及寄主植物感染小麦条锈菌之后显著增加, 可以提高小麦对条锈病的抗性[30]。另外MAPK信号通路的激活需要天冬氨酸、谷氨酸等氨基酸的参与, 本实验中氨基酸含量在不同分组中的变化可能也参与该通路的代谢调控过程。
[1] Wan A, Zhao Z, Chen X, He Z H, Li G B. Wheat stripe rust epidemic and virulence off. sp.in China in 2002., 2004, 88: 896–904.
[2] 万安民, 赵中华, 吴立人. 2002年我国小麦条锈病发生回顾. 植物保护, 2003, 2: 5–8. Wan A M, Zhao Z H, Wu L R. Reviews of occurrence of wheat stripe rust disease in 2002 in China., 2003, 2: 5–8 (in Chinese with English abstract).
[3] Miura K, Tada Y. Regulation of water, salinity, and cold stress responses by salicylic acid., 2014, 5: 4.
[4] Saleem M, Fariduddin Q, Janda T. Multifaceted role of salicylic acid in combating cold stress in plants: a review., 2021, 40: 464–485.
[5] Khalvandi M, Siosemardeh A, Roohi E, Keramati S. Salicylic acid alleviated the effect of drought stress on photosynthetic characteristics and leaf protein pattern in winter wheat., 2021, 7: e05908.
[6] Jayakannan M, Bose J, Babourina O, Zed R, Sergey S. Salicylic acid in plant salinity stress signalling and tolerance., 2015, 76: 25–40.
[7] White R F. Acetylsalicylic acid (aspirin) induces resistance to tobacco mosaic virus in tobacco., 1979, 99: 410–412.
[8] 范淑琴, 陈曦, 施永军, 陈宸, 黄奔立, 陈夕军. 水杨酸诱导黄瓜生长及对白粉病的防效. 中国瓜菜, 2020, 33(12): 77–81. Fan S Q, Chen X, Shi Y J, Chen C, Huang B L, Chen X J. Effect of salicylic acid on growth promotion of cucumber and control of powdery mildew., 2020, 33(12): 77–81 (in Chinese).
[9] 牛皓, 姜玉梅, 牛吉山. 小麦抗赤霉病遗传育种研究进展. 农业生物技术学报, 2020, 28: 530–542. Niu H, Jiang Y M, Niu J S. Research advances in the genetics and breeding of wheat () resistance to Fusarium Head Blight., 2020, 28: 530–542 (in Chinese with English abstract).
[10] Sakhabutdinova A R, Fatkhutdinova D R, Bezrukova M V. Salicylic acid alleviates leaf rust-inducible oxidative processes in wheat plants., 2008, 31: 895–903.
[11] 刘芃. 小麦水杨酸信号通路介导的抗条锈病机理研究. 西北农林科技大学硕士学位论文, 陕西杨凌, 2014. Liu F. Preliminary Studies on the Mechanism of Salicylic Acid Signaling Pathway in Wheat Resistance Against Stripe Rust Fungus. MS Thesis of Northwest Agriculture & Forestry University, Yangling, Shaanxi, China, 2014 (in Chinese with English abstract).
[12] Liu N, Xu Y, Li Q, Cao Y, Yang D, Liu S, Wang X, Mi Y, Liu Y, Ding C, Liu Y, Li Y, Yuan YW, Gao G, Chen J, Qian W, Zhang X. A lncRNA fine-tunes salicylic acid biosynthesis to balance plant immunity and growth., 2022, 30: 1124–1138.
[13] Liu J, Wu X, Fang Y, Liu Y, Bello E O, Li Y, Xiong R, Li Y, Fu Z Q, Wang A, Cheng X. A plant RNA virus inhibits NPR1 sumoylation and subverts NPR1-mediated plant immunity., 2023, 14: 3580.
[14] Brunet J, Mundt C C. Disease, frequency-dependent selection, and genetic polymorphisms: experiments with stripe rust and wheat., 2000, 54: 406–415.
[15] Peterson R F, Campbell A B, Hannah A E. A diagrammatic scale for estimating rust intensity on leaves and stems of cereals., 1948, 26: 496–500.
[16] 中华人民共和国食品安全国家标准. GB 5009.124-2016食品安全国家标准——食品中氨基酸的测定. 2016. National Food Safety Standards of China. GB 5009.124-2016 Determination of Amino Acids in Food of National Food Safety Standard. 2016 (in Chinese ).
[17] Bolger AM, Lohse M, Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data., 2014, 30: 2114–2120.
[18] Dobin A, Davis C A, Schlesinger F, Drenkow J, Zaleski C, Jha S, Batut P, Chaisson M, Gingeras T. STAR ultrafast universal RNA-seq aligner., 2013, 29: 15–21.
[19] Givanna H P, Simon A, Paul T P, John E P, Zanini F. Analysing high-throughput sequencing data in Python with HTSeq 2.0., 2022, 38: 2943–2945.
[20] 孙嘉曼, 傅俊范, 王燕平, 周如军, 严雪瑞. 外源水杨酸诱导人参抗锈腐病的生理机制. 沈阳农业大学学报, 2011, 42: 555–558. Sun J M, Fu J F, Wang Y P, Zhou R J, Yan X R. Physiological mechanism of ginseng resistant to ginseng rusty root rot induced by exogenous salicylic acid., 2011, 42: 555–558 (in Chinese with English abstract).
[21] Rabbinge R, Hoy M A. A Population model for two-spotted spider miteand its predator metaseiulus occidentalis., 1980, 28: 64–81.
[22] Pan X, Ma J, Su X, Cao P, Chang W R, Liu Z F, Zhang X Z, Li M. Structure of the maize photosystem I supercomplex with light- harvesting complexes I and II., 2018, 360: 1109–1113.
[23] Ullah C, Tsai C J, Unsicker S B, Xue L, Reichelt M, Gershenzon J, Hammerbacher A. Salicylic acid activates poplar defense against the biotrophic rust fungusincreased biosynthesis of catechin and proanthocyanidins., 2019, 221: 960–975.
[24] Gao Z M, Wang X C, Peng Z H, Zheng B, Liu Q. Characterization and primary functional analysis of phenylalanine ammonia-lyase gene from., 2012, 31: 1345–1356.
[25] Mandal S, Mallick N, Mitra A. Salicylic acid-induced resistance tof. sp.in tomato., 2009, 47: 642–649.
[26] 江厚龙, 李鹏, 李钠钾, 催伟伟, 张艳, 耿丽娜, 丁伟. 外源诱抗剂对烟草青枯病的诱抗效果研究. 中国农学通报, 2014, 30: 286–290. Jiang H L, Li P, Li N J, Cui W W, Zhang Y, Geng L N, Ding W. Inhibition effects of induced resistance on tobacco resistance to., 2014, 30: 286–290 (in Chinese with English abstract).
[27] Zhang M, Su J, Zhang Y, Xu J, Zhang S Q. Conveying endogenous and exogenous signals: MAPK cascades in plant growth and defense., 2018, 45: 1–10.
[28] Yin Z, Zhu W, Zhang X, Chen X, Ye W. Molecular characterization, expression and interaction of MAPK, MAPKK and MAPKKK genes in upland cotton., 2021, 113: 1071–1086.
[29] Rodriguez M C, Petersen M, Mundy J. Mitogen-activated protein kinase signaling in plants., 2010, 61: 621–649.
[30] Wang B, Song N, Zhang Q, Wang N, Kang Z S. TaMAPK4 acts as a positive regulator in defense of wheat stripe-rust infection., 2018, 9: 152.
Alleviative effect of salicylic acid on wheat seedlings with stripe rust based on transcriptome and differentially expressed genes
QI Xue-Li1,**, LI Ying2,**, LI Chun-Ying3, HAN Liu-Peng1, ZHAO Ming-Zhong1, and ZHANG Jian-Zhou3,*
1Crops Molecular Breeding Academy of Henan, Zhengzhou 450002, Henan, China;2Editorial Department of, Zhengzhou 450002, Henan, China;3Wheat Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China
In order to explore the mechanism of exogenous salicylic acid in improving the resistance of wheat stripe rust, using, the untreated wheat seedlings (control), stripe rust wheat seedlings (SR), and salicylic acid treated stripe rust wheat seedlings (SA-SR) as the experimental materials were investigated using Zhoumai 18. After 15 days of treatment, the wheat seedlings were identified for disease resistance, amino acid detection, transcriptome sequencing, and fluorescence quantification. The results indicated that the exogenous salicylic acid could significantly reduce the pathogenicity of stripe rust in wheat seedlings. The content of amino acids in leaves in the SR group was generally reduced, while there was no significant difference between the SA-SR group and the control group pretreated with salicylic acid, indicating that the content of amino acids in leaves was significantly reduced due to wheat stripe rust. GO enrichment indicated that the differentially expressed genes of SR and SA-SR groups were enriched in biological processes related to photosynthesis involving cell components such as chloroplasts and thylakoids. KEGG pathway enrichment showed that both SR and SA-SR subgroups were significantly enriched in the MAPK signaling pathway and the biosynthesis of secondary metabolites played an important role in plant disease resistance or stress resistance.
wheat stripe rust; salicylic acid; amino acid; transcriptom
10.3724/SP.J.1006.2024.31053
本研究由财政部和农业农村部国家现代农业产业技术体系建设专项(小麦, CARS-3-7)和河南省农业科学院自主创新项目(2022ZC03)资助。
This study was supported by the China Agriculture Research System of MOF and MARA (Wheat, CARS-3-7) and Independent Innovation Project of HAAS (2022ZC03).
张建周, E-mail: zhangjianzhou00@163.com
**同等贡献(Contributed equally to this work)
齐学礼, E-mail: xueliqi888@163.com; 李莹, E-mail: liying1233@163.com
2023-09-17;
2024-01-12;
2024-02-23.
URL: https://link.cnki.net/urlid/11.1809.S.20240222.1514.002
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

