海藻酸钠-聚乙烯包覆贝得石复合材料(SA-Bd@PE)去除低浓度铀酰试验研究*
张金梅,边 亮,3,宋绵新,张 琴,杨敬杰,3,聂嘉男,张 娇,罗伟恢,解 鑫,张 鹏
(1.西南科技大学 环境与资源学院,四川 绵阳 621010;2.西南科技大学 材料与化学学院,四川 绵阳 621010;3.西南科大四川天府新区创新研究院,四川 成都 610299)
0 引言
核能作为高效清洁能源,可以缓解资源匮乏困境[1]。随着核能的快速发展,铀得到了大量开采和加工利用,但是由于目前开采加工技术以及铀废水处理技术尚不成熟,因此含铀废水的总量逐渐增多。如含铀废水随着雨水、地下水和江河进入到环境中,将对动植物以及人体健康带来巨大威胁[2]。目前,一些国内外学者开展了高浓度(质量浓度大于50 mg/L)含铀废水的处理研究,并取得了一定进展[3-5],而对低浓度含铀废水的关注相对较少,且处理难度较大[6]。即使在水样中仅检测出了低浓度铀,但是其经过富集后也可能会带来不可忽视的危害[7]。低浓度含铀废水虽然浓度低,但回收总量大,如通过合理处置并加以有效利用,可以在一定程度上缓解环境压力和能源匮乏问题。
目前去除含铀废水的方法主要有沉淀法、膜分离法、离子交换法、生物法和吸附法等[8]。吸附法提铀因具有效率高、成本低、回收简单等特点而得到了广泛应用,而吸附材料是该方法的核心要素。大量研究表明,可以使用天然矿物作为原料制备吸附剂,其中蒙皂石族黏土矿物和海藻酸钠因储量丰富、结构独特以及吸附能力强而被视为优良的吸附剂制备原料。蒙皂石族黏土矿物中的蒙脱石比表面积和阳离子交换容量(56.37 m2/g,84.8 mmol/100 g)较伊利石(14.17 m2/g,9.7 mmol/100 g)、高岭石(12.4 m2/g,6.2 mmol/100 g)大,因而蒙脱石的吸附能力也更强[9]。XIAO等[10]研究发现纯样蒙脱石对UO22+的最大吸附量为39.96 mg/g,改性后的蒙脱石吸附量增加了约1倍(β-环糊精等离子和氧化铁改性蒙脱石的最大吸附量为74.52 mg/g)。结构相似的贝得石理论上可以和蒙脱石起到相同的作用,因为蒙脱石的铝氧八面体被硅氧八面体替代后就会变成贝得石。然而微生物产生的有机酸能够使蒙脱石的Al溶出,导致硅氧八面体比例升高。在实际处理含铀地下水时还应关注微生物作用,研究贝得石的吸附性能可以为未来的废水治理提供理论依据,而现阶段该方面的研究成果鲜有报道。海藻酸钠具有黏附性,其表面具有众多的官能团,因而被大量用于制备高级吸附剂;其具有良好的解吸功能,解吸次数对吸附能力的影响不大,在解吸后可以循环使用,因此海藻酸钠基材料具备可重复利用性[11]。但是纯的海藻酸钠表面平整,吸附性能不佳,可以选用适当的材料与其掺杂复合,以增强其对金属离子的吸附性[12]。ALLABOUN等[13]制备了碳纳米管-海藻酸钠并用于吸附UO22+,测得其吸附量为6.01 mg/g,吸附能力较弱。BELHOUCHAT等[14]利用活化的膨润土与海藻酸钠混合制备小球并用于去除水中的亚甲基蓝和甲基橙,结果表明其为高效且高潜力的吸附剂,对亚甲基蓝的最大吸附量达到了769 mg/g。肖燕萍等[15]利用三元材料(海藻酸钠/蒙脱石-零价铁颗粒)去除Cu(Ⅱ),发现24 h后的去除率为92.11%,处理效果较好。近年来,聚合物类材料作为铀的高效吸附剂得到了广泛研究,与其他吸附剂相比其表现出了较强的吸附能力和优异的选择性。邱龙等[16]研究发现偕胺肟基聚乙烯无纺布对U(Ⅵ)的最大吸附容量为71.92 mg/g。冯鑫鑫等[17]制备的偕胺肟基超高分子量聚乙烯纤维通过电子束来嫁接,发现其对UO22+的去除率达到了99.93%,表明该类材料具有很大的应用前景。
本文以海藻酸钠、贝得石作为主要原料,采用交联法制备复合材料SA-Bd@PE,并将其作为吸附剂,研究其对含UO22+废水的去除性能,探究不同pH溶液和接触时间对UO22+的吸附影响,并且分析了SA-Bd@PE对UO22+的吸附过程;选取不同分子量的PE作为添加剂,经过交联制备出结构更加松散、表面孔隙更多的复合材料,并比较3种复合材料的吸附性能。
1 材料与方法
1.1 主要仪器与试剂
1.1.1 主要仪器
傅里叶红外光谱仪(FTIR,Spectrum-1,PerkinElme),激光拉曼光谱仪(Raman,InVia,Renishaw),X射线衍射仪(XRD,X'pert PRO,Panaco,Inc.),扫描电子显微镜(SEM,TM3000,Hitachi),电感耦合等离子体发射光谱仪(ICP-OES,Plasma 3000,钢研纳克),Zeta电位及纳米粒度分析仪(Zeta,Zetasizer Nano Zs90,Mal-vern)。
1.1.2 主要试剂
海藻酸钠[SA,富辰(天津)化学试剂有限公司],贝得石(Bd,美国黏土协会),聚乙烯粉末(PE,北京市祥瑞化工有限公司)(0分子量、5 000分子量、100 000分子量),六水硝酸铀酰[UO2(NO3)2·6H2O,≥99.5%,西安鼎天化工有限公司]。
1.2 试验方法
1.2.1 复合材料SA-Bd@PE的制备
采用交联法制备复合材料SA-Bd@PE。将贝得石(1.5 g)与琼脂(1 g)加入沸水中溶解并超声分散30 min后取出备用;称取海藻酸钠1 g加入其中并在不断加热的情况下持续搅拌30 min,再冷却至50 ℃,用50 mL注射器将其注入氯化钙溶液中,固化12 h即完成复合材料SA-Bd@PE的制备,最后用去离子水清洗3次后风干备用。加有聚乙烯粉末的复合材料制备方式与上述相似,只是Bd和PE的质量和为1.5 g,PE在加热完成后冷却至50 ℃,再加入搅拌均匀后固化。
1.2.2 配制含铀废水
称取六水硝酸铀酰1.86 g,溶解并转移至棕色容量瓶中,再用去离子水定容至1 L后得到1 g/L的UO22+溶液,避光保存。不同浓度的UO22+溶液是通过取一定量1 g/L的UO22+溶液用去离子水稀释得到的。不同pH的UO22+溶液则是用NaOH(0.1 mol/L)和HCl(0.1、1 mol/L)调节得到试验所需的模拟含铀废水。
1.2.3 吸附试验
吸附试验是用制备的复合材料SA-Bd@PE(约0.05 g)吸附50 mL已知UO22+浓度的溶液(0~50 mg/L),常温常压下吸附一定时间(2~10 h)后用ICP-OES测得溶液中剩余离子浓度。利用NaOH和HCl调节制备pH=1~9的UO22+溶液。
1.2.4 试验数据处理
为了确定复合材料SA-Bd@PE在吸附试验中的吸附机理和吸附过程,采用动力学模型和等温吸附模型对试验数据进行拟合。伪一级动力学模型见式(1),伪二级动力学模型见式(2),Langmuir等温吸附模型见式(3),Freundlich等温吸附模型见式(4),Dubinin-Radushkevich等温吸附模型见式(5)。
(1)
(2)
式中:qe为吸附剂的平衡吸附量,mg/g;qt为吸附过程中t时吸附剂对目标元素的瞬时吸附量,mg/g;t为吸附时间,min;Kf为伪一级吸附速率常数(min-1)和伪二级吸附速率常数[g/(mg·min)]。
(3)
(4)
(5)
式中:Ce为平衡时溶液的质量浓度,mg/L;qm为饱和吸附量,mg/g;KL为Langmuir等温吸附模型的吸附常数,L/mg;C0为溶液的初始质量浓度,mg/L;KF为Freundlich等温吸附模型的吸附常数,mg/g·(L/mg)1/n,n为经验常数;β为Dubinin-Radushkevich等温吸附模型的吸附自由能的吸附常数,mol2/kJ2;ε为波兰尼电位;R为理想气体常数,8.314 J/(mol·K);T为吸附过程中的绝对温度,K。
Langmuir模型由平衡常数RL的值来判断吸附特性,当值为1时认为吸附是线性吸附,大于1时吸附难以进行,0~1时认为吸附容易进行。Freundlich模型是一个经验公式,根据拟合后的n值确定吸附强度,当n值大于1时表明吸附容易进行,且n值越大说明吸附性能越好。Dubinin-Radushkevich模型则根据平均吸附能的大小来判定吸附机理,根据公式可以计算出平均吸附能Ea,其小于8 kJ/mol是物理吸附,其大于8 kJ/mol是化学吸附。
1.2.5 分析测试方法
采用傅里叶红外光谱仪(FTIR)与激光拉曼光谱仪(Raman)确定SA-Bd@PE的键合情况,通过X射线衍射仪(XRD)确定SA-Bd@PE的具体物相结构,采用扫描电子显微镜(SEM)观察SA-Bd@PE表面的结构形貌,采用电感耦合等离子体发射光谱仪(ICP-OES)测定用SA-Bd@PE去除UO22+后的溶液中剩余离子浓度。
2 结果与讨论
2.1 结构表征
由交联法制备的复合材料SA-Bd@PE和Bd的XRD图谱见图1。
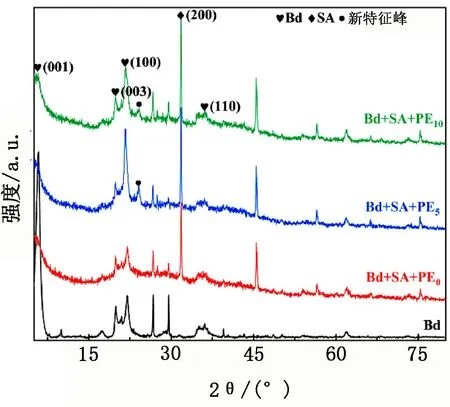
图1 复合材料SA-Bd@PE和Bd的XRD图
由图1可知,2θ为5.84°、19.94°、21.98°和36.12°处是Bd的典型特征衍射峰,其所对应的晶面分别为(001晶面)、(003晶面)、(100晶面)和(110晶面)[18]。从SA-Bd@PE的XRD图谱中可以发现Bd的(001晶面)减弱甚至消失不见,而(100晶面)出现了特征峰增强的情况。这是因为在交联过程中产生了大量的热,使得矿物结构在受热后(001晶面)发生了坍塌,同时加入PE后材料的孔隙率降低而使(100晶面)衍射峰出现微弱的增强。通常情况下,SA在2θ为14°、23°、31.5°和39.5°时有衍射峰出现,然而在图1中并未发现14°、23°和39.5°处相应的衍射峰,这可能是在交联过程中海藻酸钠发生了化学变化,阻止了其结晶行为[19],但是2θ=31.5°处的衍射峰未发生明显变化。同时在2θ=24.12°处出现了新的特征峰,其为Ca2CO3特征峰,说明SA表面的(-COOC-)基团在固化过程中与Ca2+发生了络合反应[20]。
根据分子振动光谱图可以确定物质结构表面上的化学基团以及键合情况,Bd和复合材料SA-Bd@PE的FTIR和Raman图分别见图2a、图2b。
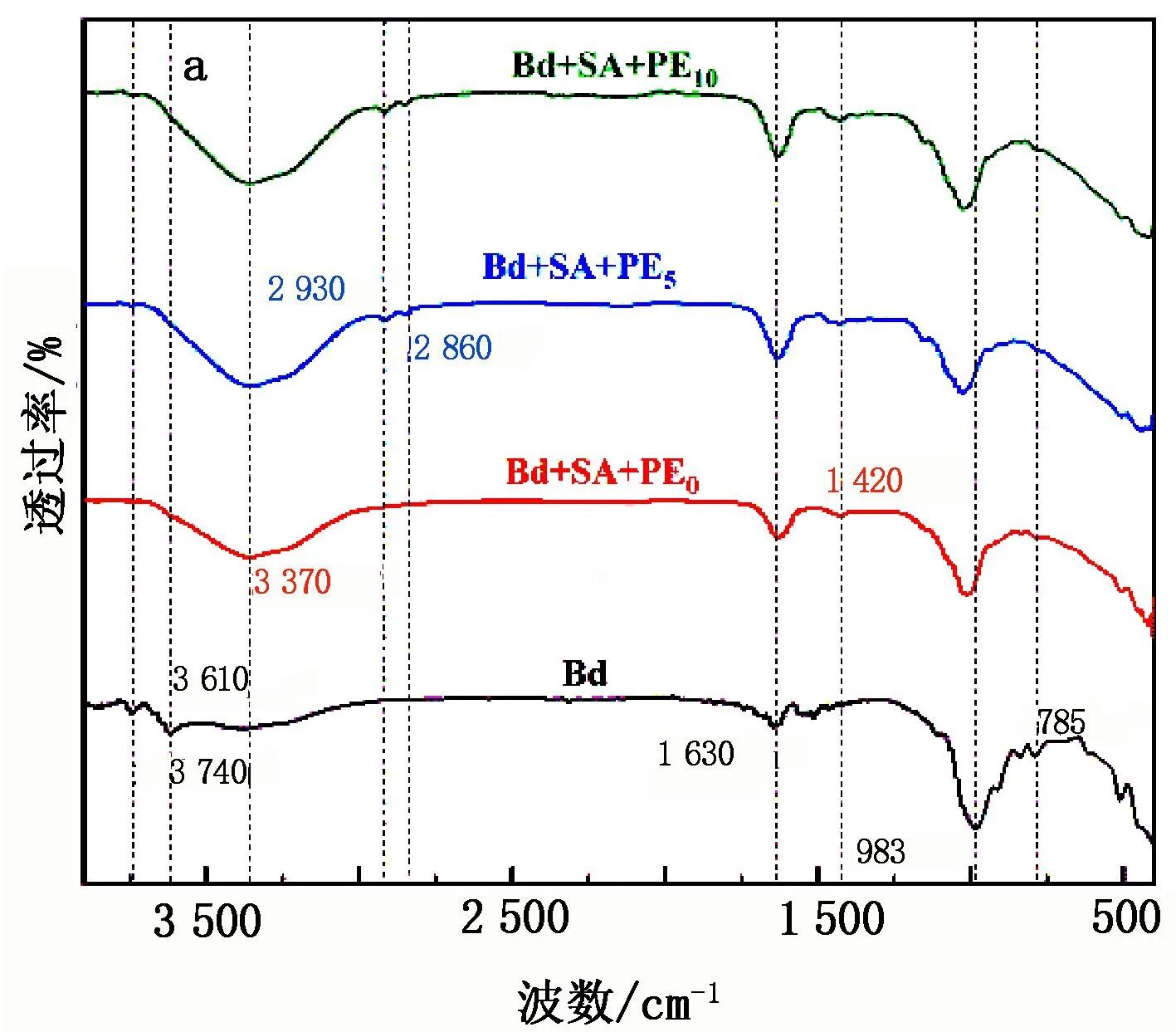
图2 Bd和复合材料SA-Bd@PE的FTIR和Raman图
由图2a可知,Bd的吸收峰(3 740 cm-1,层间水分子的伸缩振动;3 610 cm-1,O-H伸缩振动,层状硅酸盐的特征峰;1 630 cm-1,层间水分子的弯曲振动;983 cm-1,Si-O-Si伸缩振动;785 cm-1,C-H向外弯曲振动)[21]出现在SA-Bd@PE上。同时SA的吸收峰(3 370 cm-1,N-H伸缩振动;1 420 cm-1,C-C单键骨架振动)[22]和PE产生的基团(2 930 cm-1,亚甲基;2 860 cm-1,次甲基上的C-H伸缩振动引起[23],然后亚甲基和次甲基进一步与游离的-OH生成羧基)也出现在SA-Bd@PE上。这说明了SA、PE进入了贝得石的层间结构并与SA、PE上的官能团发生了相互作用。由图2b可知:在波段1 700~2 500 cm-1处,加入PE后材料的拉曼活性减弱,因为烯烃的C=C和羧基的C=O伸缩振动使得材料结构更加松散,从而导致孔隙增多,可变性增强;在969 cm-1(碳原子间的非对称伸缩振动)处特征峰增强,这是由906 cm-1处醚基的C-O-C对称振动和969 cm-1处烯烃的碳原子间非对称伸缩振动叠加所致;1 162 cm-1处特征峰是由PE和SA上烯烃的C=C伸缩振动叠加形成,同时出现峰位红移,红移是由C=C的共振所致,且在此处PE拉曼活性更强,这是因为PE含有更多的C=C。
为了从宏观上探究SA-Bd@PE材料发生吸附的机理,对其进行了电子扫描,结果见图3。由图3a可以看出,结构变化后形成细小颗粒的Bd均匀分布于SA上,使得SA表面更加粗糙并增加了吸附位点,但是出现了一定的团聚现象,可能是由SA的黏附性导致的。由图3b、图3c可以看出,SA-Bd附着于PE表面,分布不均,但改善了团聚现象。根据红外图谱得出的PE产生了羧基官能团可以解释图3c中PE的大孔洞现象,也说明在增加材料吸附位点的同时产生了官能团来吸附UO22+。

图3 Bd+SA+PE0(a)、Bd+SA +PE5(b)、Bd+SA +PE10(c)、Bd(d)和PE(e)的SEM图
2.2 UO22+的吸附研究
2.2.1 pH对吸附的影响
U的存在形式与溶液pH有关,从而影响材料对UO22+的吸附(见图4)。
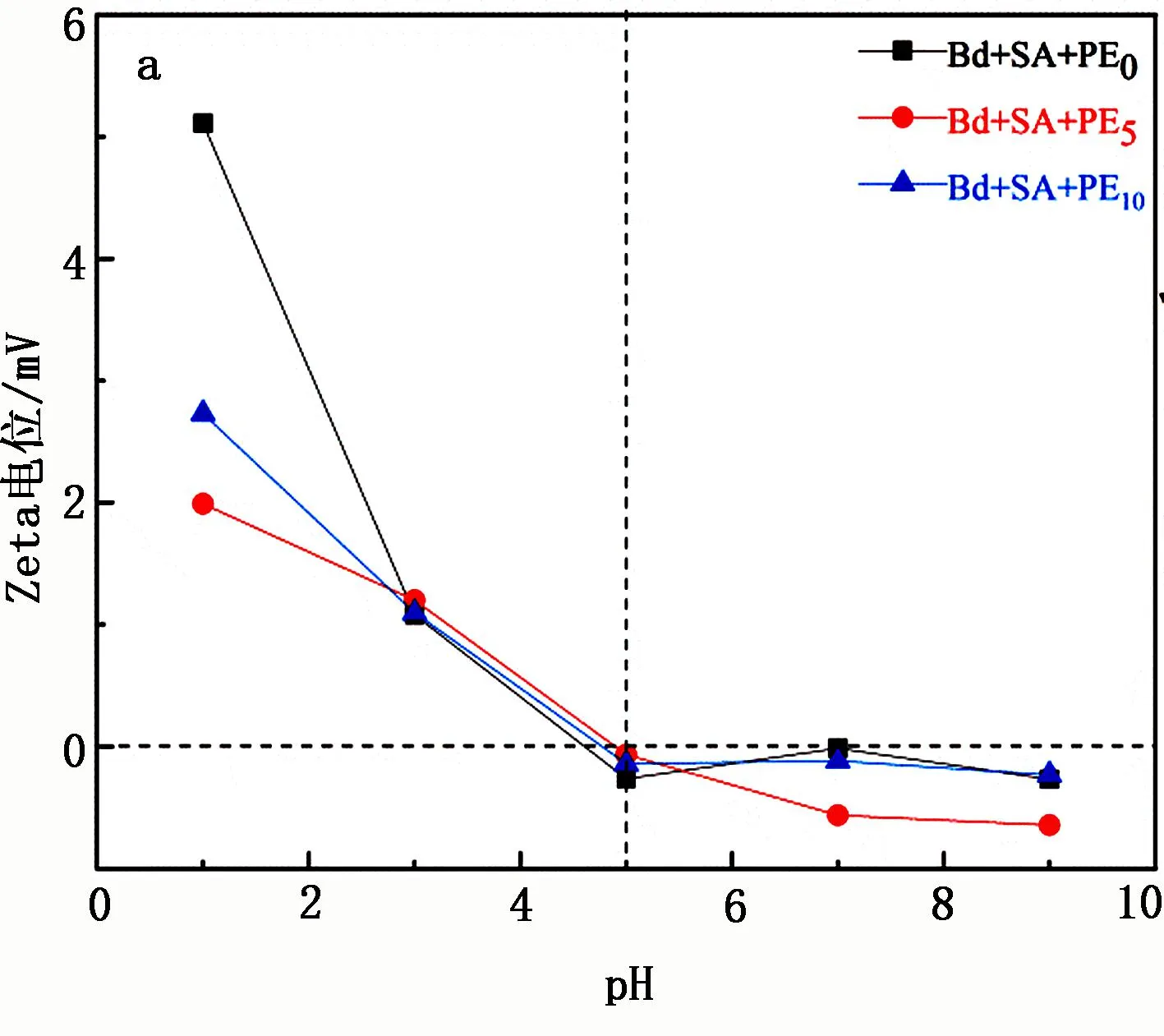
图4 SA-Bd@PE的Zeta电位(a)、溶液pH(b)对SA-Bd@PE吸附UO22+的影响
由图4a可知:随着溶液pH的增大,电位呈下降趋势,3种材料均在pH约为5时表面的正负电荷均等;pH<5时材料表面发生质子化,此时材料表面带正电;随着质子化作用的减弱,在pH=5~9时材料表面带负电。由图4b可知:在pH=1~5时,材料对UO22+的吸附量逐渐增大,在pH=5时达到最大值55 mg/g,而SA-Bd@PE0的吸附量最小,仅为29 mg/g。在pH<5时,溶液中有大量的H+存在,其与UO22+发生静电力作用,并产生了竞争,同时又因为材料表面在酸性溶液中有较强的质子化作用,使得UO22+不易吸附在材料上,导致吸附量较少。PE的加入改善了材料的团聚现象并且表面带有官能团,为UO22+提供了更多的吸附位点,这也是SA-Bd@PE吸附量增加的原因。
2.2.2 吸附动力学
SA-PE@Bd在不同反应时间下的吸附效果见图5(虚线为实际情况,实线为拟合情况)。
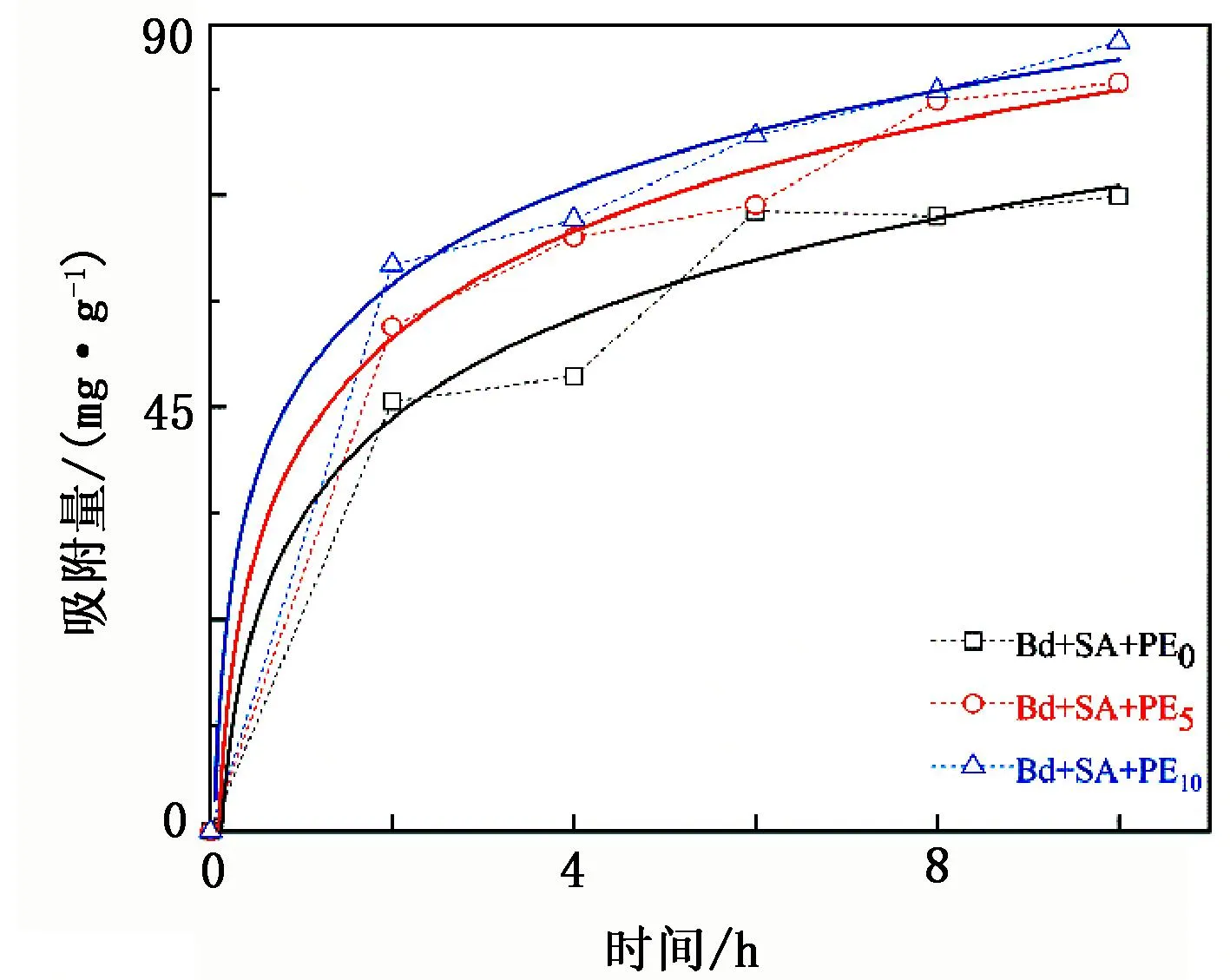
图5 不同接触时间对复合材料SA-Bd@PE吸附UO22+的影响
由图5可知:前2 h内材料吸附量快速增加,这是因为在吸附初期UO22+能迅速大量占据材料上的附着点,从而使吸附迅速发生;2 h后,吸附量缓慢增加,是因为材料的吸附位点达到饱和后,游离的官能团发挥了作用。从图5中还可以看出,添加了PE的复合材料吸附量更大,是因为PE使得材料的结构松散,表面粗糙,且减少了SA-Bd@PE0的团聚现象,因此提供了更多的吸附位点来增加其对UO22+的吸附。为更好地了解材料对UO22+的吸附过程,使用伪一级和伪二级动力学模型对试验数据进行拟合分析,结果见图6,拟合参数见表1。由图6、表1可知,伪二级动力学模型(R2=0.99)比伪一级动力学模型(R2=0.73~0.85)更符合该吸附过程,且吸附量与试验值接近(41.07、43.54、49.71 mg/g),由此表明SA-Bd@PE吸附UO22+的过程为化学吸附。
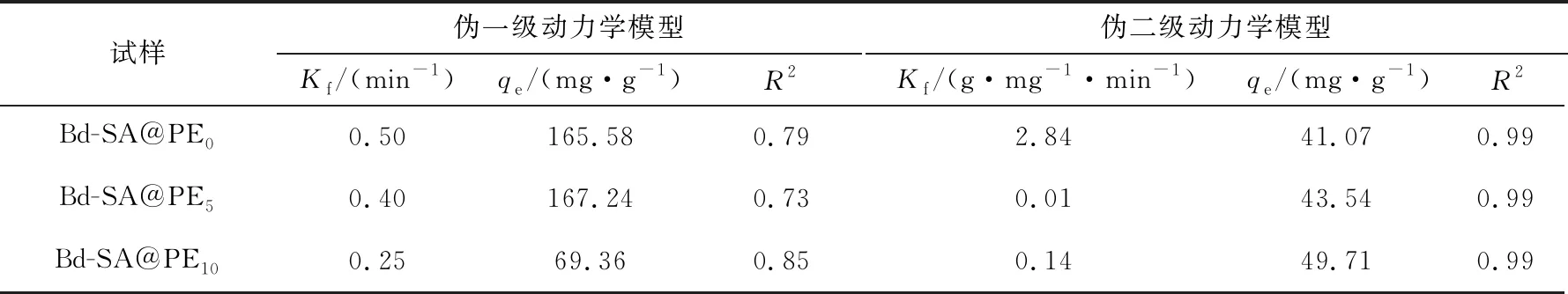
表1 SA-Bd@PE吸附UO22+的动力学参数
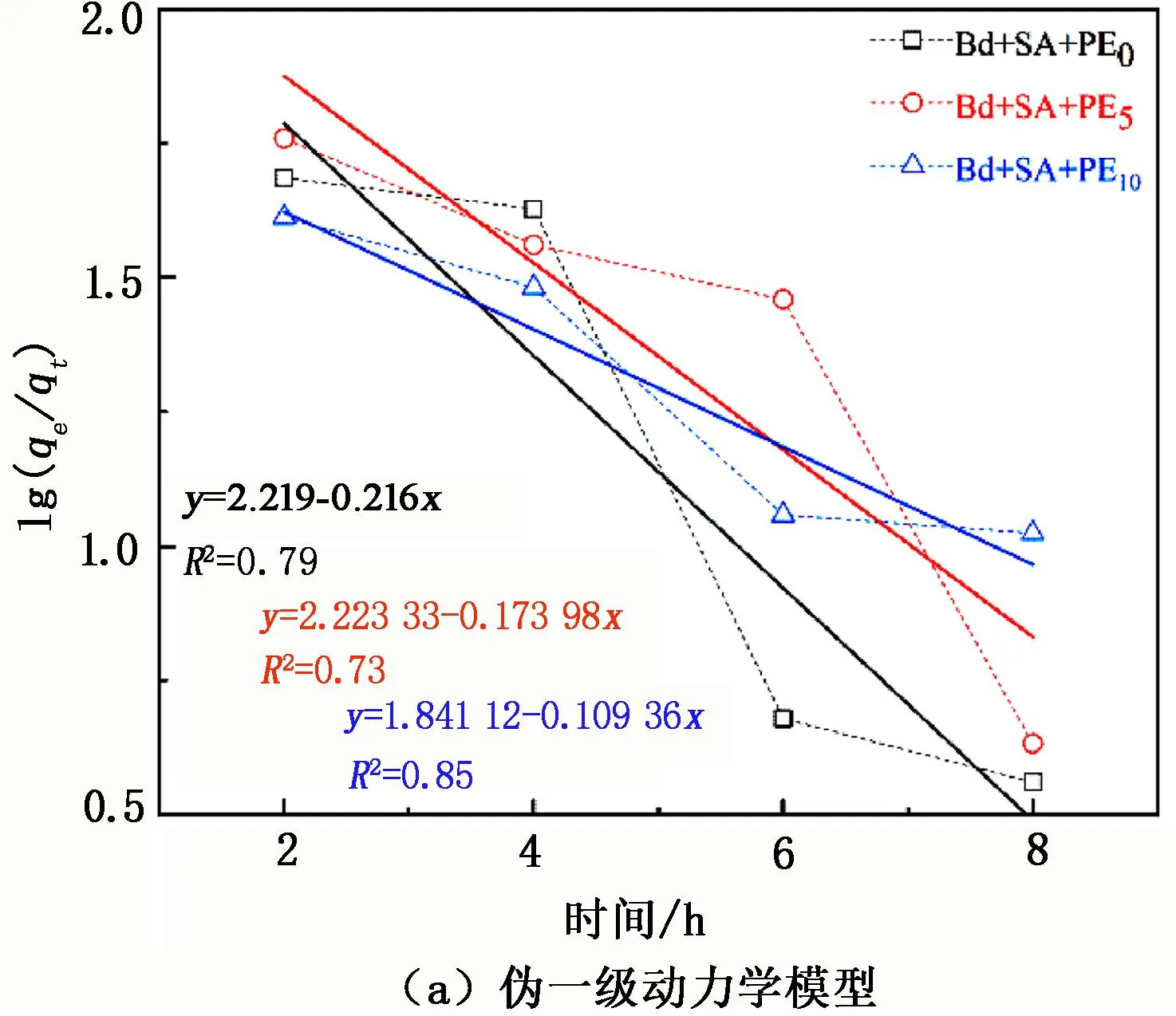
图6 SA-Bd@PE吸附UO22+的动力学模型拟合曲线
2.2.3 等温吸附曲线
利用等温吸附模型对试验结果进行拟合,据此分析UO22+在溶液中的吸附行为。采用Langmuir模型、Freundlich模型和Dubinin-Radushkevich 模型分别描述材料与UO22+的吸附平衡状态,拟合结果见图7,拟合参数见表2。由图7、表2可知,Langmuir模型(R2=0.98~0.99)比另外两种模型(R2=0.05~0.98)更符合该吸附过程,且吸附量与试验值接近(41.32、45.61、46.78 mg/g),表明SA-Bd@PE吸附UO22+的过程为表面单层吸附。PE材料的吸附量大于Bd-SA@PE0,说明PE提高了复合材料对UO22+的吸附能力。
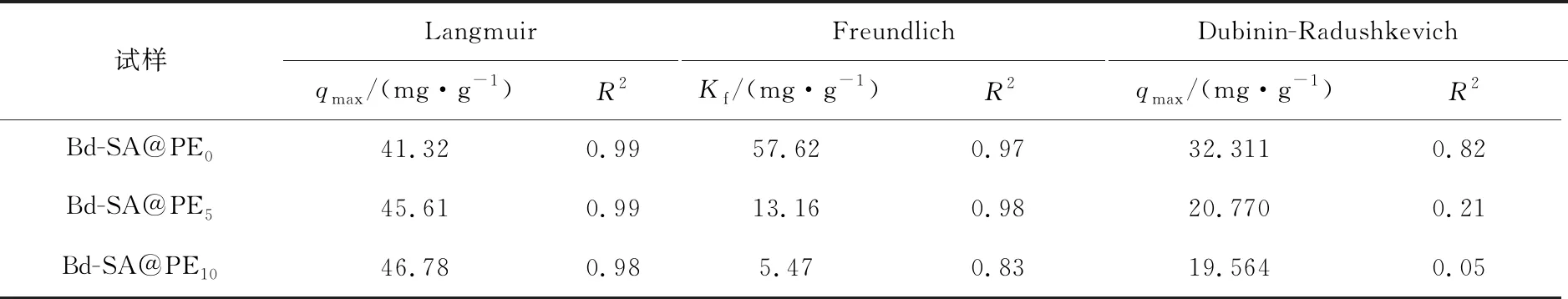
表2 SA-Bd@PE在25 ℃下吸附UO22+的 Langmuir、Freundlich和Dubinin-Radushkevich等温吸附参数
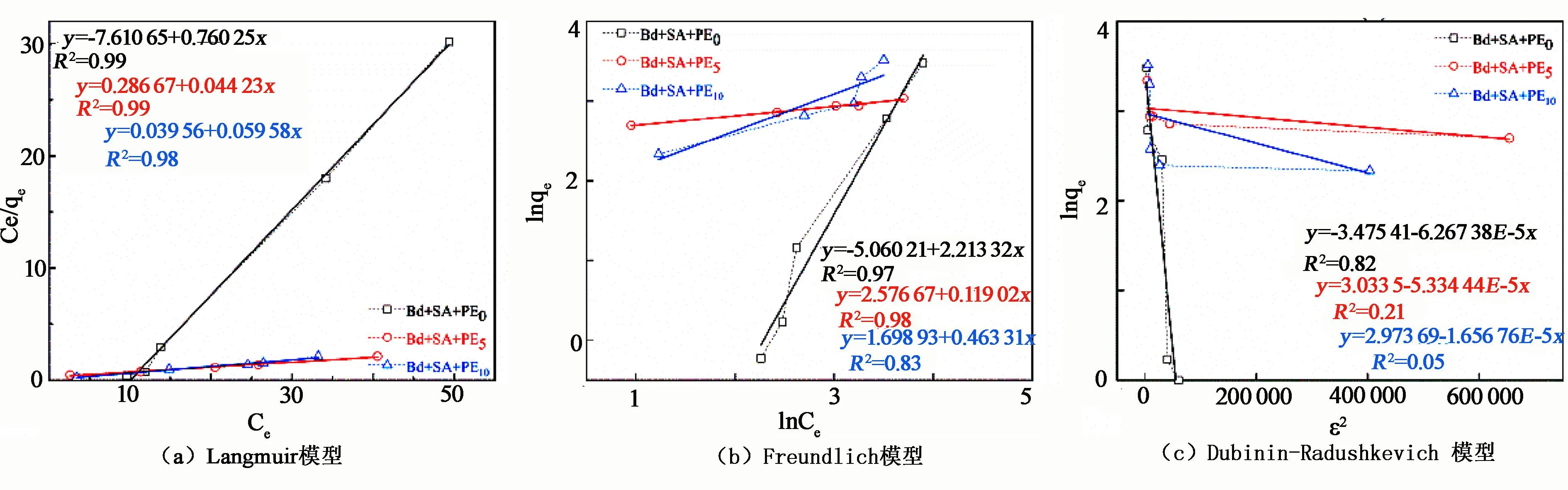
图7 SA-Bd@PE吸附UO22+的Langmuir模型(a)、Freundlich模型(b)和Dubinin-Radushkevich 模型(c)拟合曲线
3 结论
本文成功制备出了SA-Bd@PE三元复合材料,通过吸附试验研究了其对UO22+的吸附行为,得到以下主要结论:
a.添加PE可以使材料结构变得松散,从而得到更加粗糙的表面,使得吸附位点增加。
b.通过研究pH对试验的影响发现,当pH=5时吸附效果最佳,吸附量达到峰值55 mg/g。
c.动力学模型拟合结果显示,SA-Bd@PE复合材料与伪二级动力学模型的拟合度高达0.99,表明该吸附行为以化学吸附为主。
d.等温吸附模型拟合结果显示,SA-Bd@PE复合材料与Langmuir等温模型的拟合度高达0.99,表明材料吸附方式为表面单层吸附。
e.3种材料的吸附性能优劣排序为:Bd-SA@PE10(49.71 mg/g)> Bd-SA@PE5(43.54 mg/g)> Bd-SA@PE0(41.07 mg/g)。相较于偕胺肟基聚乙烯无纺布等聚乙烯类材料,该复合材料简化了制备过程,其机械强度高、成本较低且吸附效果好。

