长链非编码RNA人类白细胞抗原复合体18通过微RNA-497-5p/细胞周期蛋白E1轴调节弥漫性大B细胞淋巴瘤的增殖、凋亡和侵袭
廖子龙,向国强,陈绘迦
作者单位:恩施土家族苗族自治州中心医院血液病科,湖北 恩施445000
弥漫性大B细胞淋巴瘤(DLBCL)是一种在遗传发现、治疗反应和临床预后方面具有高度异质性的肿瘤[1]。尽管治疗策略的进步,如脂质体多柔比星和利妥昔单抗,大大提高了DLBCL的治疗效果,但总体5年生存率仍较低[2]。因此,进一步研究与DLBCL发病机制有关的治疗靶点可能会为DLBCL的有效治疗提供更多的机会。大量证据显示,长链非编码RNA(lncRNA)失调与肿瘤的进展密切相关[3]。人类白细胞抗原复合体18(HCG18)是一种新发现的lncRNA,已有研究发现,HCG18在胃癌、咽喉癌中高表达,且可促进肿瘤的进展[4-5]。而HCG18对DLBCL细胞恶性生物学行为的影响尚不清楚。此外,lncRNA可以充当ceRNA通过海绵化miRNA来调节基因表达,进而在许多疾病中发挥关键作用[6]。生物信息学分析发现HCG18与微小RNA-497-5p(miR-497-5p)、miR-497-5p与细胞周期蛋白E1(cyclin E1,CCNE1)存在结合位点。相关研究显示,过表达miR-497-5p可抑制胰腺癌细胞增殖[7],CCNE1在DLBCL中发挥致癌作用[8]。而HCG18能否通过调控miR-497-5p/CCNE1轴影响DLBCL恶性进展尚不可知。因此,本研究拟从细胞水平上探究HCG18对DLBCL细胞行为的影响以及对应的分子机制。
1 材料与方法
1.1 临床样本及细胞 以2018年5月至2021年5月恩施土家族苗族自治州中心医院收集的23例DLBCL病人淋巴组织以及同期本院收治的23例良性淋巴结增生病人的淋巴组织为研究对象。病人或其近亲属已知情同意,本实验符合《世界医学协会赫尔辛基宣言》要求。
人正常B细胞永生化细胞HMy2.CIR、DLBCL细胞系SU-DHL-1、OCI-LY8、U2932均购自上海烜雅生物公司。
1.2 主要试剂 CCK-8试剂盒购自杭州昊鑫生物公司(货号HY-K0301),Annexin V-FITC细胞凋亡试剂盒购自沈阳万类生物公司(货号WLA001),兔源一抗CCNE1、甘油醛-3-磷酸脱氢酶(GAPDH)、Bcl-2相关X蛋白(Bax)、增殖细胞核抗原(PCNA)、基质金属蛋白酶9(MMP-9)及羊抗兔IgG二抗均购自英国Abcam公司(货号ab33911、ab32503、ab29、ab8245、ab76003、ab6721)。
1.3 实验分组 将HMy2.CIR、OCI-LY8、SU-DHL-1、U2932细胞在RPMI 1640培养基中培养。取对数生长期的OCI-LY8细胞,分别将过表达物阴性对照(pcDNA)、HCG18过表达物(pcDNA-HCG18)、小干扰RNA阴性对照(si-NC)、HCG18小干扰RNA(si-HCG18)、si-HCG18和抑制物阴性对照(inhibitorNC)、si-HCG18和miR-497-5p 抑制物(miR-497-5p inhibitor)转染于OCI-LY8细胞,并分组为pcDNA组、pcDNA-HCG18组、si-NC组、si-HCG18组、si-HCG18+inhibitorNC组、si-HCG18+miR-497-5p inhibitor组。另取正常培养的OCI-LY8细胞作为Ct组。转染48 h后收集各组细胞进行实验。
1.4 qRT-PCR检测HCG18、miR-497-5p表达TRIzol试剂提取总RNA,总RNA反转录为cDNA后进行PCR反应。通过2-ΔΔCt法分别以GAPDH、U6为内参计算HCG18、miR-497-5p相对表达量。引物为GAPDH正向5'-AAAGGGTCATCATCTCTG-3',反向5'-GCTGTTGTCATACTTCTC-3',HCG18正向5'-GCTAGGTCCTCTACTTTCTG-3',反向5'-CAGAAAGTAGAGGACCTAGC-3',miR-497-5p正向5'-CCTTCA GCAGCACACTGTGG-3',反向5'-CAGTGCAGGGTC CGAGGTAT-3',U6正向5'-CTCGCTTCGGCAGCACA-3',反向5'-AACGCTTCACGAATTTGCGT-3'。
1.5 细胞增殖的检测 将细胞接种在96孔板(1×104个/孔)中,并在37 ℃、5%二氧化碳下培养48 h。然后,去除上清液,使用无血清新鲜培养基以10∶1的比例稀释CCK-8溶液。各孔加入100 µL CCK-8溶液孵育1 h后测量450 nm处的吸光度[D(λ)450nm]。
1.6 细胞凋亡的检测 调节细胞浓度至7×104个/毫升。然后用500 µL结合缓冲液、5 µL Annexin-V-FITC和5 µL PI重悬细胞。在4 ℃下避光孵育15 min,观察细胞凋亡。
1.7 细胞侵袭的检测 将细胞稀释至2×105个/毫升并悬浮到预涂有基质胶的上室中,再向下室加入含12%胎牛血清的RPMI 1640培养基。孵育24 h后,用多聚甲醛固定、0.1%结晶紫染色侵袭的细胞,观察并统计细胞侵袭数。
1.8 PCNA、CCNE1、Bax、MMP-9蛋白的检测RIPA缓冲液提取蛋白。取30 µg蛋白经定量、电泳、转模、封闭处理后,将膜在4 ℃下与一抗PCNA(1∶5 000)、CCNE1(1∶4 000)、Bax(1∶2 000)、GAPDH(1∶5 000)、MMP-9(1∶2 000)过夜孵育,再与二抗(1∶5 000)孵育1.5 h。加入ECL观察蛋白印迹,Image J软件统计蛋白表达情况。
1.9 靶向关系验证 分别构建HCG18、CCNE1野生型质粒和突变型质粒,并命名为HCG18-WT、CCNE1-WT、HCG18-MUT、CCNE1-MUT,将HCG18-MUT、HCG18-WT、CCNE1-MUT、CCNE1-WT分别与miR-497-5pmimic或mimic NC共转染于OCI-LY8细胞,48 h后,评估萤光素酶活性变化。
1.10 统计学方法 SPSS 29.0软件用于统计分析,以表示数据。独立样本t检验用于两组间比较,单因素方差分析及事后SNK-q检验用于多组间的比较,P<0.05为差异有统计学意义。
2 结果
2.1 HCG18、miR-497-5p表达及CCNE1蛋白表达比较 与良性淋巴结增生病人淋巴组织比较,DLBCL淋巴组织中HCG18、CCNE1蛋白表达升高,miR-497-5p表达降低(P<0.05),见图1,表1。与HMy2.CIR细胞相比,SU-DHL-1、OCI-LY8、U2932细胞中HCG18表达及CCNE1蛋白表达上调,miR-497-5p表达下调,且HCG18表达及CCNE1蛋白表达量最高,以及miR-497-5p表达量最低的细胞是OCI-LY8细胞,因此,选取OCI-LY8细胞进行转染实验,见图2,表2。
表1 HCG18、miR-497-5p、CCNE1蛋白在淋巴组织中的表达/

表1 HCG18、miR-497-5p、CCNE1蛋白在淋巴组织中的表达/
注:DLBCL为弥漫性大B细胞淋巴瘤,HCG18为人类白细胞抗原复合体18,miR-497-5p为微RNA-497-5p,CCNE1为细胞周期蛋白E1,GAPDH为甘油醛-3-磷酸脱氢酶。
CCNE1/GAPDH 0.23±0.02 1.45±0.14组别良性淋巴结增生病人淋巴组织DLBCL淋巴组织例数23 23 HCG18 1.00±0.00 2.36±0.15 miR-497-5p 1.00±0.00 0.18±0.02 41.37<0.001 t值P值43.48<0.001 196.63<0.001
表2 HCG18、miR-497-5p、CCNE1蛋白在OCI-LY8细胞中的表达/

表2 HCG18、miR-497-5p、CCNE1蛋白在OCI-LY8细胞中的表达/
注:HCG18为人类白细胞抗原复合体18,miR-497-5p为微RNA-497-5p,CCNE1为细胞周期蛋白E1,GAPDH为甘油醛-3-磷酸脱氢酶。①与HMy2.CIR细胞比较,P<0.05。
CCNE1/GAPDH 0.29±0.02 1.42±0.13①1.08±0.09①0.87±0.07①178.20<0.001组别HMy2.CIR细胞OCI-LY8细胞SU-DHL-1细胞U2932细胞F值P值例数6 6 6 6 HCG18 1.00±0.00 2.66±0.24①2.01±0.14①1.72±0.09①133.30<0.001 miR-497-5p 1.00±0.00 0.17±0.01①0.39±0.02①0.56±0.05①989.30<0.001

图1 蛋白质印迹法检测淋巴组织中CCNE1蛋白表达

图2 蛋白质印迹法检测OCI-LY8细胞中CCNE1蛋白表达
2.2 HCG18、miR-497-5p、CCNE1蛋白在OCI-LY8细胞中的表达 与Ct组和pcDNA组对比,pcDNAHCG18组HCG18表达及CCNE1蛋白表达上调,miR-497-5p表达下调(P<0.05),与si-NC组、Ct组相比,si-HCG18组HCG18、CCNE1蛋白表达下调,miR-497-5p表达上调(P<0.05),与si-HCG18+inhibitor NC组、si-HCG18组相比,si-HCG18+miR-497-5p inhibitor组miR-497-5p表达下调,CCNE1蛋白表达上调(P<0.05),见图3,表3。
表3 HCG18、miR-497-5p、CCNE1蛋白在OCI-LY8细胞中的表达/
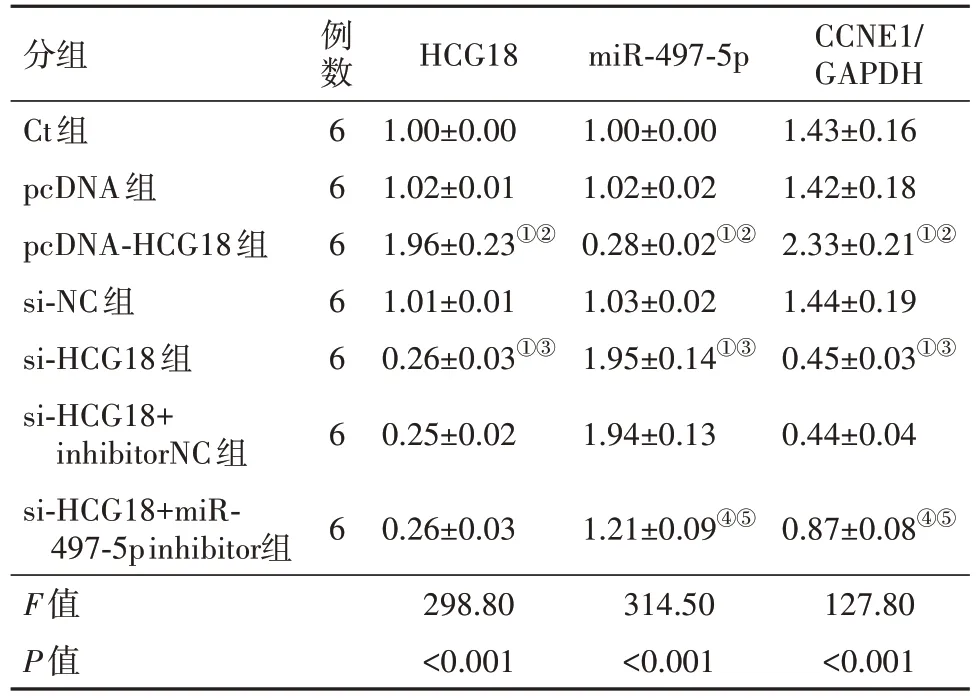
表3 HCG18、miR-497-5p、CCNE1蛋白在OCI-LY8细胞中的表达/
注:HCG18为人类白细胞抗原复合体18,miR-497-5p为微RNA-497-5p,CCNE1为细胞周期蛋白E1,GAPDH为甘油醛-3-磷酸脱氢酶,Ct为对照,pcDNA为过表达物阴性对照,pcDNA-HCG18为HCG18过表达物,si-NC为小干扰RNA阴性对照,si-HCG18为HCG18小干扰RNA,inhibitorNC为抑制物阴性对照,miR-497-5p inhibitor为miR-497-5p 抑制物。①与Ct组对比,P<0.05。②与pcDNA组对比,P<0.05。③与si-NC组对比,P<0.05。④与si-HCG18组对比,P<0.05。⑤与si-HCG18+inhibitorNC组对比,P<0.05。
2.33±0.21①②1.44±0.19 0.45±0.03①③0.44±0.04 0.87±0.08④⑤127.80<0.001 pcDNA-HCG18组si-NC组si-HCG18组si-HCG18+inhibitorNC组si-HCG18+miR-497-5p inhibitor组F值P值6 6 6 6 6 1.96±0.23①②1.01±0.01 0.26±0.03①③0.25±0.02 0.26±0.03 298.80<0.001 0.28±0.02①②1.03±0.02 1.95±0.14①③1.94±0.13 1.21±0.09④⑤314.50<0.001
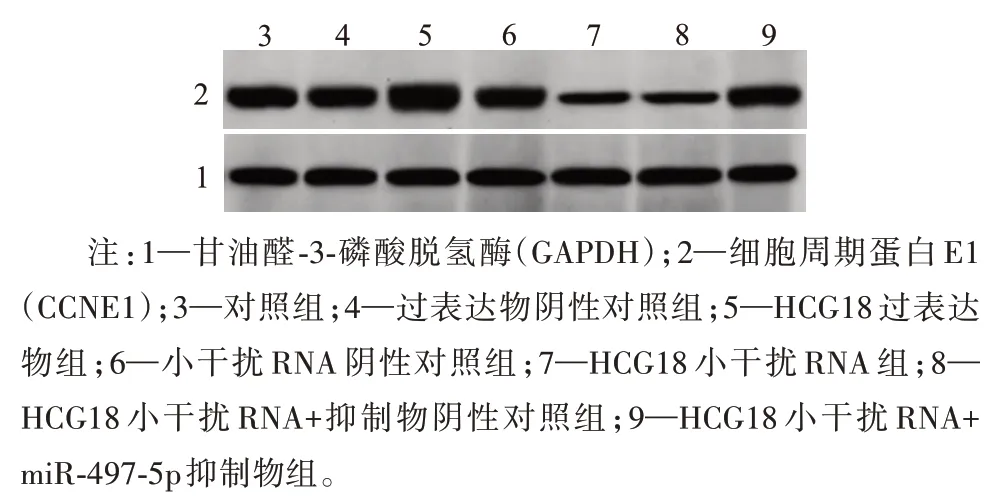
图3 蛋白质印迹法检测OCI-LY8细胞中CCNE1蛋白表达
2.3 过表达或沉默HCG18对OCI-LY8细胞增殖的影响 与Ct组和pcDNA组对比,pcDNA-HCG18组OCI-LY8细胞D(λ)450nm值升高(P<0.05),与Ct组、si-NC组比较,si-HCG18组OCI-LY8细胞D(λ)450nm值降低(P<0.05),与si-HCG18组、si-HCG18+inhibitor NC组比较,si-HCG18+miR-497-5p inhibitor组OCILY8细胞D(λ)450nm值升高(P<0.05),见表4。
表4 各组OCI-LY8细胞增殖、凋亡、侵袭情况比较/
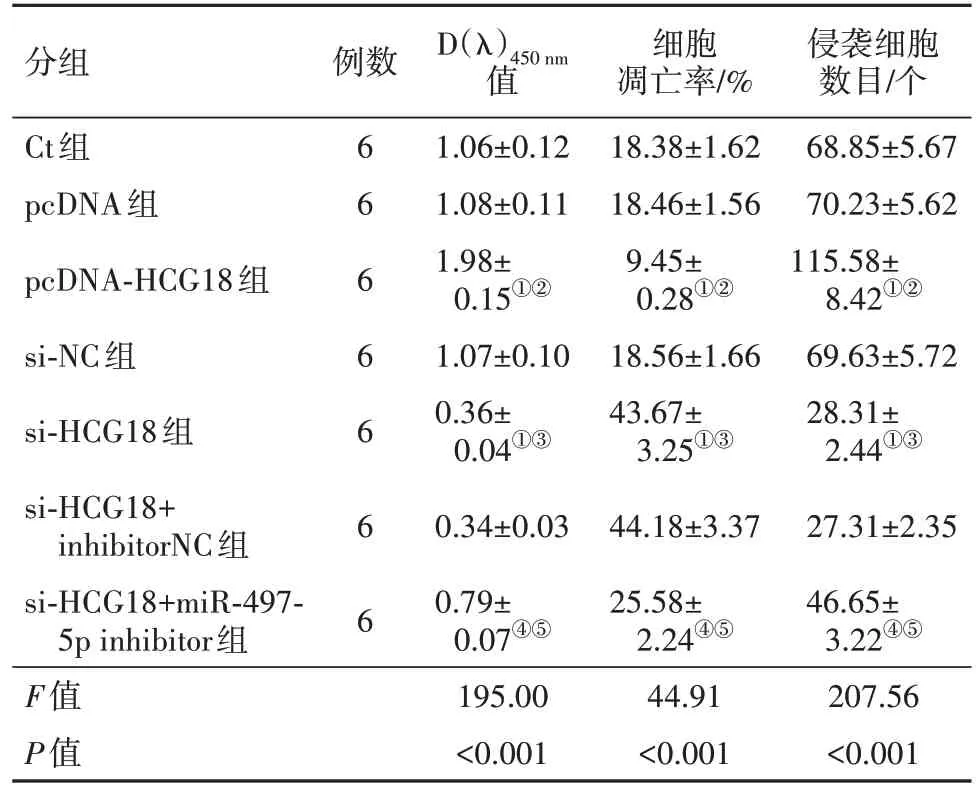
表4 各组OCI-LY8细胞增殖、凋亡、侵袭情况比较/
注:D(λ)450 nm为OCI-LY8细胞450 nm处吸光度,Ct为对照,pcDNA为过表达物阴性对照,pcDNA-HCG18为HCG18过表达物,si-NC为小干扰RNA阴性对照,si-HCG18为HCG18小干扰RNA,inhibitorNC为抑制物阴性对照,miR-497-5p inhibitor为miR-497-5p 抑制物。①与Ct组对比,P<0.05。②与pcDNA组对比,P<0.05。③与si-NC组对比,P<0.05。④与si-HCG18组对比,P<0.05。⑤与si-HCG18+inhibitorNC组对比,P<0.05。
侵袭细胞数目/个68.85±5.67 70.23±5.62 115.58±8.42①②69.63±5.72 28.31±2.44①③27.31±2.35 46.65±3.22④⑤207.56<0.001分组Ct组pcDNA组pcDNA-HCG18组si-NC组si-HCG18组si-HCG18+inhibitorNC组si-HCG18+miR-497-5p inhibitor组F值P值例数6 6 6 6 6 6 6 D(λ)450 nm值1.06±0.12 1.08±0.11 1.98±0.15①②1.07±0.10 0.36±0.04①③0.34±0.03 0.79±0.07④⑤195.00<0.001细胞凋亡率/%18.38±1.62 18.46±1.56 9.45±0.28①②18.56±1.66 43.67±3.25①③44.18±3.37 25.58±2.24④⑤44.91<0.001
2.4 过表达或沉默HCG18对OCI-LY8细胞凋亡的影响 与Ct组、pcDNA组比较,pcDNA-HCG18组OCI-LY8细胞凋亡率降低(P<0.05),与Ct组、si-NC组比较,si-HCG18组OCI-LY8细胞凋亡率上升(P<0.05),与si-HCG18+inhibitor NC组、si-HCG18组相比,si-HCG18+miR-497-5p inhibitor组OCI-LY8细胞凋亡率下降(P<0.05),见图4,表4。
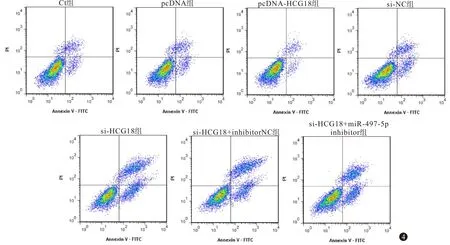
图4 流式细胞术检测OCI-LY8细胞凋亡
2.5 过表达或沉默HCG18影响OCI-LY8细胞侵袭与pcDNA组、Ct组相比,pcDNA-HCG18组OCI-LY8细胞侵袭数目升高(P<0.05),与Ct组、si-NC组比较,si-HCG18组OCI-LY8细胞侵袭数目降低(P<0.05),与si-HCG18组、si-HCG18+inhibitor NC组比较,si-HCG18+miR-497-5p inhibitor组OCI-LY8细胞侵袭数目升高(P<0.05),见图5,表4。

图5 Transwell实验检测OCI-LY8细胞侵袭(结晶紫染色×200)
2.6 过表达或沉默HCG18影响OCI-LY8细胞中蛋白表达 与Ct组和pcDNA组对比,pcDNAHCG18组OCI-LY8细胞中PCNA、MMP-9蛋白表达升高,Bax蛋白表达降低(P<0.05),与Ct组和si-NC组对比,si-HCG18组PCNA和MMP-9蛋白表达下调,Bax蛋白表达上调(P<0.05),与si-HCG18组、si-HCG18+inhibitor NC组比较,si-HCG18+miR-497-5p inhibitor组PCNA和MMP-9蛋白表达上调,Bax蛋白表达下调(P<0.05),见图6,表5。
表5 各组OCI-LY8细胞中PCNA、Bax、MMP-9蛋白表达比较/
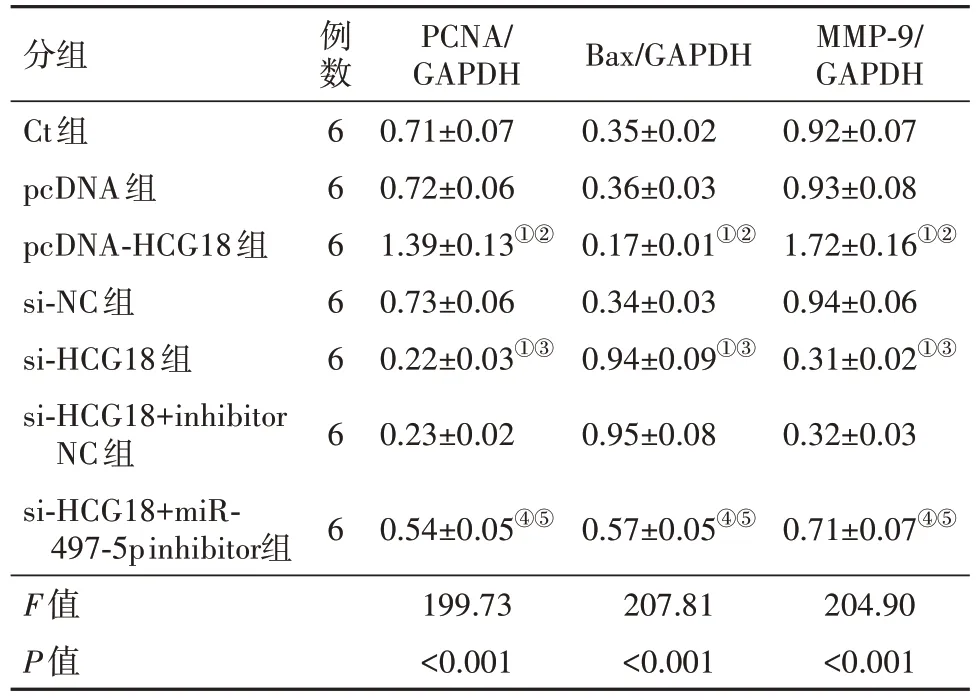
表5 各组OCI-LY8细胞中PCNA、Bax、MMP-9蛋白表达比较/
注:Bax为Bcl-2相关X蛋白,PCNA为增殖细胞核抗原,MMP-9为基质金属蛋白酶9,GAPDH为甘油醛-3-磷酸脱氢酶,Ct为对照,pcDNA为过表达物阴性对照,pcDNA-HCG18为HCG18过表达物,si-NC为小干扰RNA阴性对照,si-HCG18为HCG18小干扰RNA,inhibitorNC为抑制物阴性对照,miR-497-5p inhibitor为miR-497-5p抑制物。①与Ct组对比,P<0.05。②与pcDNA组对比,P<0.05。③与si-NC组对比,P<0.05。④与si-HCG18组对比,P<0.05。⑤与si-HCG18+inhibitorNC组对比,P<0.05。
PCNA/GAPDH 0.71±0.07 0.72±0.06 1.39±0.13①②0.73±0.06 0.22±0.03①③0.23±0.02 Bax/GAPDH 0.35±0.02 0.36±0.03 0.17±0.01①②0.34±0.03 0.94±0.09①③0.95±0.08 MMP-9/GAPDH 0.92±0.07 0.93±0.08 1.72±0.16①②0.94±0.06 0.31±0.02①③0.32±0.03 0.71±0.07④⑤204.90<0.001分组Ct组pcDNA组pcDNA-HCG18组si-NC组si-HCG18组si-HCG18+inhibitor NC组si-HCG18+miR-497-5p inhibitor组F值P值例数6 6 6 6 6 6 6 0.54±0.05④⑤199.73<0.001 0.57±0.05④⑤207.81<0.001

图6 蛋白质印迹法检测OCI-LY8细胞中PCNA、Bax、MMP-9蛋白表达
2.7 HCG18靶向调控miR-497-5p/CCNE1轴lncRNA HCG18与miR-497-5p、miR-497-5p与CCNE1存在结合位点,见图7。miR-497-5p mimic和HCG18-WT共转染组的萤光素酶活性低于mimic NC和HCG18-WT共转染组(P<0.05)。miR-497-5p mimic和CCNE1-WT共转染组的萤光素酶活性低于mimic NC和CCNE1-WT共转染组(P<0.05),见表6。
表6 各组萤光素酶活性比较/
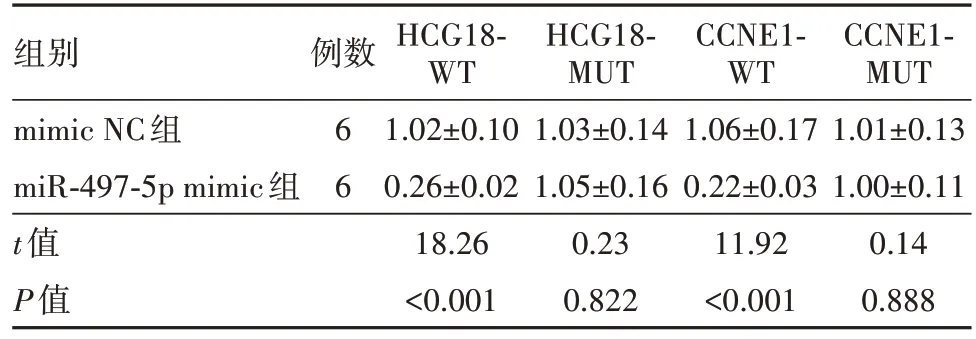
表6 各组萤光素酶活性比较/
注:mimic NC为模拟物阴性对照,miR-497-5p mimic为微RNA-497-5p模拟物,HCG18-WT为人类白细胞抗原复合体18野生型质粒,HCG18-MUT为人类白细胞抗原复合体18突变型质粒,CCNE1-WT为细胞周期蛋白E1野生型质粒,CCNE1-MUT为细胞周期蛋白E1突变型质粒。
CCNE1-MUT 1.01±0.13 1.00±0.11 0.14 0.888组别mimic NC组miR-497-5p mimic组t值P值例数6 6 HCG18-WT 1.02±0.10 0.26±0.02 18.26<0.001 HCG18-MUT 1.03±0.14 1.05±0.16 0.23 0.822 CCNE1-WT 1.06±0.17 0.22±0.03 11.92<0.001

图7 长链非编码RNA人类白细胞抗原复合体18(lncRNA HCG18)与微RNA-497-5p(miR-497-5p)、miR-497-5p与细胞周期蛋白E1(CCNE1)的结合位点图
3 讨论
最近,越来越多的研究开始关注一系列在DLBCL进展中发挥基本生物学作用的lncRNA。如lnc SMAD5-AS1过表达可以通过海绵化miR-135b-5p上调APC表达来抑制体外和体内DLBCL增殖[9],lncRNA FIRRE通过促进DLBCL中的细胞增殖和减少细胞凋亡而发挥癌基因的作用[10]。此外,各种研究已将HCG18与肿瘤进展联系起来。如HCG18在透明细胞肾细胞癌组织和细胞中高表达,沉默HCG18减弱了透明细胞肾细胞癌细胞活力、迁移和侵袭能力[11],HCG18可促进肺腺癌中的肿瘤生长[12]。这些结果揭示了HCG18在上述肿瘤中的促癌作用。本研究表明,在DLBCL淋巴组织和DLBCL细胞中HCG18上调表达,并选择了HCG18上调表达最高的OCI-LY8细胞进行后续实验。PCNA是一种重要的复制辅助因子,具有促进细胞增殖的作用[13],Bax作为一种细胞凋亡调节剂,其缺失会阻止细胞快速凋亡[14],MMP-9被认为是肿瘤侵袭过程中细胞外基质蛋白水解降解的主要因素[15]。本研究显示,过表达HCG18可促进OCI-LY8细胞中PCNA、MMP-9蛋白表达及细胞增殖、侵袭,抑制Bax蛋白表达及细胞凋亡,而沉默HCG18则影响效果呈相反趋势。提示HCG18在DLBCL中具有致癌作用,沉默HCG18可抑制OCI-LY8细胞增殖、侵袭,促进细胞凋亡。说明HCG18参与调控DLBCL细胞的增殖、凋亡和侵袭。
大量研究证实,lncRNA可以作为miRNA海绵并调控靶 miRNA的表达[16]。本研究通过生物信息学分析及双萤光素酶验证实验证实了miR-497-5p可与HCG18靶向结合。相关研究表明,过表达miR-497-5p可抑制肺鳞状细胞癌进展[17],下调miR-497-5p促进了肝癌细胞的增殖、侵袭[18]。本研究发现,miR-497-5p在DLBCL组织和细胞中下调表达,过表达HCG18抑制了OCI-LY8细胞中miR-497-5p表达,下调HCG18促进了OCI-LY8细胞中miR-497-5p表达,猜想沉默HCG18抑制OCI-LY8细胞增殖、侵袭,促进细胞凋亡可能是通过上调miR-497-5p表达来实现的。为了验证该假设,本研究在沉默HCG18的同时再用miR-497-5p inhibitor处理OCI-LY8细胞,结果发现,miR-497-5p inhibitor逆转了沉默HCG18对OCI-LY8细胞增殖、侵袭、凋亡的影响。证明了猜想的正确性。间接证实了HCG18靶向miR-497-5p在DLBCL细胞的增殖、凋亡、侵袭中发挥调节作用。
miRNA可通过与mRNA的3'UTR互补结合来降解mRNA或抑制蛋白质翻译[19]。为了进一步探究相应的分子机制,本研究通过starbase数据库发现CCNE1为miR-497-5p的靶基因。据报道,过表达CCNE1与卵巢癌的不良预后相关[20],上调CCNE1表达可促进结肠癌细胞增殖、侵袭[21]。表明CCNE1在上述肿瘤中发挥着癌基因的作用。本研究显示,在DLBCL淋巴组织和细胞中CCNE1蛋白上调表达,上调HCG18抑制了OCI-LY8细胞中miR-497-5p表达,促进了CCNE1蛋白表达,而沉默HCG18后则呈相反趋势,且miR-497-5p与CCNE1存在靶向调控关系,证实了沉默HCG18可能通过上调miR-497-5p来抑制CCNE1表达,进而抑制OCI-LY8细胞增殖、侵袭,促进细胞凋亡。阐明HCG18可通过miR-497-5p/CCNE1轴对DLBCL细胞的增殖、凋亡、侵袭起调节作用。
综上所述,沉默HCG18抑制OCI-LY8细胞增殖、侵袭,诱导细胞凋亡可能是通过调控miR-497-5p/CCNE1轴实现的。该研究可能为DLBCL的治疗提供新的靶点。

