YTH结构域家族蛋白2和叉头蛋白转录因子3在肺腺癌中的表达关系研究
杨睿,李占江,陈腾飞
作者单位:郑州大学第一附属医院呼吸与危重症医学科,河南 郑州450000
肺癌是世界范围内发病率最高的恶性肿瘤[1],其中非小细胞腺癌是最常见的类型,已进入个体化治疗时期[2]。但病人3年总生存率仍然较低。叉头蛋白转录因子3(FOXO3),主要参与细胞的生长、增殖、分化和转化等过程[3]。FOXO3基因表达在癌组织中下调,常被称为肿瘤抑制器[4]。YTH结构域家族蛋白2(YTHDF2)作为RNA甲基化的阅读器蛋白,在肿瘤发展中起到重要作用[5]。但在肺癌中的表达及其对肺腺癌的影响目前报道尚少。因此,本研究主要分析YTHDF2、FOXO3在肺腺癌组织中的表达,及与病人临床病理特征和累积生存率的影响,以期为肺腺癌的预后评估提供参考。
1 资料与方法
1.1 一般资料 选取2020年1月至2021年5月郑州大学第一附属医院行手术治疗的肺腺癌病人癌组织及对应的癌旁组织(距离癌组织5 cm以上)80对,其中男52例,女28例。纳入标准:原发性肺腺癌;临床及病理资料完整。排除标准:拒绝参加此次调查研究者;随访时间少于1个月者;有精神疾病史病人;其他部位肿瘤及心、脑、肝、肾等严重疾病病人。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 生物学分析 采用Ualcan网站,使用其中的癌症基因组图谱(TCGA)数据库对YTHDF2、FOXO3基因的表达分析、生存预后,并进行可视化。
1.2.2 免疫组织化学检测 按照常规取材肺腺癌组织标本及癌旁正常组织标本,使用免疫组织化学试剂盒(北京博奥派克生物科技有限公司)进行染色,具体操作按照说明书进行。
1.2.3 免疫组织化学染色结果判定 强度评分:未染色:0分;略染色:1分;明显染色:2分;深棕色:3分。阳性细胞数比例:随机观察不少于5个视野,计数500个细胞中染色阳性细胞数,阳性细胞数目<5%为0分,5%~<25%为1分,25%~<50%为2分,≥50%为3分。强度评分×阳性细胞数比例为染色评分,根据评分结果分为两组:分数<4即为低表达、分数≥4即为高表达。
1.3 统计学方法 采用SPSS 22.2软件进行统计学分析。阳性细胞数目为计数资料以例(%)表示,采用χ2检验分析;生存分析采用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结果
2.1 YTHDF2及FOXO3在肺腺癌中及癌旁正常组织中的表达差异 比较TCGA数据库中515例肺腺癌组织和59例癌旁正常组织中YTHDF2、FOXO3基因的表达水平,结果显示YTHDF2、FOXO3基因在肺腺癌组织和癌旁正常组织中表达差异有统计学意义(58.39±21.21比49.06±17.36,13.16±4.33比23.24±7.63,t=3.26、15.38,P=0.001、<0.001)。
2.2 YTHDF2、FOXO在肺腺癌组织及癌旁正常组织中的免疫组化结果 免疫组化结果显示,YTHDF2、FOXO3基因主要定位于细胞质或细胞核,见图1。YTHDF2、FOXO3在肺腺癌组织中的高表达率分别为26.25%(21/80)、18.75%(15/80),明显低于癌旁正常组织中的82.50%(66/80)、88.75%(71/80)(χ2=51.02、78.84,均P<0.001)。
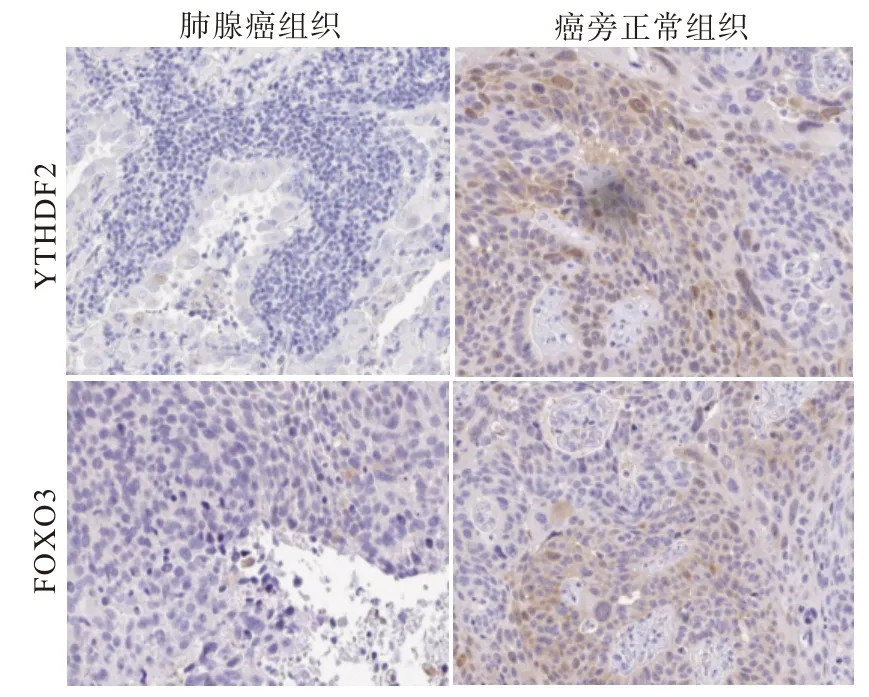
图1 YTHDF2、FOXO3蛋白在肺腺癌组织及癌旁正常组织中的表达(免疫组织化学法×100)
2.3 肺腺癌组织中YTHDF2、FOXO3表达相关性 GEPIA数据库中分析显示,肺腺癌中YTHDF2与FOXO3基因表达水平的对数值呈正相关性(R=0.36,P<0.05)。
2.4 肺腺癌组织中YTHDF2、FOXO3蛋白表达情况与病人临床病理参数之间的关系 YTHDF2蛋白表达情况与肺腺癌病人年龄、淋巴结转移和分化程度相关(P<0.05);与TNM分期、性别无关(P>0.05);FOXO3蛋白表达情况与肺腺癌病人性别和分化程度相关(P<0.05);与TNM分期、年龄、淋巴结转移无关(P>0.05)。见表1。
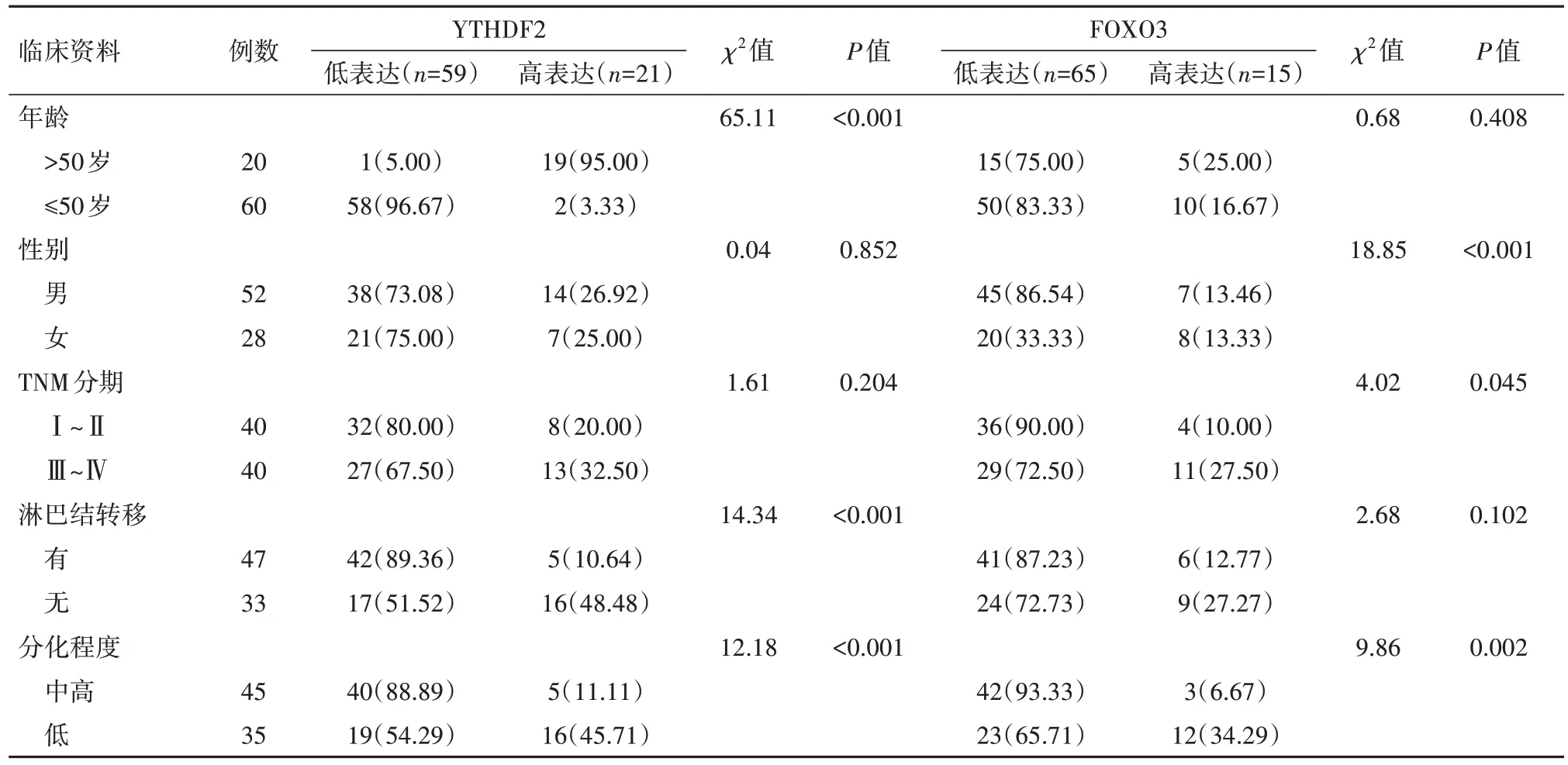
表1 YTHDF2、FOXO3蛋白与肺腺癌临床病理特征的关系/例(%)
2.5 肺腺癌组织中YTHDF2、FOXO3蛋白表达情况与肺腺癌病人3年生存情况的关系 病例随访的方式:采用电话或信件随访,随访时间从出院至最近一次随访,随访期限为3年。肺腺癌组织中YTHDF2蛋白高表达组和低表达组病人3年累积生存率分别为53.30%、14.00%,经Log-Rank比较,差异有统计学意义(χ2=24.60,P<0.001);FOXO3蛋白高表达组和低表达组病人3年累积生存率分别为64.50%、12.20%,经Log-Rank比较,差异有统计学意义(χ2=18.20,P<0.001)。
3 讨论
肺癌已经逐渐成为全球癌症死亡的主要原因[6]。其中有87%被归类为非小细胞肺癌,而肺腺癌和肺鳞状细胞癌是主要的病理类型[7]。FOXO3是一种“肿瘤抑制因子”[8],也是四种相关的FOXO转录因子之一,可保护细胞免受各种生理应激的影响[9]。FOXO3已被证明在DNA修复,生长停滞和细胞凋亡中具有重要作用[10]。研究表明FOXO3能够激活促凋亡转录程序,并且可促进人类肺癌致癌物产生炎症反应[11]。FOXO3定位于6号染色体,编码673个氨基酸[12]。FOXO3在蛋白质中的水平受到丝氨酸/苏氨酸激酶(Akt)的影响。Akt能够促进特定残基上磷酸化FOXO3,并导致其胞质滞留和转录失活,同时Akt可被磷脂酰肌醇3-激酶信号激活[13]。FOXO3可以通过调节细胞增殖、迁移及血管生成参与癌症的发生。研究发现,FOXO3还参与许多化疗药物(吉非替尼等)的作用机制[14]。另有研究显示敲除FOXO3基因会促使肿瘤的发生,从而发现FOXO3作为抑癌基因发挥作用[15]。然而,其他研究报道FOXO3在肿瘤发生中起相反的作用,可促进肿瘤细胞的转移。例如,有研究表明FOXO3既能抑制也能促进乳腺癌细胞的进展,且调节FOXO3活性对于肿瘤生长和转移至关重要[16]。
YTHDF2能够识别和削弱mRNA稳定性[17]。最新的报告称YTHDF2是能够降解两种肿瘤启动子并且能够抑制肿瘤基因表达,增强干细胞自我更新能力[18]。癌细胞的代谢特征对于适应肿瘤微环境内的变化至关重要,通常有助于表观遗传可塑性[19]。Shen等[20]研究报道,YTHDF2在胃癌组织及细胞中均为低表达,其表达水平与胃癌分期及病人的生存期密切相关,可作为胃癌的预后标志物。另王月帆等[21]研究发现,肝癌组织中YTHDF2高表达,且YTHDF2高表达病人具有更低的总体生存率和无复发生存率,YTHDF2可作为判断肝癌病人预后的分子标志物。但YTHDF2、FOXO3蛋白在肺腺癌中的作用尚不明确,因此本研究分析肺腺癌组织和癌旁正常组织中YTHDF2、FOXO3蛋白的表达变化。
本研究免疫组化结果发现,肺腺癌组织中YTHDF2、FOXO3蛋白高表达率均较癌旁正常组织低,FOXO3蛋白表达与TCGA数据库中FOXO3基因表达的结果一致,而YTHDF2蛋白表达与TCGA数据库中YTHDF2基因表达的结果不一致,考虑可能与本研究纳入样本量与TCGA数据库中的样本量相差较大有关,需扩大样本进行验证。另外,GEPIA数据库中分析发现,肺腺癌中YTHDF2与FOXO3基因表达水平的对数值呈正相关。上述结果提示YTHDF2、FOXO3表达异常与肺腺癌的发生密切相关,FOXO3可能通过抑制转录因子的激活,从而降低相关基因的表达,抑制癌细胞的增殖。分析原因可能为YTHDF2、FOXO3蛋白具有DNA结合、转录活化和转录抑制等功能,与增生、分化、血管再生和侵袭等病理生理关系密切,是重要的细胞调控因子。本研究还发现,YTHDF2蛋白表达与肺腺癌病人年龄、淋巴结转移和分化程度相关,而FOXO3蛋白表达与肺腺癌病人性别、分化程度相关,提示YTHDF2、FOXO3表达受多种因素影响,可能在肺腺癌病情进展中发挥作用。进一步分析发现,YTHDF2蛋白、FOXO3蛋白低表达组病人具有更低的3年累积生存率,提示YTHDF2、FOXO3异常低表达病人可能更易发生预后不良,对于此类病人,应及时采取措施干预,以提高病人的3年累积生存率,并改善生存质量。
综上所述,YTHDF2、FOXO3在肺腺癌组织中均呈低表达,与病人肿瘤分化程度和3年累积生存率有关,可作为评估预后的潜在标志物。但是本研究样本量较少,可能存在一定的偏倚,后续还须扩大样本继续研究。

