全反式维甲酸抑制核因子E2相关因子2和血红素加氧酶1加重大鼠肾脏缺血再灌注损伤表达
董毅玲,张文文,闫琰,覃志成
作者单位:山西医科大学第五临床医学院,山西 太原030012
肾脏缺血再灌注损伤(ischemia/reperfusion injury,IRI)是由于肾脏血液供给不足,随后恢复血液灌流后肾脏功能无法恢复正常,造成其功能代谢障碍及结构受损的一种病理状态[1]。在临床上,缺血再灌注损伤是导致急性肾损伤(acute renal injury,AKI)的主要原因之一,其病理生理过程包括氧化应激、炎症、肾小管上皮细胞凋亡、铁死亡等[2-3]。其中缺血再灌注损伤发生的主要原因是氧化应激。目前相关研究发现Nrf2/HO-1信号通路是调节氧化应激的重要因子。核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)是一种基因转录因子,主要通过调控下游抗氧化酶血红素加氧酶1(heme oxygenase1,HO-1)基因影响细胞的氧化状态,从而调节细胞的氧化还原平衡[4]。全反式维甲酸(all-trans retinoic acid,ATRA)又名视黄酸,是体内维生素A的中间代谢产物之一,ATRA可以抑制Nrf2与抗氧化反应元件(antioxidant response element,ARE)的结合能力,其抑制作用是迅速、完全且不可逆转的[5-6]。根据此特性,本研究于2020年10月至2022年2月通过以大鼠肾脏IRI为模型,观察ATRA抑制Nrf2、HO-1表达是否会加重肾脏IRI,同时阐明Nrf2/HO-1通路在肾脏IRI中的作用。
1 材料与方法
1.1 实验材料 24只雄性无特定病原体(SPF)级6~8周龄SD大鼠,体质量范围260~350 g,购于山西省人民医院动物实验中心。采用常规饲养,在禁食12 h后用于本实验,主要试剂:全反式维甲酸(alltrans retinoic acid,ATRA)购于美国Sigma公司,水合氯醛购于阿拉丁试剂有限公司,兔抗大鼠Nrf2抗体、抗HO-1抗体、山羊抗兔IgG抗体购于北京博奥森生物有限公司,末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TdT -mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malonic dialdehyde,MDA)试剂盒、尿素氮(BUN)试剂盒及血肌酐(Scr)试剂盒均购于南京建成生物公司,组化试剂盒DAB显色剂、PIPA裂解液、PBS缓冲液、SDS-PAGE凝胶制备试剂盒购于武汉塞维尔生物科技有限公司。本研究符合一般动物实验伦理学原则。
1.2 实验方法
1.2.1 动物模型制备 24只雄性SD大鼠随机分为3组:假手术组(sham组)、肾脏缺血再灌注组(Ischemia/reperfusion,I/R组)及全反式维甲酸组(I/R+ATRA组),每组8只。1周前开始对3组大鼠进行腹腔注射,Sham组、I/R组腹腔注射1 mL/kg玉米油,每天1次;将ATRA溶于玉米油中(100 mg/10 mL玉米油),ATRA组腹腔注射溶于玉米油的ATRA(10 mg/kg),每天1次。持续1周以后,3组大鼠分别腹腔注射10%水合氯醛(0.3 mL/100 g)进行麻醉,待小鼠对刺激无反应时,表明麻醉成功,将其处于仰卧位固定在37 ℃恒温垫上,清洁手术区域后沿腹中线逐层切开各层组织,暴露双侧肾脏,先结扎右侧肾蒂,然后摘除右肾。Sham组不予以夹闭左肾动脉;I/R组:用无创动脉夹夹闭左肾动脉,使左肾缺血,夹闭后看到肾脏颜色变为暗紫色,在缺血期间随时将伤口用纱布覆盖,并补充0.9%氯化钠溶液,缺血45 min后取出血管夹,恢复肾脏血供,当肾脏颜色回至正常颜色时,表明肾脏再灌注成功。I/R+ATRA组:与I/R组实验过程相同,建立肾脏I/R模型。逐层缝合手术切口,整个实验操作过程注意无菌操作,待大鼠清醒后,放入笼中进行饲养。3组大鼠于实验结束24 h后留取各组血液及肾组织标本。
1.2.2 蛋白质印迹法检测肾组织蛋白水平 将切开的肾组织、匀浆珠、RIPA裂解液进行充分研磨,离心后提取上清液及总蛋白。用BCA试剂盒测定蛋白浓度,通过沸水浴将蛋白溶液变性后,分别进行电泳、转膜、封闭、加入一抗(Nrf2为1∶1 000,HO-1为1∶1 000)孵育过夜后,加入二抗(按1∶5 000进行稀释)在室温下孵育半小时后,用TBST缓冲液冲洗3次。最后用ECL化学发光法曝光。用Alpha软件分析、定量蛋白质水平,记录数据。
1.2.3 肾组织SOD、MDA检测 取肾组织约50 mg,将其制作成10%匀浆液,根据试剂盒说明书,通过比色法检测肾组织的SOD活性及MDA含量。
1.2.4 肾组织活性氧检测 DHE染色评估肾组织活性氧:将冷冻的肾组织冰冻切片,进行DHE染色,在荧光显微镜(日本尼康)下观察红色荧光。分别测量每张切片中6个视野阳性的累积光密度值(IOD)以及对应的组织像素面积(Area),并计算出活性氧相对表达量即面密度(Areal density)=IOD/Area进行分析,记录数据。
1.2.5 血清Scr、BUN检测 将装有实验大鼠血清的EP管进行离心,取上层血清成分,通过全自动生化分析仪,根据试剂盒说明书,检测肌酐和尿素氮的含量。
1.2.6 组织病理学检查 用石蜡包埋肾脏组织,将大鼠肾组织切片切成3 µm厚,苏木精-伊红(HE)染色处理后,显微镜下观察肾脏病理形态变化。肾小管损伤程度评分:0分,代表正常;1分,代表微创伤(外髓质和皮质破坏<5%);2分,代表轻度破坏(外髓质和皮质破坏5%~25%);3分,代表中度破坏(外髓质和皮质破坏>25%~75%);4分,代表严重破坏(外髓质和皮质破坏>75%)[7]。每张切片至少选8个皮髓交界部视野观察(×200)。
1.2.7 肾脏组织凋亡细胞检测 根据TUNEL染色试剂盒说明书进行操作。每张切片取6个细胞分布不重叠的视野,采集图像。使用Image-Pro Plus 6.0软件对图像进行分析。
1.3 统计学方法 采用SPSS 26.0软件进行统计学分析,采用GraphPad Prism5软件进行统计并绘图,计量资料以表示,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾组织Nrf2、HO-1蛋白相对表达量比较 与Sham组相比,I/R组大鼠的肾组织Nrf2、HO-1蛋白表达均增加,差异有统计学意义(P<0.01);与I/R组相比,I/R+ATRA组Nrf2、HO-1蛋白表达均减少,差异有统计学意义(P<0.01)。见图1,表1。
表1 各组大鼠肾组织Nrf2、HO-1蛋白相对表达量/
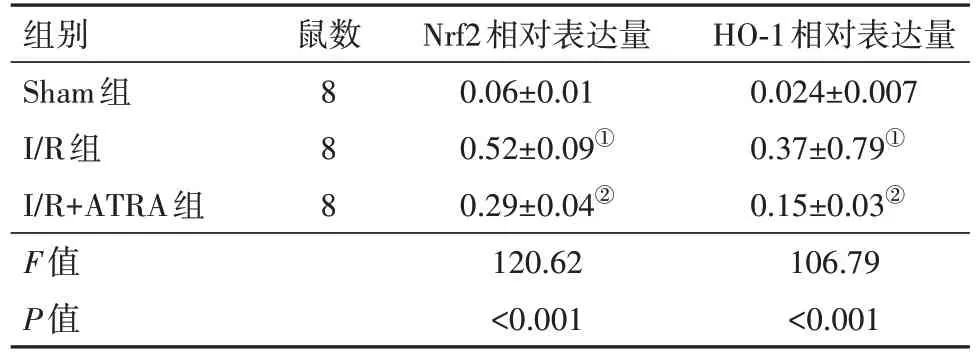
表1 各组大鼠肾组织Nrf2、HO-1蛋白相对表达量/
注:Nrf2为核因子E2相关因子2,HO-1为血红素加氧酶1。①与Sham组比较,P<0.01。②与I/R组比较,P<0.01。
组别Sham组I/R组I/R+ATRA组F值P值HO-1相对表达量0.024±0.007 0.37±0.79①0.15±0.03②106.79<0.001鼠数8 8 8 Nrf2相对表达量0.06±0.01 0.52±0.09①0.29±0.04②120.62<0.001
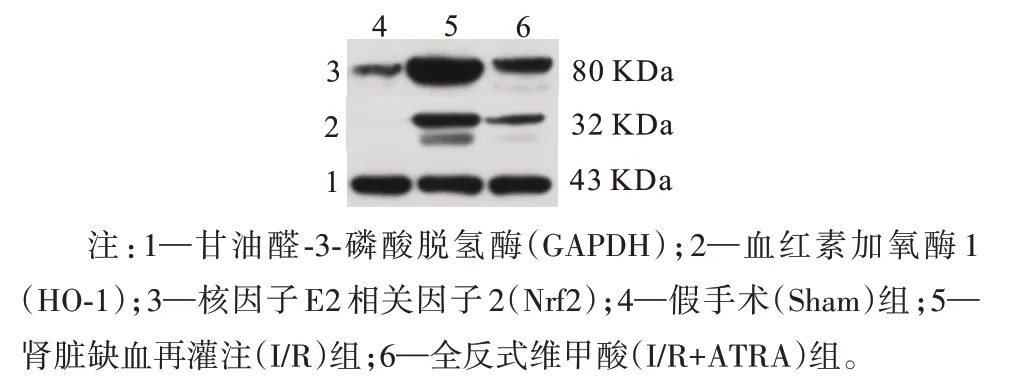
图1 各组大鼠肾组织Nrf2、HO-1蛋白相对表达量
2.2 肾组织SOD、MDA表达 与Sham组比较,I/R组肾组织SOD活性减弱,MDA含量增高(P<0.05);与I/R组比较,ATRA处理后的肾组织SOD活性明显下降,MDA含量明显增高(P<0.05)。见表2。
表2 各组大鼠肾组织SOD活性和MDA含量比较/

表2 各组大鼠肾组织SOD活性和MDA含量比较/
注:SOD为超氧化歧化酶,MDA为丙二醛。①与Sham组比较,P<0.05;②与I/R组比较,P<0.05。
组别Sham组I/R组I/R+ATRA组F值P值MDA/(nmol/mg)15.71±1.73 23.14±2.51①30.47±3.74②56.17<0.001鼠数8 8 8 SOD/(U/mg)366.92±36.01 281.99±9.96①190.37±11.23②122.92<0.001
2.3 肾组织活性氧表达 用活性氧荧光探针DHE染色,荧光显微镜下观察发现,相比于Sham组,I/R组肾组织细胞内有微弱的红色荧光,活性氧相对表达量增加(t=7.76,P<0.001,其中Sham组和I/R组的活性氧相对表达量分别为(0.20±0.04)%和(0.97±0.27)%;与I/R组比较,I/R+ATRA组红色荧光明显增强,活性氧相对表达量(2.14±0.46)%明显增加(F=79.34,P<0.001)。见图2。

图2 各组大鼠肾组织活性氧表达(DHE染色×200)
2.4 各组大鼠Scr及BUN表达 与Sham组相比,I/R组血清Scr、BUN水平均升高(P<0.01);与I/R组相比,I/R+ATRA组血清Scr、BUN含量均明显升高(P<0.01)。见表3。
表3 各组大鼠血清 Scr、BUN 水平比较/
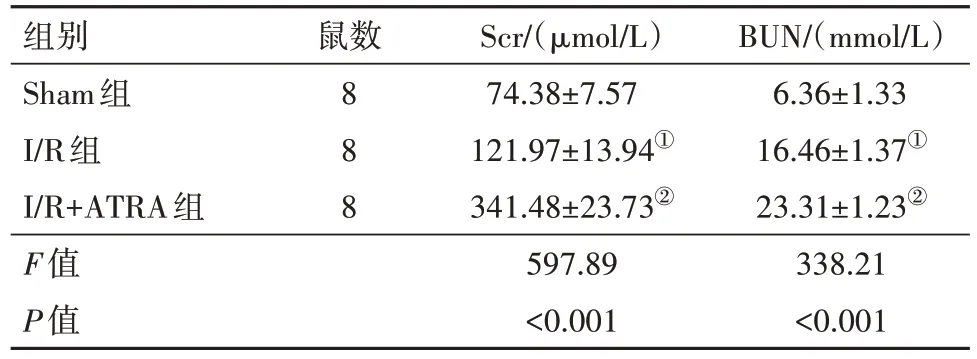
表3 各组大鼠血清 Scr、BUN 水平比较/
注:Scr为肌酐,BUN为尿素氮。①与Sham组比较,P<0.01。②与I/R组比较,P<0.01。
组别Sham组I/R组I/R+ATRA组F值P值BUN/(mmol/L)6.36±1.33 16.46±1.37①23.31±1.23②338.21<0.001鼠数8 8 8 Scr/(µmol/L)74.38±7.57 121.97±13.94①341.48±23.73②597.89<0.001
2.5 各组大鼠肾脏病理情况比较 Sham组肾小球、肾小管、肾间质结构及组织学正常,肾小管损伤病理评分为(0.75±0.46)分;与Sham组比较,I/R组可见部分肾小管上皮细胞肿胀、变性,间质有炎性细胞浸润,肾小管损伤评分(3.13±0.64)分较高(t=8.50,P<0.001);与I/R组相比,I/R+ATRA组病理改变明显加重,肾小管管腔明显水肿、扩大,刷状缘消失,伴大量空泡变性,肾小管间质出现纤维化病变,伴大量炎性细胞浸润,肾小管损伤评分(4.88±0.35)分明显增高(F=137.17,P<0.001)。见图3。

图3 各组大鼠肾脏病理情况比较(HE染色×200)
2.6 各组大鼠肾组织的细胞凋亡情况 Sham组有微量凋亡细胞表达,凋亡细胞阳性率为(0.48±0.09)%;与Sham组相比,I/R组大鼠肾组织凋亡细胞表达增加(P<0.05),凋亡细胞阳性率为(1.06±0.26)%;与I/R组比较,I/R+ATRA组凋亡细胞表达明显增加(P<0.05),其凋亡细胞阳性率为(1.74±0.08)%,差异有统计学意义(F=117.64,P<0.001),见图4。

图4 各组大鼠肾脏组织凋亡细胞比较(TUNEL染色×200)
3 讨论
急性肾损伤常见的原因是肾脏IRI,肾脏IRI是一种复杂的病理生理事件,而氧化应激是肾脏IRI发生发展的主要病理生理机制[8]。在肾脏缺血再灌注阶段,组织重新获得氧从而产生大量的活性氧,直接造成细胞内抗氧化物质、抗氧化酶数量减少,进而导致氧化-抗氧化能力失衡,加重细胞损伤、坏死[9]。有相关证据表明,减少与肾脏IRI相关的氧化应激有助于改善肾脏功能,提高生存率,缓解肾IRI[10]。
Nrf2作为机体抗氧化应激的重要转录因子,正常情况下,Nrf2主要与其抑制剂Keap1(Kelch-like ech-associated protein 1,Keap1)结合保留在细胞质中,维持低转录活性[11]。在细胞受到亲电试剂或其他活性物质(如活性氧)刺激时,Nrf2与Keap1解耦联,活化的Nrf2从细胞质转入细胞核,并与Maf蛋白结合形成异质二聚体后与ARE结合,导致一系列基因的转录激活,调控Ⅱ相解毒酶、抗氧化酶(HO-1、过氧化物酶-1、谷氨酸半胱氨酸连接酶等)或药物转运体的转录活性[12-13]。HO-1能促进产生胆绿素、铁离子和一氧化碳,这些产物在保护细胞免受氧化损伤、调节细胞凋亡、细胞炎症以及促进血管生成等方面发挥重要作用[14]。有研究表明,许多疾病的发生、发展与Nrf2/HO-1通路抑制导致的氧化应激增强有关。例如在横纹肌溶解的急性肾损伤中,Nrf2基因敲除的小鼠活性氧显著增加,其肾功能和生存率明显降低[15]。因此Nrf2/HO-1是生物进化过程中对外界刺激形成防御的一种抗损伤机制,也是机体抗氧化应激的主要信号通路[16-17]。
在缺血再灌注状态下,体内的氧化物质大量堆积,而抗氧化物质大量丢失,导致膜脂质过氧化增强,蛋白质功能抑制,核酸及染色体破坏,进一步加重病情恶化[18]。许多研究表明活性氧作为体内强氧化物,可以氧化核酸、蛋白质、脂质及染色体等物质;同时导致线粒体膜通透性增加,阻断ATP合成,进一步介导细胞凋亡,促进缺血再灌注的发生、发展[19]。而SOD作为细胞内氧自由基清除剂可清除活性氧,在减轻IRI中发挥重要作用[20]。自由基可通过作用于脂质发生过氧化反应,生成丙二醛(MDA),可直接引起细胞毒性损伤,因此,组织MDA含量被认为是脂质过氧化的一个重要指标[21]。本实验结果显示,与Sham组相比,I/R组肾组织活性氧表达升高,SOD的活性受到抑制,MDA含量上升,伴血清Scr、BUN升高,肾脏病理、肾脏组织细胞凋亡增加,说明大鼠肾脏缺血再灌注损伤会导致氧化应激的产生。同时与Sham组相比,I/R组大鼠肾组织的Nrf2、HO-1表达增加,进一步说明Nrf2/HO-1通路可能参与肾脏缺血再灌注损伤过程。
此外本研究结果显示,与I/R组相比,大鼠造模前行Nrf2阻断剂ATRA预处理后,肾组织Nrf2、HO-1的表达显著减少,SOD活性严重下降,活性氧、MDA含量明显增加,伴肾功能、肾病理损伤加重,肾脏组织细胞凋亡亦明显增加。研究结果提示,ATRA通过抑制肾IRI中Nrf2和HO-1蛋白的表达,降低组织抗氧化损伤的作用,加重肾组织细胞的病理损伤及凋亡,进一步加重肾脏IRI,说明ATRA抑制Nrf2、HO-1表达会加重肾脏缺血再灌注损伤进程。
综上所述,Nrf2/HO-1通路参与肾脏缺血再灌注损伤过程,行ATRA预处理后会抑制大鼠肾脏Nrf2、HO-1表达,加重氧化应激,进一步加重肾脏IRI。研究结果提示,在肾脏缺血再灌注过程中激活Nrf2/HO-1信号通路,可以增强组织细胞的抗氧化能力,减轻肾脏IRI损伤,这为我们治疗或减轻肾脏IRI进程提供了理论依据。

