葛根素在重大慢性疾病临床应用中的探索研究❋
田赵威,刘晨风,王 琛△
(1.中国中医科学院中医基础理论研究所,北京 100700;2.安徽医科大学生命科学学院,合肥 230032)
葛根,为豆科植物野葛Pueraria lobata (Willd.)Ohwi的干燥根[1],是我国最常见的中药材之一,功效广泛[2],《神农本草经》载“主消渴,身大热,呕吐,诸痹,起阴气,解诸毒”[3],《本草汇言》言“清风寒,净表邪,解肌热,止烦渴,泻胃火之药也”[4]。葛根素,即8-β-D-葡萄吡喃糖-4',7-二羟基异黄酮,是中药葛根的主要有效成分之一,药理作用多样[5],具有巨大的临床应用价值[6]。本文对葛根素近年的相关研究进行梳理,将其在重大慢性疾病中的应用及未来可能的研究热点以可视化的方式呈现,更加系统、直观地展现葛根素的研究热点及发展趋势,为葛根素的深入研究及临床应用提供方向参考和有益借鉴,以便进一步挖掘葛根素的临床应用价值。
1 葛根素的研究概况
借助Citespace可视化分析软件进行年发文量变化情况和关键词频次统计等分析可以在一定程度上反映葛根素相关研究的研究热点和发展趋势。如图1A所示,葛根素相关文章较多且呈持续增长的趋势,表明葛根素是近年来的研究热点之一,且有进一步发展的可能性。关键词是对研究内容的高度总结和概括,关键词出现频率越高,意味着该关键词在其对应领域越热门[7]。关键词共现后,排除葛根素(puerarin)、细胞(cell)等概念性词汇后,统计频次大于50次的关键词,主要涉及氧化应激(oxidative stress)、炎症(inflammation)、细胞凋亡(apoptosis)等与机制相关的词汇,见图1B,而这些机制与心脑血管疾病、代谢性疾病、肿瘤等重大慢性疾病的发生、发展息息相关。
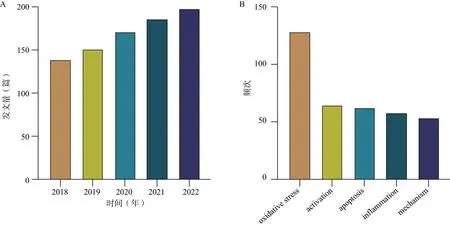
A.发文量分析;B.关键词频次分析
2 葛根素在重大慢性疾病中的研究现状
近年来,葛根素在心脑血管疾病、代谢性疾病、肿瘤等重大慢性疾病中的作用愈发被关注,见图2。

图2 葛根素在重大慢性疾病中的研究概况
2.1 心脑血管缺血性疾病
葛根素具有心脑血管保护作用,在心脑血管疾病中的研究开始较早且较深入。研究表明,葛根素可以显著降低脑缺血/再灌注损伤后海马CA1区梗死体积,并以剂量依赖方式减少自噬体的形成[8];可以增加双侧颈总动脉永久闭塞大鼠背侧CA1海马区突触结构的可塑性,降低氧化应激,最终减轻大鼠的认知障碍[9]。Kong等[10]提出葛根素在缺血性海马中的时间和剂量依赖性分布特征,即葛根素在栓塞海马区的最大浓度高于正常海马区,在栓塞体和正常海马中达到最大浓度的时间相似,但在20 mg/kg剂量下,栓塞海马区的平均停留时间高于正常海马区。此外,葛根素通过靶向蛋白sumo化修饰来缓解心肌缺血/再灌注损伤[11],显著改善心室壁梗死,降低病死率,并抑制心肌损伤标志物的水平[12];促进梗死后血管生成,并抑制炎症反应,从而减弱或防止多种刺激对心脏的重塑[13]。
2.2 代谢性疾病
葛根素对葡萄糖和脂肪酸发挥减少合成、抑制释放、调节转运等功能,亦可以改善胰岛素分泌[14],在调节糖脂代谢中发挥重要作用。在糖代谢方面,葛根素上调糖发生相关基因的表达,改善1型糖尿病小鼠的糖耐量[15];增强2型糖尿病大鼠骨骼肌μ-阿片受体的表达和磷酸化,增加胰岛素刺激的葡萄糖转运蛋白(glucose transporter, GLUT)4在质膜上的转运[16],并直接作用于肌肉细胞,减弱棕榈酸诱导的线粒体自噬和炎症反应,从而改善胰岛素敏感性[17]。在脂质代谢方面,葛根素可通过上调与糖尿病大鼠线粒体生物发生、氧化磷酸化、活性氧解毒、肌肉脂肪酸氧化等一系列基因的表达,有效缓解糖尿病大鼠血脂异常,减少细胞内脂质积累[18]。此外,葛根素既可以通过调节酒精和脂质代谢减轻酒精诱导的斑马鱼幼体肝脏脂肪变性[19],又可以恢复烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)含量并有益地影响肝线粒体功能,减轻非酒精性脂肪性肝病引发的脂肪变性和代谢紊乱[20]。进一步研究表明,葛根素强烈抑制脂肪酸合成酶基因(fatty acid synthetase, FAS)和胆固醇调节元件结合蛋白 (sterol regulatory element binding proteins, SREBP)-1c的表达,诱导甘油三酯脂肪酶(adipose triacylglyceride lipase, ATGL)的表达,进而提高肝脏脂质代谢中枢调节因子的活性[21]。
2.3 肿瘤
葛根素在癌症治疗中比多柔比星更有效,为癌症药物设计提供了一个新的方向[22]。近年来葛根素被证实在膀胱癌、肺癌、胰腺癌等多种肿瘤模型中发挥重要作用,可以抑制肿瘤细胞的活力、增殖、迁移和侵袭,诱导肿瘤细胞凋亡[23-25]。相关机制研究表明,肿瘤相关成纤维细胞(cancer associated fibroblasts, CAFs)是介导粘连增生反应的关键基质细胞,在实体肿瘤中部分负责耐药和免疫抑制微环境的形成,其中活性氧(reactive oxygen species, ROS)是多种促纤维化途径的中心枢纽,对CAFs的活化不可或缺,而葛根素可以有效地下调活化的肌成纤维细胞中ROS的产生[26]。此外,肿瘤细胞对化疗药产生耐药是导致化疗失败的重要原因,而葛根素可以逆转铂类抗癌药物的耐药性,增强奥沙利铂对乳腺癌的抗癌作用,抑制低剂量奥沙利铂诱导的上皮-间质转化和迁移[27]。目前,葛根素在癌症中的相关研究虽涉及多个方面,但尚不深入,涉及直接作用机制的研究尤显不足。
2.4 其他
除心脑血管疾病、代谢性疾病和肿瘤外,葛根素在其他疾病中的研究亦有涉及。在神经性疼痛方面,葛根素可以通过抑制炎症细胞因子,缓解长春新碱诱导的神经病理性疼痛[28];可以抑制紫杉醇诱导的背根神经节瞬时受体电位香草酸1型受体(the transient receptor potential vanilloid 1, TRPV1)、降钙素基因相关肽(calcitonin gene related peptide, CGRP)和P物质(substance P, SP)上调,减少热痛觉过敏,进而减轻紫杉醇诱导的外周神经性疼痛[29]。Xie等[30]证明葛根素通过抑制神经性疼痛大鼠背根神经节中TRPV1和瞬时受体电位通道蛋白(transient receptor potential channel, TRPC)1的上调,剂量依赖性地改善神经性疼痛。在骨关节炎方面,葛根素抑制了白介素(Interleukin, IL)-1β处理诱导的软骨细胞炎症介质和细胞凋亡,以延缓小鼠关节炎的进展[31]。在视网膜保护方面,葛根素可以降低血清和视网膜铁含量,减轻视网膜铁沉积,并部分阻止铁过载小鼠视网膜中视紫红质和视网膜色素上皮特异性蛋白表达的降低[32];亦可以通过抑制缺氧诱导的视网膜色素上皮细胞中血管内皮生长因子的上调,改善缺氧诱导大鼠视网膜病变[33]。
3 葛根素在重大慢性疾病中的主要作用机制分析
葛根素通过抗炎、抗氧化等机制在心脑血管保护、糖脂代谢调节、肿瘤抑制等方面发挥重要作用,深入挖掘其作用机制是挖掘葛根素潜在临床价值的重要方式, 故本文进一步探讨其发挥作用的主要机制,见图3。
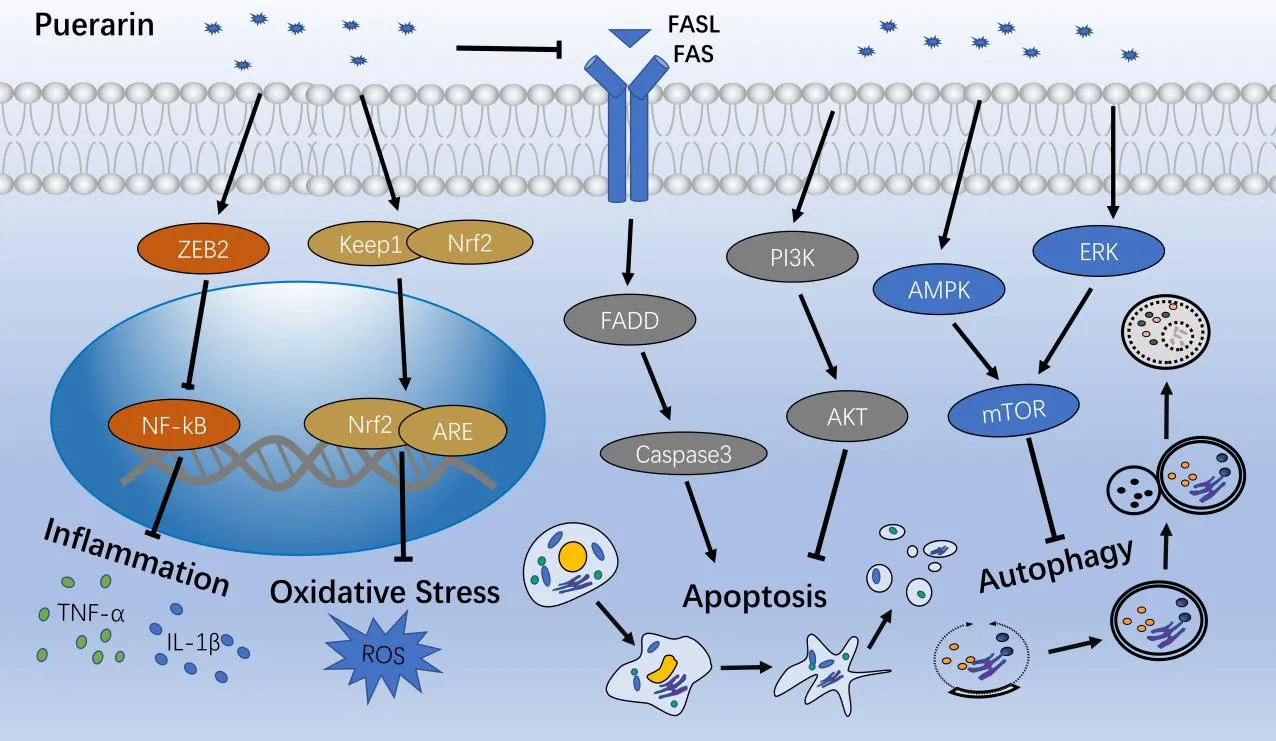
图3 葛根素的主要作用机制
3.1 抗炎机制
抗炎是葛根素治疗多种疾病的共同机制,葛根素可以通过下调核因子 (nuclear factor, NF)-κB,提高促炎介质的分泌,显著抑制炎症反应[34]。因此,有许多炎症性疾病的治疗策略旨在利用葛根素阻断NF-κB的活性。研究表明,葛根素通过提高E盒结合锌指蛋白(zinc finger e-box binding homeobox, ZEB)2表达水平,阻断NF-κB信号通路的激活,从而阻止促炎因子的激活[35],提高抗炎因子水平,调节炎症反应[36]。同时葛根素可以通过抑制NF-κB相关途径,抑制脂多糖诱导的炎症反应,促进巨噬细胞发生M2型极化[37],进而发挥和增强抗炎作用[38]。除NF-κB信号通路外,丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路亦是葛根素发挥抗炎功能的重要途径。葛根素可以呈剂量依赖性显著抑制MAPK家族蛋白的磷酸化,进而减轻炎症反应[39]。此外,葛根素还可通过哺乳动物雷帕霉素靶蛋白(the mammalian target of rapamycin, mTOR)信号通路,减弱mTOR复合物1在溶酶体附近的积聚,进而减少促炎细胞因子的产生[40]。
3.2 抗氧化机制
氧化应激与炎症反应关系密切,炎症可以促进氧化应激的发生,而氧化应激所产生的白三烯、血栓素等均为促炎物质,又可诱发炎症反应。Gou等[41]的研究进一步证明了炎症反应会促进活性氧积累和脂质过氧化,氧化还原失衡可诱导炎症反应的发生和发展。核因子E2相关因子(nuclear factor erythroid 2-related factor 2, Nrf2)信号通路被抑制是导致的氧化还原失衡的重要原因,其中Nrf2是一种转录因子,可以通过参与氧化应激反应和药物相关解毒基因的表达来调节细胞对毒性和氧化损伤的防御[42]。研究表明,葛根素可以促进Nrf2表达和核转位增加[43],进而通过Kelch样环氧氯丙烷相关蛋白(kelch-like ech-associated protein, Keap)1-核因子E2相关因子(Nrf2)/抗氧化反应元件(antioxidant response element, ARE) 信号通路上调抗氧化酶的mRNA表达水平和含量,减少活性氧积累和脂质过氧化,提高细胞抗氧化能力[44]。
3.3 抗凋亡机制
磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)信号通路是调节细胞凋亡的重要信号转导机制[45]。葛根素可以通过激活PI3K/Akt途径,降低半胱酰天冬氨酸特异性蛋白酶(cysteinyl aspartate specific proteinase, caspase)-3蛋白活性,减少B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)相关X蛋白和裂解的caspase-3蛋白的表达,促进Bcl-2蛋白水平升高,进而减少细胞凋亡[46]。细胞表面死亡受体(fas cell surface death receptor, Fas)基因及Fas配体(fas ligand, FasL)在细胞凋亡过程中也发挥重要作用,葛根素在体内和体外均可通过Fas/FasL和线粒体途径减弱镉诱导的细胞凋亡[47]。此外,炎症与凋亡的关系亦有被探讨,葛根素可以通过抑制组蛋白去乙酰化酶1/3(histone deacetylase 1/3, HDAC 1/3)显著消除果糖诱导的细胞炎症和凋亡[48];亦可通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)/沉默信息调节因子(silent information regulator factor 2-related enzyme, SIRT)1信号通路,抑制NOD样受体热蛋白结构域相关蛋白(NOD-like receptor thermal protein domain associated protein, NLRP)3炎症小体介导的细胞凋亡,从而改善脂多糖诱导的细胞炎症损伤[49]。
3.4 自噬调节机制
自噬在机体的生理和病理过程中都能见到,但其所起的作用尚未完全阐明,Wang等[50]研究发现氧化应激可以诱导自噬发生,而葛根素可以通过Nrf2通路逆转氧化应激诱导的溶酶体功能障碍,恢复自噬,减轻镉诱导的细胞毒性。最近的研究则表明,mTOR在细胞自噬过程中发挥了极为重要的作用,而葛根素可以通过激活AMPK/mTOR信号通路,发挥UNC-51样激酶(unc-51 like autophagy activating kinase, ULK)1的协同磷酸化作用,减轻自噬[8];亦可通过细胞外信号调节激酶(extracellular regulated protein kinases, ERK)/mTOR信号通路介导的自噬途径,减轻小鼠自噬相关蛋白的过度表达[51]。除mTOR相关抑制性途径外,葛根素还可以通过上调14-3-3γ蛋白表达,与蛋白激酶Cε相互作用,进而磷酸化并迁移至线粒体,激活适应性自噬[52]。此外,Zhou等[53]研究表明葛根素可以通过抑制凋亡和恢复自噬活性来减轻镉诱导的肝细胞损伤,故推测葛根素的抗细胞凋亡作用可能与其促进自噬作用有关,有待进一步研究。
总的来说,葛根素所发挥的抗炎、抗氧化等作用往往不是单独存在的,各作用的相互关系虽已逐渐被关注但仍相对较少,而代谢组学等新技术的不断发展更为葛根素复杂作用机理的进一步研究提供了可能。同时研究者虽对葛根素的抗炎作用机理有较为广泛的探讨,但在与之密切相关的免疫调节机制方面的研究却相对较少。近期研究发现,葛根素具有治疗由调节性T细胞缺乏引起的免疫疾病的潜力[54],表明葛根素在免疫调节方面亦可能发挥关键作用。中医认为正气内存则邪不可干,疾病的发生发展与邪胜正衰的关系密切,现代临床治疗中免疫相关制剂也发挥着愈来愈重要的作用,故葛根素的免疫调节机制值得关注和重视。
4 葛根素研究趋势
突现词的发展变化可以预示研究热点的发展演化方向,对预测研究发展趋势有重要价值。因此,本文利用CiteSpace软件进一步分析了葛根素相关研究的突现词变化情况,以便预测葛根素的发展趋势。本研究选择PubMed和Web of science数据库,检索近5年文献,经去重及人工清洗后,进一步对题录数据热点突现分析。如表1所示,糖尿病肾病(diabetic nephropathy)、细胞分化(differentiation)、帕金森(parkinsons disease)和肠道菌群(gut microbiota)等内容为最新的突现词,是葛根素的研究前沿。

表1 葛根素的十大突现词
4.1 糖尿病肾病
葛根素在糖尿病及其并发症中具有较为广泛的应用价值,不仅通过降低血糖水平、改善胰岛素抵抗、抑制炎症和晚期糖基化终产物的形成直接有益于糖尿病;还通过延缓和改善糖尿病并发症,间接对糖尿病有益[55]。在糖尿病患者中,高葡糖和高氧化状态激活转化生长因子(transforming growth factor, TGF)-β的基因表达,并进一步将Smad蛋白转运到肾细胞核,进而引发糖尿病肾病,而葛根素可以抑制TGF-β的过表达和Smad 2/3蛋白的核转位,对血管平滑肌细胞具有保护作用[56]。葛根素还可以增加糖尿病小鼠肾脏中环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的产生,增强cAMP反应元件结合蛋白(cyclic-AMP response binding protein, CREB)磷酸化,减少CREB的过度表达,进而减少高糖诱导的糖尿病肾病小鼠足细胞凋亡[57]。此外,Chen等[58]发现葛根素通过血红素加氧酶(heme oxygenase, HO)和沉默信息调节因子(silent information regulator, SIRT)1介导的自噬上调保护足细胞免受糖尿病诱导的损伤,并认为这是糖尿病小鼠模型中肾脏保护作用的新机制。不难看出,葛根素在糖尿病肾病的预防和治疗中展现出了良好的多靶点协同作用优势,而糖尿病的并发症多样且难以逆转,葛根素多靶点协同作用优势对其他并发症也具有重要意义。
4.2 细胞分化
骨质疏松已成为困扰老年人群的主要疾病,葛根素在成骨分化中所发挥的作用越来越受到重视。研究表明,葛根素可以显著促进成骨细胞增殖,增强碱性磷酸酶活性,增加矿化结节形成[59],并通过Wnt通路激活和氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor, PPAR)γ通路抑制,促进骨髓间充质干细胞发生成骨分化[60]。Zhou等[61]通过建立骨移植大鼠模型,证实葛根素能有效促进骨髓间充质干细胞的增殖和分化,增加移植骨大鼠的骨量和骨形成参数。Yang等[62]亦证实葛根素在体外能促进骨髓间充质干细胞的增殖和成骨分化,在体内能促进新骨再生。此外,葛根素亦可以抑制破骨细胞前体自噬,阻断破骨细胞前体增殖和破骨细胞分化[63]。然而,当前的研究较多围绕成骨细胞、破骨细胞两大靶细胞展开,更加深入且确切的分子机制还有待进一步挖掘和探讨。此外,骨质疏松与糖尿病密切相关且共病机制复杂,葛根素在骨质疏松和糖尿病治疗中所展示出的共同靶点可能是治疗糖尿病骨质疏松症的关键枢纽。
4.3 帕金森病
相关研究表明,葛根素通过提高谷胱甘肽的生物合成能力来减轻1-甲基-4-苯基吡啶离子(4-phenylpyridin-1-ium iodide, MPP+)诱导的氧化应激,通过抑制核排斥诱导核内Nrf2的积累改善了1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)中毒小鼠腹侧中脑的运动缺陷[64],亦可通过孕酮受体(progestogen receptor, PR)信号通路保护原代大鼠中脑神经元免受MPP+诱导的毒性[65]。此外,葛根素可以促进多巴胺神经元的存活、增殖和分化[66],在治疗阿尔茨海默病中的作用亦不可忽视。抑郁症状是阿尔茨海默病进展的标志,葛根素可以通过抑制mTOR相关通路减轻脂多糖诱导小鼠的炎症反应和抑郁行为,具有成为新型抗抑郁药先导化合物的潜力[40]。Liu等[67]利用计算机筛选葛根素对阿尔茨海默病的潜在治疗作用,并结合体内实验进行证明。模拟研究表明,葛根素在分子对接和动力学模拟中具有高度稳定性;实验结果表明,葛根素能抑制乙酰胆碱酯酶活性,使抗氧化防御物质的活性恢复到正常水平,同时降低脑内炎症因子和凋亡基因的表达[67]。当前,神经退行性疾病还无法治愈,但神经保护剂可以减缓中枢神经系统的退化,进而延缓疾病的进展。因此,葛根素的潜在神经保护作用值得进一步开发和利用。
4.4 肠道菌群
葛根素通过上调闭锁蛋白的表达来修复结肠黏液屏障,进而调节肠道菌群的丰富度,维持肠道微生态的稳定[68]。《本草纲目》曰“葛根乃阳明经药,兼入脾经,脾主肌肉”[69]。现代研究亦表明,葛根素可以显著改变肠道微生物的组成,进而改善青年大鼠的前肢握力和肌肉收缩功能[70]。葛根素还能通过调节肠道菌群失调,改善骨微环境,进而发挥抗骨质疏松作用[71]。此外,肠道菌群对宿主的脑功能亦有调节作用,葛根素可以改善应激引起的正常肠道菌群失调,减轻抑郁样行为[72],还能降低抑郁大鼠促炎因子,改善受损结肠组织,表明葛根素抗抑郁作用的潜在机制与通过调节炎症反应实现微生物-肠道-脑轴的双向交流密切相关[73]。中医认为,葛根为阳明经药,具有升阳止泻的作用,以葛根芩连汤为代表的经典方也在肠道疾病的治疗过程中发挥显著作用[74-76],因此葛根素与肠道菌群的关系在一定程度上为葛根及相关方剂治疗肠道疾病的机制探讨提供了一些线索。此外,炎症信号通过肠-脑轴的双向传递[77],葛根素或可沿着肠-脑轴调节炎症反应和免疫稳态。
5 结语
目前,葛根素在心脑血管缺血性疾病、代谢性疾病、肿瘤等重大慢性疾病中所发挥的抗炎、抗氧化、抗凋亡等作用被广泛探讨。缺血性心血管疾病一直是葛根素近年来研究的主要关注点且相应制剂已成功应用于临床。随着对心血管疾病研究的深入,冠状动脉微循环功能障碍对于心肌缺血的影响越来越受到关注。炎症机制是导致冠状动脉微循环功能和结构异常的潜在原因[78],因此抗炎是葛根素治疗多种疾病的共同机制。
不同剂型的葛根素已应用于冠心病、糖尿病等疾病的临床治疗中且在与他药的联合运用中发挥重要协同作用,葛根素的水溶性差、生物利用度低以及对血脑屏障的不完全穿透等问题,限制了其在临床的广泛应用。研究者们依托纳米、自乳化等制备技术,有效增强了葛根素的口服生物利用度和血脑屏障穿透性[79-84]。葛根素生物利用度等问题的有效解决,为葛根素的临床应用提供了更多的可能性。未来,葛根素的应用价值将不仅局限于上述各类疾病,在视网膜缺血/再灌注损伤、特异性皮炎等多种疾病的临床治疗中都可能发挥重要价值[85-86],而相应的高质量临床研究则亟待开展。
不可否认,葛根素近年来的研究较为丰硕且覆盖面广,但葛根素的免疫调节作用、神经保护作用、肠道菌群调节作用等研究仍然较少,值得关注和重视,同时葛根素在糖尿病并发症中所发挥的多靶点协同作用机制以及在骨代谢中所发挥的分子调节机制亦值得进一步深入挖掘。与此同时,葛根素高质量临床试验的缺乏亦是亟待解决的问题。基础医学研究的成果最终还是要应用于临床,除了学术价值,葛根素潜在社会价值、经济价值也为多种疾病的治疗提供了新的方向。

