基于HPLC-Q-Exactive Orbitrap MS/MS整合网络药理学研究衢枳壳降糖的物质基础及作用机制❋
姜莉苑,董 馨,田雨欣,宋剑锋,赵维良,胡颖菲,李梦盈,冯敬骞△
(1.衢州职业技术学院,浙江衢州 324000;2.内蒙古医科大学药学院,呼和浩特 010110;3.衢州市食品药品检验研究院,浙江衢州 324000;4.浙江省食品药品检验研究院,杭州 310052)
据糖尿病国际联盟最新报道,2021年全球成人糖尿病患者约5.37亿,预计到2045年糖尿病患病人数将上升到7.83亿[1]。中药在防治复杂疾病上具有疗效稳定、不良反应小、多靶点同时作用的特点,从天然药物中筛选具有降糖作用的中药作为补充或替代疗法已成为糖尿病治疗研究热点[2-3]。衢枳壳,俗称“胡柚片”,为芸香科植物常山柚橙(Citrus aurantium ‘Changshanhuyou’)的干燥未成熟果实,居“衢六味”品种之首。其性味苦、辛、酸,微寒,归脾、胃经,具有理气宽中、行滞消胀的功效[4-5]。本品于2016年被《浙江省炮制规范(2015版)》收载,在浙江省内作为枳壳替代品使用,化学成分和药效作用与枳壳基本相同[6-7]。目前,临床上将枳壳应用于治疗糖尿病及其并发症[8-10]。虽衢枳壳治疗糖尿病的临床应用鲜有报道,但已有药理学实验证明衢枳壳提取物可促进腺苷酸活化蛋白激酶 (adenosine monophosphate activated protein kinase, AMPK)的活化,抑制肝脏脂质累积,从而明显改善2型糖尿病小鼠胰岛素抵抗[11]。另有研究证实衢枳壳中的柚皮素和橙皮素可通过降低硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP),抑制组蛋白乙酰化修饰过程,对胰岛B细胞起到保护作用[12]。然而这些研究主要通过比较分散的靶点来探讨其治疗糖尿病的作用机制,对全面阐释衢枳壳的降糖作用及特点存在着一定的局限性,不足以科学完整地揭示其内在本质。近年来,网络药理学被广泛应用于中医药治疗复杂疾病的机制研究[13-17]。网络药理学的系统性和协同性与中医药“整体观”研究思路有相同之处,将“一靶一药”转变为“多靶点、多成分”已成为探索中药作用机制的强有力研究策略。
本研究采用高效液相色谱串联四极杆-静电场轨道阱高分辨质谱(HPLC-Q- Exactive Orbitrap MS/MS)技术对衢枳壳给药后血中移行成分进行分析和表征,构建衢枳壳中活性成分库,并基于网络药理学技术,预测衢枳壳治疗糖尿病的关键靶点、通路,为后续衢枳壳的降糖作用机制研究提供科学依据和数据支撑,并为衢枳壳药用价值的开发和临床合理应用奠定基础。动物实验经内蒙古医科大学医学伦理委员会批准,批准号:YKD202301189。
1 材料
1.1 动物
清洁级SD大鼠,雄性,体质量180~240 g,由内蒙古医科大学动物中心提供,动物许可证号:SCXK(蒙)2020-0 003。
1.2 主要药物、试剂与仪器
橙皮苷(批号:wkq21020906;纯度>98%);新橙皮苷(批号:wkq21020406;纯度>98%);柚皮苷(批号:wkq21020606;纯度>98%);芸香柚皮苷(批号:wkq20060103;纯度>98%);柚皮素(批号:wkq21022409;纯度>98%);川陈皮素(批号:wkq21030909;纯度>98%)对照品均购自四川维克奇生物科技有限公司。衢枳壳饮片(批号:2012135)购自衢州南孔中药有限公司,经衢州市食品药品检验研究院主任中药师宋剑锋鉴定,为芸香科植物常山胡柚的干燥未成熟果实。甲醇(货号:210386)、乙腈(货号:216058)均为色谱纯,购自美国Fisher公司。乙醇(货号:A20221161)、甲酸(货号:20220202)均为分析纯,购自国药集团化学试剂有限公司。
17-Exactive液相色谱-质谱联用仪,美国Thermo-Fisher公司;AL204电子分析天平,瑞典METTLERTOLEDO公司;N-1100旋转蒸发仪,上海爱朗仪器有限公司;FDU-1200冷冻干燥机,日本东京理化公司;CVE3110真空浓缩仪,日本东京理化公司。
2 方法
2.1 衢枳壳入血成分鉴定
2.1.1 色谱条件 色谱柱为Agilent Poroshell 120 SB-C18柱(2.7 μm,100 mm×3.0 mm);流动相A为乙腈,B为0.3%甲酸-水,梯度洗脱 0~5 min,90%~80%B;5~10 min,80%~60%B;10~25 min,60%~55%B;25~35 min,55%~0%B;流速为 0.3 mL/min,柱温为35 ℃,进样体积为5 μL。
2.1.2 质谱条件 采用电喷雾离子源正负离子模式(ESI +/-)、Full MS/ddMS2模式,鞘气流速40 L/min;辅助气流速2 L/min;锥孔电压为3 500 V(-)和4 000 V(+);碰撞电压为30 eV;S-lens RF level 50 kV;毛细管离子传输管温度为300 ℃;加热温度为350 ℃。
2.1.3 供试品制备 取衢枳壳粉末(过二号筛)100 g,加64%甲醇1 880 mL,加热回流提取2次,每次1 h,滤过,合并滤液,浓缩,冻干后即得衢枳壳提取物,并放入-20 ℃冰箱保存备用。
2.1.4 对照品溶液制备 精密称取各标准对照品适量,分别置于10 mL容量瓶中,加入甲醇溶解、定容,得到1 mg/mL的各标准对照品储备液。根据需要用甲醇逐级稀释至所需浓度,置于4 ℃冰箱保存备用。
2.1.5 血浆样品制备 将所有大鼠随机分为空白组和给药组,每组6只。试验前12 h禁食,正常饮水,给药组给予衢枳壳提取物药液(给药剂量为临床给药剂量的6倍,36 g/kg),空白组给予等量蒸馏水。结合相关文献[12]及前期预实验结果,灌胃给药2 h后,腹腔麻醉,随后经腹主动脉采集全血,置于含肝素钠的采血管中,静置30 min后以15 984 g离心10 min,分离得上层血浆,并置于-20 ℃冰箱冷冻保存备用。
150 μL空白血浆中加入50 μL混合对照品溶液,涡旋1 min后4 ℃下以15 984 g离心10 min,吸取上清液,制得含混合对照品的血浆样品。
2.1.6 血浆样品处理 用600 μL甲醇提取200 μL血浆,涡旋3 min后静置10 min,将萃取混合物于4 ℃下以15 984 g离心10 min,吸取上清液,并于真空浓缩仪中浓缩干燥。用100 μL 甲醇复溶残余物后涡旋1 min,离心10 min,吸取上清液于液质小瓶内,待进样分析。含混合对照品的血浆处理方法同上。
2.1.7 结构鉴定数据处理 结合Mass Frontier软件获取各化合物分子式,质谱偏差范围为δ≤10×10-6,模拟出碎片离子的结构式,结合Scifinder等数据库及相关文献报道推测可能的化合物结构及裂解方式。此外,通过对照品对鉴定的化学成分进一步确定,而未能获得对照品的化合物则根据以上方法进行初步结构推测鉴定。
2.2 网络药理学分析
2.2.1 衢枳壳入血成分靶点、疾病靶点的筛选 从TCMSP数据库中收集衢枳壳入血成分的Pubchem Cid,借助SuperPred和Swiss Target Prediction数据库,获取成分作用靶点,去重后得到衢枳壳各成分靶点数据库。使用GeneCards数据库和OMIM数据库,以“diabetes”为关键词搜索疾病的相关靶点并进行标准化处理,去除重复后即得糖尿病相关靶点。
2.2.2 蛋白互作(protein-protein interaction, PPI)网络构建和核心靶点的筛选 为确定成分靶点和疾病靶点之间的作用关系,需通过Venny 2.1.0网站制作韦恩图。将收集得到的成分靶点和疾病靶点分列导入集合中,并将两部分集合各自命名,中间交集部分即为潜在靶点。将筛选出的衢枳壳各化学成分、潜在靶点以及疾病“diabetes”导入Cytoscape 3.9.1软件中,形成“成分-靶点-疾病”相互作用网络。将衢枳壳的潜在作用靶点上传至String数据库,分析结果继续导入Cytoscape3.9.1软件,构建蛋白质相互作用的PPI 可视化网络,通过筛选网络拓扑学关键性质来确定核心靶点。
2.2.3 GO和KEGG富集分析的构建 于DAVID数据库中对上述筛选出的32个核心靶点开展通路富集分析,把参数(Select Identifier)设置为OFFICIAL GENE SYMBOL,列表类型为Gene list,限定物种为人,其他均为默认值,获取GO和KEGG富集分析结果,再使用微生信平台对得到的结果进行可视化分析,以用于后期试验验证。
2.2.4 分子对接验证 选择筛选过的在PPI网络中排名前5位的核心靶点及核心成分进行分子对接模拟。在PubChem数据库中下载化合物的2D或3D结构,借助Chem3D软件进行结构优化,将其另存为“PDB”格式,作为小分子配体。在RCSB PDB数据库中下载靶点蛋白的3D 晶体结构,并使用PyMOL软件去除水分子和自由基,加氢。采用Autodock 1.5.7软件进行分子对接,对接分数越低,代表结合越稳定。
3 结果
3.1 入血成分鉴定结果
基于查找出的衢枳壳中的化学成分,结合相关文献[18-19]及质谱一级、二级分子量信息,利用Xcalibur软件,在正离子及负离子扫描下,共识别出化合物20个。各模式下总离子流图见图1。化合物详细结果信息见表1。

A.为正离子模式;b.为负离子模式
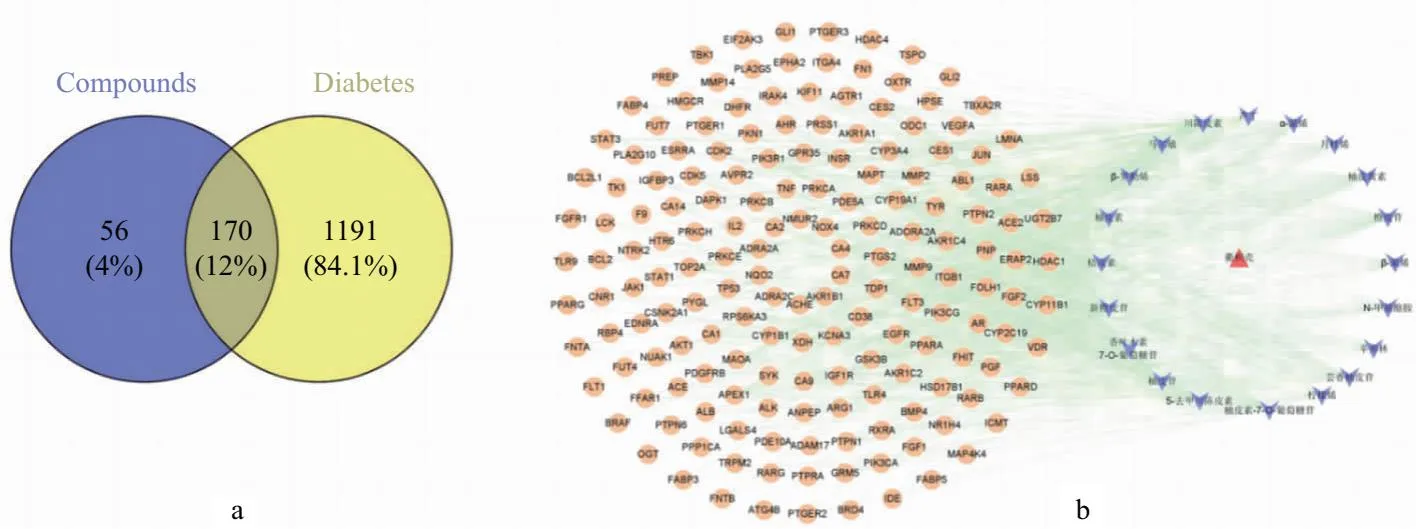
A.成分靶点和疾病靶点韦恩图; b.成分-靶点-药物相互作用网络图

表1 衢枳壳入血成分鉴定
3.2 网络药理学分析结果
3.2.1 活性成分-靶点-疾病靶标关联网络 检索SuperPred和Swiss Target Prediction数据库,去重后得到成分相关靶点226个;将从GeneCards(筛选Relevance score>1的靶点)与OMIM两数据库富集得到的靶点整合去重,得到疾病相关靶点1 361个。运用VENNY2.1.0将成分靶点和疾病靶点做韦恩图,获得到的交集靶点即为衢枳壳治疗糖尿病的潜在靶点170个,结果见图2a。将上述20个化学成分、1个药物、170个潜在靶点导入Cytoscape-3.9.1软件,绘制成分-靶点-药物关联网络,结果见图2b。在网络中,共191个节点(1个药物节点,20个化学成分节点,170个靶点节点),775条边,其中红色三角形代表衢枳壳,紫色箭头代表各化学成分,黄色圆形代表靶点基因。
3.2.2 核心靶点网络 上传潜在靶点至String数据库,获取蛋白质互作网络,导出数据,筛选Degree unDir(18.662 65),Closeness unDir(0.002 78),Betweenness unDir(203.759 03)以上的32个靶点为核心靶点见图3。
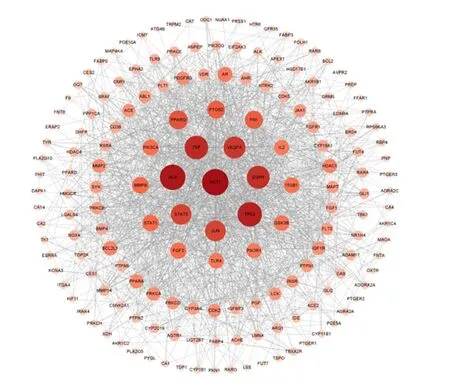
图3 衢枳壳核心靶点关联网络
3.2.3 GO功能富集和KEGG信号通路分析结果 将筛选出的32个核心靶点于DAVID数据库中进行功能富集和信号通路分析,筛选P<0.05,结果显示生物过程(biological process, BP)共涉及215个,主要有基因表达的正负调控、转录的正调控,DNA模板化、RNA聚合酶Ⅱ启动子转录过程的正调控,凋亡过程的正调控等;分子功能(molecular function, MF)共涉及61个,主要有酶结合、相似蛋白结合、转录因子活性序列特异性DNA结合、转录因子RNA聚合酶Ⅱ序列特异性DNA结合等;细胞组分(cellular component, CC)共涉及28个,主要有高分子配合物、细胞质、细胞外空隙、胞外区、核染色质等,绘制的GO功能富集图见图4。KEGG信号通路分析结果主要包括:缺氧诱导因子(hypoxia-inducible factor, HIF)-1信号通路、晚期糖基化终末产物 (advanced glycation end products, AGE)-晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)信号通路、癌症蛋白聚糖信号通路、化学致癌-受体激活通路等。KEGG通路气泡图如图5所示。
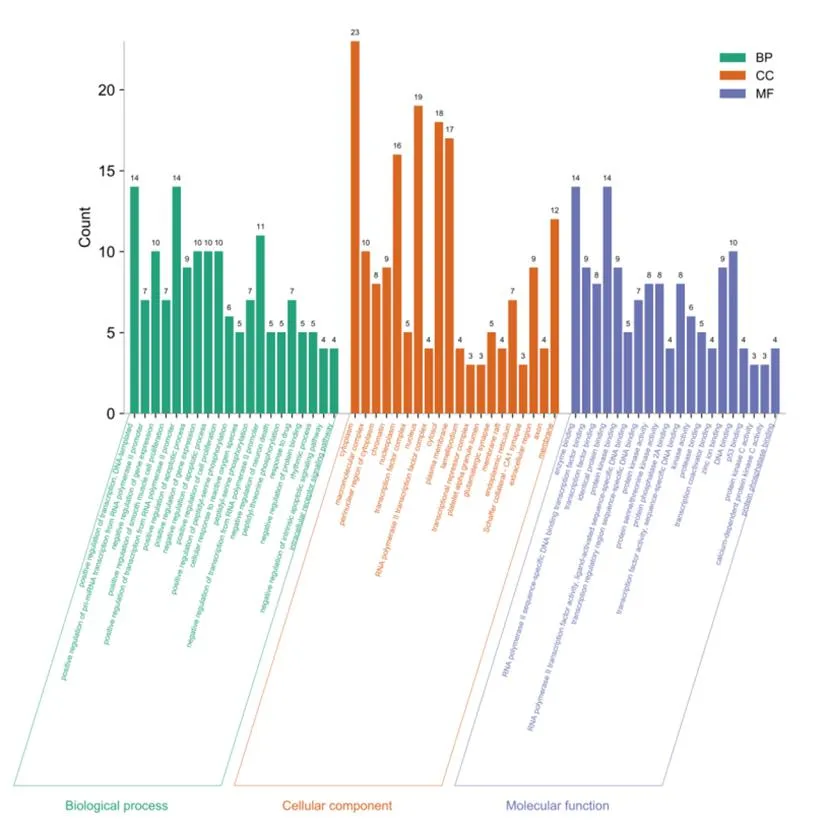
图4 衢枳壳核心靶点GO功能分析

图5 衢枳壳核心靶点KEGG通路气泡图富集分析
3.2.4 分子对接结果 将PPI网络中度值排名前5位的靶蛋白与“成分-靶点-通路”网络对应的度值前5位的有效成分进行分子对接验证。通过分子对接验证两者间结合活性,结果见图6。结果显示,衢枳壳中度值排名前5的核心成分芦丁、橙皮苷、新橙皮苷、芸香柚皮苷、川陈皮素与5个核心靶点丝氨酸/苏氨酸蛋白激酶(RAC serine/threonine-protein kinase, AKT)1(PDBID:1 UNQ)、白蛋白(albumin, ALB)(PDBID:6YG9)、细胞肿瘤抗原p53(Cellular tumor antigenp 53, TP53)(PDBID:1GZH)、肿瘤坏死因子(tumor necrosis factor, TNF)(PDBID:5UUI)、表皮生长因子(epidermal growth factor receptor, EGFR)(PDBID:2XKN)的靶点结合能均小于0,这表明活性成分能与对应靶点自发结合,且结合能越小表明对接越稳定(1 kcal=4.186 J)。其中、ALB、TP53、EGFR与5个核心成分的结合能均<-6.0 kcal/mol表明它们对接稳定并具有较好活性。而橙皮苷与ALB(PDBID:6YG9)、芸香柚皮苷与ALB(PDBID:6YG9)均<-10 kcal/mol表明它们的活性较高。运用Discovery studio进行可视化分析,部分结果如图7所示。

图6 分子对接结果热图
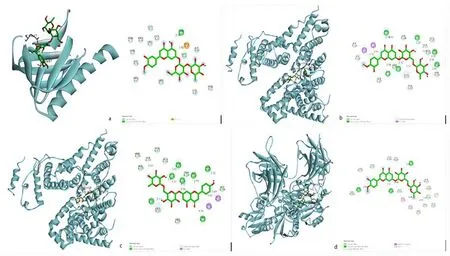
A.新橙皮苷-苏氨酸蛋白激酶(AKT)1; b.橙皮苷-白蛋白(ALB); c.芸香柚皮苷-白蛋白(ALB); d.橙皮苷-细胞肿瘤抗原p53(TP53)
4 讨论
本文采用HPLC-Q-Exactive Orbitrap MS/MS联合网络药理学技术探究衢枳壳降糖的物质基础及作用机制,同时借分子对接技术对衢枳壳发挥降糖作用的机制进行了验证。结果显示衢枳壳降糖过程中存在多成分、多靶点协同起效的现象。
本研究结果显示,采用衢枳壳提取物灌胃给药后,有20个成分入血吸收,其中芦丁、橙皮苷、新橙皮苷、芸香柚皮苷、川陈皮素等成分与糖尿病关键靶点结合能低,活性较高,因此,推测以上5个成分为衢枳壳治疗糖尿病的关键起效成分。相关报道显示,芦丁可通过促进胰岛素对葡萄糖的摄取率和利用率,提升机体对胰岛素的敏感度,进而改善患者血糖[20]。橙皮苷可通过抑制肾脏组织中mRNA的表达,进而改善肾功能、减轻蛋白尿,保护糖尿病引发的肾功能损伤[21]。另有学者发现,新橙皮苷则通过增加肝细胞中葡萄糖的消耗,发挥降糖和降脂功效[22]。Chen等[23]发现芸香柚皮苷可有效防治糖尿病肾病,能够降低细胞外基质的积累,增加基质金属蛋白酶(matrix metalloproteinase, MMP) -2的表达。此外,川陈皮素对改善急性肾脏损伤、恢复肾功能有积极作用[24]。
网络药理学结果显示,AKT1、ALB、TP53、TNF、EGFR等为衢枳壳降糖过程中核心靶点,与以往研究结果一致。其中AKT1在调节细胞的生存、蛋白合成、血管形成以及胰岛素依赖的细胞应答、新陈代谢等方面发挥重要作用[25-26]。而ALB基因则可直接作用于肾小球[27]。TP53则可通过调节葡萄糖的转运,控制糖酵解和糖异生等延缓糖尿病进程。不少研究表明,TNF信号通路可以影响细胞存活和分化及免疫和炎症反应[28],进而抑制糖尿病并发症的发生。此外,本研究借助GO和KEGG分析,发现衢枳壳通过调控HIF-1信号通路、AGE-RAGE信号通路、EGFR信号通路等发挥降糖作用。HIF-1信号参与抑制氧化应激、肾功能保护过程[29]。AGE-RAGE信号通路也被证实是糖尿病肾病的重要发病通路之一[30]。
综上所述,衢枳壳中的芦丁、新橙皮苷、橙皮苷、芸香柚皮苷、川陈皮素等活性成分可能为衢枳壳降糖的物质基础,且通过作用于AKT1、ALB、TP53、TNF、EGFR等核心基因调控HIF-1信号通路、AGE-RAGE信号通路、EGFR信号通路等发挥治疗效果,但更深层次的机制与作用过程仍需进一步生物学实验进行验证,同时应结合临床深入探究。

