基于网络药理学及生物信息学探讨藤梨汤治疗结直肠癌的作用机制研究
罗字呈,杨 桃,陈 江,曹一波,胡文婷,曾 炼,肖天保
(1贵州中医药大学第一临床医学院,贵州 贵阳 550025;2贵州中医药大学第一附属医院肛肠科,贵州 贵阳 550001)
结直肠癌(colorectal cancer,CRC)发病率高达10%,已成为全球第三大常见恶性消化道肿瘤,仅次于乳腺癌和肺癌[1]。根据2020年全球癌症统计数据显示,CRC的死亡率占所有癌症相关死亡的9.4%,居全球恶性肿瘤的第2位,具有发病率高、病死率高等特点[2]。CRC在早期阶段具有强隐匿性,典型症状缺乏,癌变增多会出现大便习惯改变、便血、腹部肿块、腹痛腹泻、肠梗阻等相关症状[3-4]。目前,手术根治及辅助化疗及新辅助化疗是早期CRC治疗的一线治疗手段,但由于CRC起病隐匿且危害性极强、缺乏特异性、不容易早期发现、容易发生转移、浸润转移早等特点,25%的患者首次诊断就存在远处转移,另有25%的患者在确诊后发生转移,且转移性CRC绝大部分无法治愈,5年生存率仅14%,预后较差[5-6]。2020年中国癌症统计报告显示,中国CRC发病率和死亡率分别位居所有恶性肿瘤的第2位和第5位;截至2022年,我国CRC发病人数为592 232例,死亡人数为309 114例,严重威胁国民健康[7]。
CRC归属于中医“癌病”“肠蕈”“锁肛痔”等范畴。“肠蕈”病名最早记录于《黄帝内经》的《灵枢·水胀》篇章,辨证主要以“虚、滞、湿、热、瘀”为主。脾虚胃弱,湿热、痰浊、血瘀等邪浊是CRC发生发展的关键。研究表明,CRC发病机制是一个复杂的生物学过程,是具有多种致病机制的异质性疾病,涉及细胞周期阻滞、细胞侵袭及转移抑制、肿瘤信号转导途径调节、相关基因与蛋白表达抑制等机制[8-10]。藤梨汤及其复方制剂是长期以来用于治疗CRC的临床经验方,以扶正祛邪为治疗大法,核心药物为藤梨根、冬凌草、鳖甲、黄芪、当归。研究表明,藤梨汤可通过参与生物学过程改善CRC患者临床症状、增强机体免疫系统能力、提高放化疗敏感性、降低放化疗的不良反应、减轻CRC术后骨髓抑制等[11-12],但藤梨汤能否直接治疗CRC,通过什么作用机制,这些都亟待进一步研究。网络药理学已被证明可以有效研究中药复方机制[13]。通过癌症基因组图谱计划(The Cancer Genome Atlas,TCGA)数据库收集、整理各种癌症相关的组学数据库,使用基因组分析技术调查癌症中的基因组变化,可为癌症研究的各个方面提供参考[14]。基于此,本研究应用网络药理学和生物信息学研究方法,并通过分子对接技术加以验证,以探究藤梨汤治疗CRC的潜在机制及预后分析。
1 资料与方法
1.1 资料
分别在TCMSP(https://old.tcmsp-e.com/tcmsp.php)与SymMap(www.symmap.org)中检索藤梨根、鳖甲、当归、黄芪、冬凌草5味中药,在TCMSP数据库中设置口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18筛选活性成分,并通过CNKI数据库对相关成分进行补充,使用SwissADME数据库(http://www.swissadme.ch/)筛选药物活性后,通过TCMSP及SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)查询预测化合物的相关靶点。将所得的作用靶点统一在UniProt数据库(https://www.uniprot.org)进行规范。
1.2 方法
1.2.1 数据库检索及筛选 在GeneCards数据库、TTD数据库、OMIM数据库、DisGeNET疾病靶点数据库中,以“colorectal cancer”为关键词进行检索,获得CRC相关疾病基因;GeneCards和DisGeNET数据中,score值大小是反映靶点与疾病相关性的重要指标。将DisGeNET数据库score值设置为≥0.1进行靶标筛选;GeneCards数据库设定score大于3倍中位数作为标准筛选与CRC联系较为紧密的靶点。将疾病靶点代入UniProt数据库规范基因名称,合并去除重复及无法规范的靶点。此外,基于TCGA数据库中CRC患者RNA Seq的数据为研究基础,分为正常组和肿瘤组,以|log(Fold Change)|>2且P<0.05为筛选条件得到差异基因,再通过Excel将数据库检索获得的疾病基因与TCGA数据库所得的差异基因合并去重,作为CRC的疾病靶点。
1.2.2 藤梨汤治疗CRC的蛋白质-蛋白相互作用(protein-protein interaction,PPI)网络的构建及核心靶点预测 将藤梨汤治疗CRC的关键靶点集上传至STRING平台(https://string-db.org/)进行PPI分析,物种设置为“Homo Sapiens”,要求最低互动分数大于0.4,删去网络中的游离节点,获得藤梨汤治疗CRC的PPI网络。根据最大相关准则筛选交集靶点中前15个的核心靶点,以此构建藤梨汤与CRC的核心靶点网络。
1.2.3 藤梨汤治疗CRC网络可视化分析 将药物有效成分靶点与疾病靶点输入Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)中,取两者交集作为关键靶点,即藤梨汤治疗CRC的潜在作用靶点,并绘制韦恩图。利用Cytoscape 3.9.1软件,建立“药物-有效成分-共同靶点-作用通路”相互作用的综合网络图,通过该网络来探究藤梨汤治疗CRC的核心活性成分的相关靶蛋白通路调控潜在机制。
1.2.4 GO功能富集分析和KEGG通路富集分析 使用Metascape平台对药效靶点实施基因本体GO功能富集分析与KEGG通路富集分析,过滤条件为P≤0.05,并将数据导入在线工具实现数据可视化。
1.2.5 分子对接及可视化处理 将拓扑学参数排名靠前的大分子和小分子进行分子对接。蛋白质晶体结构从AlphaFold数据库(https://alphafold.ebi.ac.uk/)获得。对接小分子库由TCMSP数据库通过搜索中药获取并建立。首先使用AutoDockTools软件对分子进行去水、加氢操作,并同时进行受体结构准备工作。使用Open Babel及AutoDock程序对小分子库进行拆分等准备工作。将活性成分结构与处理后的蛋白结构导入AutoDockTools软件进行旋转对接,计算过程采用Local Search 4.2算法进行计算,并根据结合能及结合位点数目评估最终对接结果,如果结合能< 0 kJ/mol,认定能够自发地结合分子与蛋白,再使用PyMOL进行可视化处理。
1.2.6 藤梨汤治疗CRC生存预后分析 基于TCGA数据库与药物有效成分,利用Cytoscape 筛选前15个Hub基因,获取结肠癌预后数据和匹配的生存数据,采用梯度提升 (gradient boosting machine,GBM)算法构建预测模型(node size=5)。利用校准曲线和受试者工作特征曲线下面积(area under the curve,AUC)来评价预测模型的可靠性和判别力;使用决策曲线分析用于评测列线图是否能潜在应用于临床之上;Kaplan-Meier曲线用于测试两组间的生存差异;使用用双侧检验,P<0.05表示差异有统计学意义。
2 结果
2.1 藤梨汤活性成分与作用靶点
通过TCMSP数据库及SymMap数据库检索到藤梨汤(藤梨根、鳖甲、当归、黄芪、冬凌草)的35种活性成分(OB≥30%和DL≥0.18),SymMap数据库检索到4种活性成分,CNKI数据库中搜索补充冬凌草11种活性成分,在筛选出的50种活性成分中,去重后共有30种活性成分查询到对应靶点蛋白,利用UniProt数据库探查出靶点蛋白所对应的基因名称,选取已验证且物种来源为“human”的结果,去重后得到622个中药靶点。
2.2 CRC疾病靶点的预测
以“colorectal cancer”为关键词,在GeneCards、TTD、OMIM、DisGeNET疾病靶点数据库中进行检索,再通过选取大于中位数的基因,去重后获得CRC相关疾病靶点2 163个。通过分析TCGA数据库中RNA Seq的数据,得到25 853个差异表达基因,包括上调基因18 230个,下调基因5 123个,分别绘制热图(图1A)和火山图(图1B)来表达差异基因的分布。将TCGA数据库得到的差异基因与上述6个数据库获得的疾病基因在Excel软件中合并去重,共获得CRC疾病靶点27 057个。
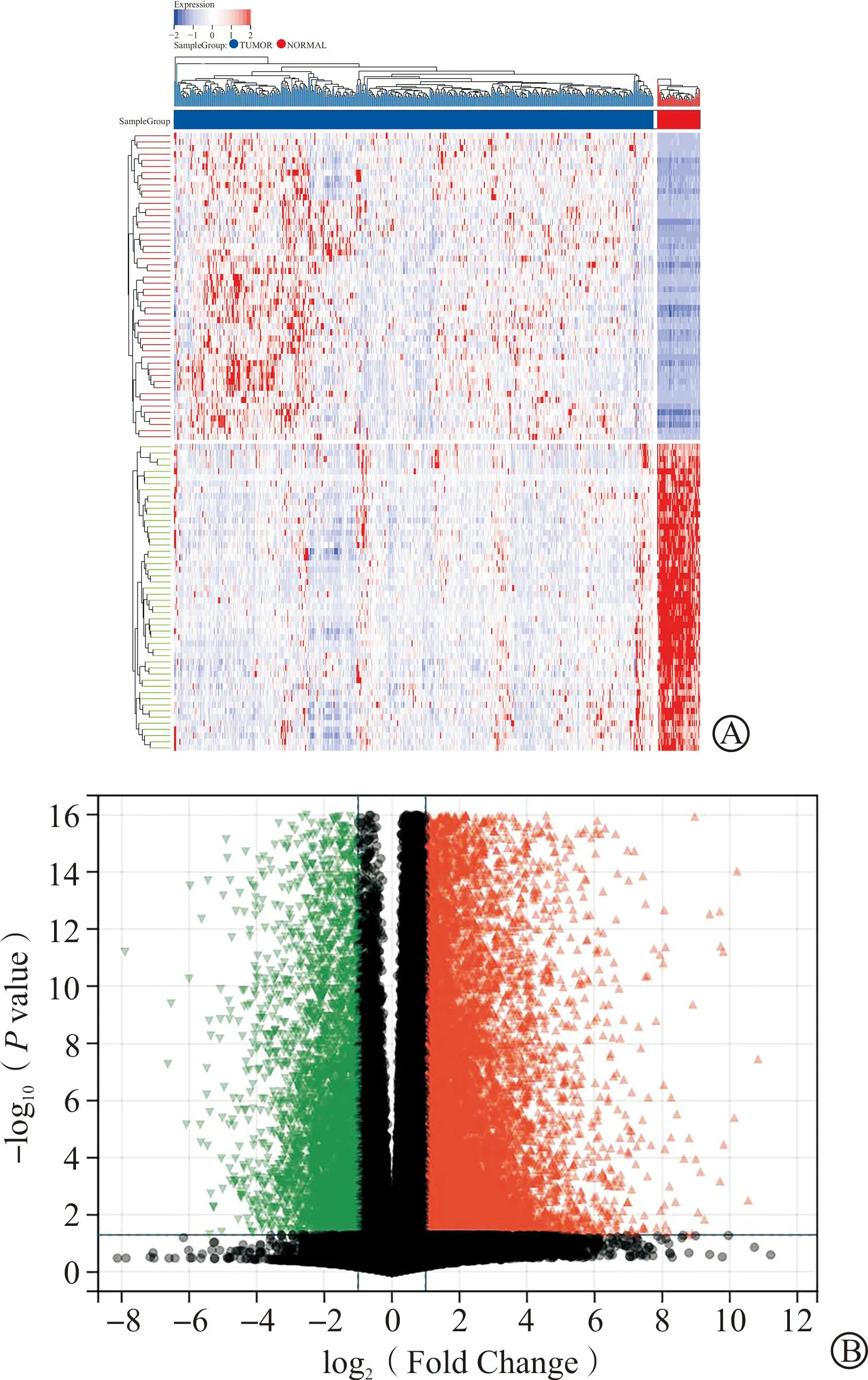
A:CRC差异基因热图(红色为上调,蓝色为下调);B:CRC差异基因火山图[图中将P值进行-log10转化,-log10(P value)越大表明差异越显著,红色代表上调,绿色代表下调]。CRC:结直肠癌。
2.3 藤梨汤治疗CRC的PPI网络及交集靶标PPI构建
运用Venny 2.1平台将藤梨汤中药靶点与CRC疾病靶点取交集,得到417个靶点,即藤梨汤治疗CRC的关键靶点,同时绘制韦恩图(图2)。

图2 药物成分与疾病靶点图
为深入研究藤梨汤治疗CRC的作用机制,将筛选出的417个关键靶点导入至STRING平台,要求最低互动分数大于0.4,去除部分游离节点后,获得藤梨汤作用于CRC的PPI网络(图3A),借助Cytoscape 3.9.1进行可视化处理与分析核心靶点,包括378个节点,2 499条边,以最大相关准则得分为依据,筛选PPI网络中排名前15的靶标蛋白作为核心靶标,分别为BCL2、TP53、CTNNB1、STAT3、MYC、CCND1、ESR1、AKT1、MTOR、CASP3、TNF、JUN、SRC、PTGS2、HSP90AA1(图3B)。
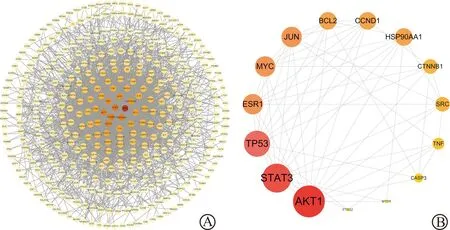
图中节点越大,红色越深,表示度值越大,网络中越处于核心地位。
利用Cytoscape 3.9.1软件对数据进行“药物-活性成分-共同靶点-作用通路”网络的构建,得到了一个包含459个节点和1 883条边的网络,分别计算网络中各节点的degree、中介中心性和接近中心性,按照degree值由高到低排列,排名前三的成分为槲皮素、异鼠李素、信阳冬凌草甲素(图4)。

橙色菱形为中药,蓝紫色方形为有效成分,绿色圆点为上调靶标,蓝色圆点为下调靶标,黑色边框为通路相关靶标,红色标记为通路。
2.4 GO功能富集分析和KEGG通路富集分析
将藤梨汤与CRC的417个交集关键靶点导入Metascape数据库进行GO富集分析,以P<0.05为筛选条件,得到GO条目6 308个,其中生物学过程5 093条、细胞组成432条、分子功能783条。选择富集程度前10个条目进行可视化并生成条形图(图5A)。
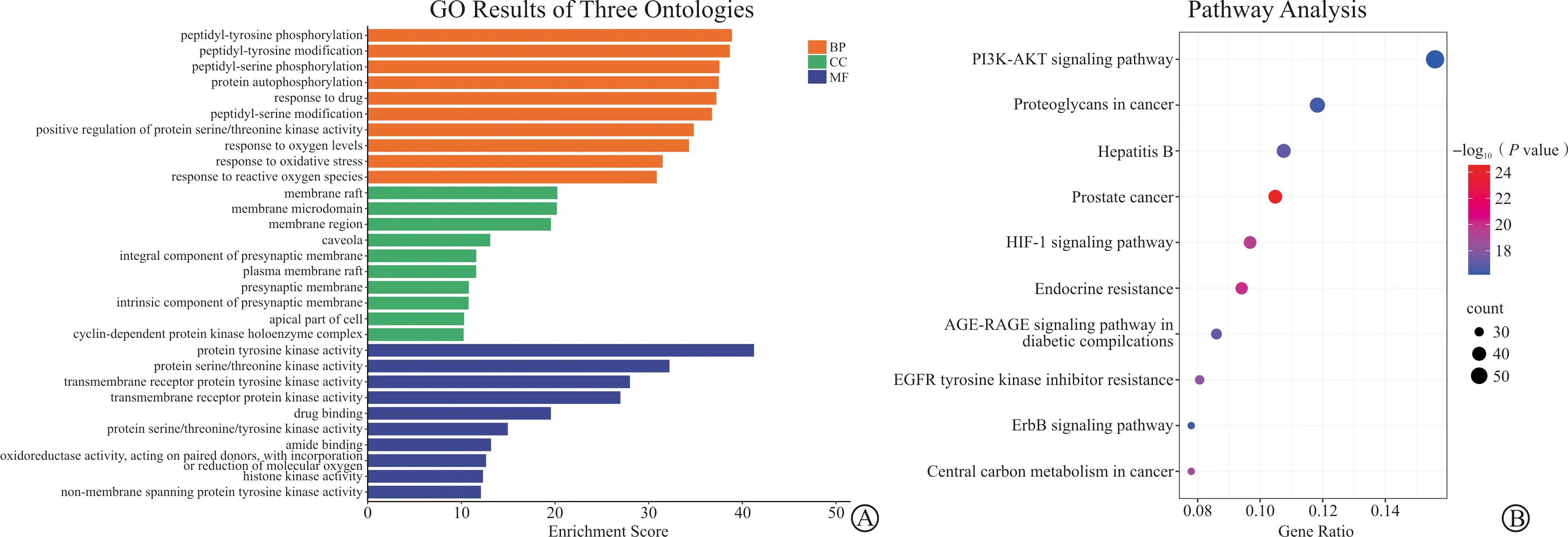
A:GO富集分析(前10条);B:KEGG富集分析结果(前10条)。BP:生物学过程;CC:细胞组成;MF:分子功能。
利用Metascape数据库对交集关键靶点进行KEGG富集分析,以P<0.05为筛选条件,结果显示关键靶点富集在296条通路上,将输出结果按-log10(P)值降序排序得到前20条关键信号通路绘制富集分析条形图,其共同靶点主要富集于PI3K-AKT信号通路、proteoglycans in cancer信号通路、HIF-1信号通路、Hepatitis B、ErbB信号通路等(图5B)。
2.5 分子对接
为验证藤梨汤对CRC的调控作用,将部分核心靶点(TP53、AKT1、STAT3)槲皮素、异鼠李素、信阳冬凌草甲素进行分子对接,其中TP53与槲皮素、信阳冬凌草甲素、AKT1与槲皮素、AKT1与异鼠李素、AKT1与信阳冬凌草甲素、STAT3与信阳冬凌草素的结合能均<-25.10 kJ/mol,提示其具有良好的对接活性(表1,图6)。

表1 藤梨汤核心靶点分子对接结果

图6 藤梨汤活性成分配体与各靶点对接结果
2.6 藤梨汤治疗CRC生存预后分析
采用机器学习GBM(node size=5)构建前15组基因进行预测模型构建,决策曲线分析法模型结果显示,基于机器学习建立的单独使用藤梨汤治疗的模型具有良好的临床收益(图7A);校准曲线显示,在1年的预测值与观察值最为贴合,其次为3年预测值,5年预测值与观察值差异略大,提示模型预测值与真实值相近,具有良好的校准能力(图7B);TimeROC验证预测模型的区分度,结果显示,15组基因用于预测1、3、5年生存情况的AUC分别为0.796、0.749和0.722,表明15组基因对CRC预后结果具有一定的诊断效能(图7C);Kaplan-Meier分析(Log-rank检验)结果显示,在总生存率及疾病特异性生存期比较中,低表达组生存率均显著高于高表达组(P<0.001,图7D~E)。非参数检验(Kruskal-WallisH检验)结果显示,15组基因表达量在不同T分期、M分期、N分期中具有统计学意义(P=0.003),其中,在T3期表达量最高,其次为T1期、T2期,T4期表达量最低,M0期表达量显著高于M1期,N1期表达量最高,其次为N0期,N2期表达量最低。综上,提示15组基因的升高及降低均对CRC的生存预后有一定影响(图7F~H)。
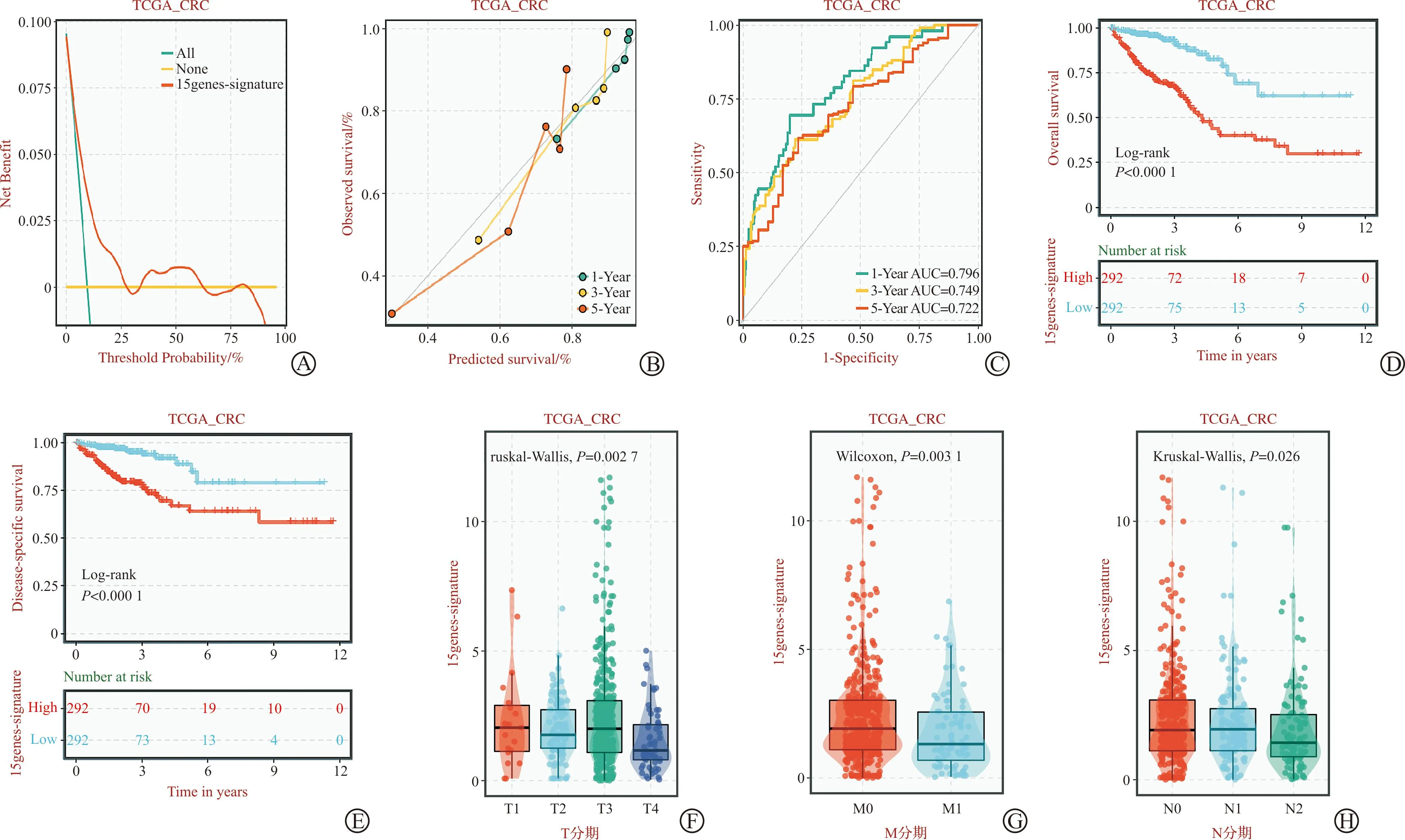
A:决策曲线评价;B:校准曲线评价;C:曲线下评价区分度;D:总生存期;E:疾病特异性生存期;F:T分期表达;G:M分期表达;H:N分期表达。
3 讨论
CRC是由于寒、湿、瘀、毒等因素淤积,脏腑功能紊乱、气血阴阳失调导致的病变,病位在肠,与脾、肝、肾密切相关。脾虚失运痰湿内生,积于肠道,肾虚温化无力,久而久之痰湿瘀阻脉络,形成癌毒。国医大师周仲瑛及刘尚义大师提出,脾虚胃弱,湿热、痰浊、血瘀等邪浊是CRC发生发展的关键,强调将扶正培本、抗癌解毒配合化痰软坚、逐瘀散结为法。贵州中医药大学第一附属医院临床常用藤梨汤方扶正祛邪,调整阴阳,方中藤梨根为君,清热解毒,化瘀黄芪为臣,益气扶正,鳖甲、冬凌草抑癌消肿,化浊解毒,亦为臣,当归为佐,活血化瘀、通络散结;全方扶正祛邪兼顾,使正气得振,瘀毒得解,机体最终阴阳平和[15-17]。
本研究中通过PPI分析得到AKT1、TP53、STAT3、ESR1、MYC、JUN等前15个Hub蛋白,这些基因广泛参与了癌细胞增殖、凋亡、炎症、肿瘤迁徙和转移等各方面。AKT是由3种异构体AKT1、AKT2和AKT3组成的丝氨酸苏氨酸蛋白激酶家族,AKT1是PI3K/AKT通路下游的关键蛋白,活化后可激活mTOR基因表达[18]。而PI3K/AKT通路是有由激酶级联组成,通过特定激酶、磷酸酶及调控蛋白质磷酸化或去磷酸化发挥作用,是调控细胞基本生物功能的重要内途径,其异常激活存在于所有恶性肿瘤中,PI3K/AKT信号通路被激活后,完全活化的AKT可通过磷酸化抑制GSK3激活,进而促进细胞周期促进因子激活,抑制细胞周期蛋白D1降解,加速细胞周期进程[19-20]。同时,研究证明将AKT1基因敲除后,可以减弱结肠肿瘤细胞的转移和生长[21]。TP53是一种重要的抑癌基因,在DNA损伤、缺氧、营养缺乏和致癌信号等的刺激作用下,p53可促进细胞周期阻滞、细胞衰老和凋亡。在43%的CRC中,TP53基因发生了突变[22]。
网络药理学整合并运用了系统生物学、计算机模拟技术、基因组学及蛋白质组学等多种手段和技术,以阐释药物-基因-靶点-疾病之间复杂的生物网络关系,综合应用于研究中药复方作用靶点及作用机制[23]。基于网络药理学技术,本研究表明藤梨汤治疗CRC中发挥关键作用的活性成分可能为槲皮素、异鼠李素、信阳冬凌草甲素、华良姜素等。
分子对接结果显示藤梨汤中的主要活性成分均可自发地与潜在靶点相结合,通过相互作用形成较为稳定的构象。首先,槲皮素通过抑制STAT3通路,有利于抑制CRC的侵袭和转移,抑制血管生成因子的表达,抑制肿瘤的迁徙和转移[24-25];通过控制AKT/PI3K信号通路、Wnt/β-catenin信号通路、EGFR信号传导途径抑制癌细胞的增殖[26];抑制TGF-β1/Smad3/c-Myc信号通路使靶基因的表达下调,抑制结肠癌LOVO细胞的增殖[27-28];上调促凋亡蛋白p53表达诱导癌细胞凋亡且上调p53基因表达使其下游的Gadd45a基因表达增高以抑制CRC发生[29];此外,异鼠李素是一种来源于天然植物的黄酮类药物,可以阻滞细胞周期、诱导细胞凋亡、促进细胞自噬、抑制癌细胞侵袭、转移,提高放化疗敏感性等作用,同等摩尔浓度下,其抗氧化活性较槲皮素更强[30]。异鼠李素通过下调抗凋亡相关蛋白Bcl-2的表达,增加促凋亡相关基因Bax的表达,促进PI3K/AKT/mTOR通路的激活,从内源性线粒体途径促进细胞凋亡[18]。除强大的抗氧化能力之外,异鼠李素还可通过调节NF-κB、AP-1和JAK-STAT3通路抑制促炎因子生成释放,从而发挥细胞保护作用;通过诱导细胞S期阻滞,以抑制作用于人HCT116和SW480两种结肠癌细胞的增殖[31-32]。最后,信阳冬凌草甲素是冬凌草中分离的二萜类成分,具有抗癌活性。前期研究发现信阳冬凌草甲素抑制SW620细胞的增殖,诱导癌细胞凋亡,提高p53总水平和磷酸化水平,从而降低肿瘤在小鼠中的生长速度[33]。因此,核心网络涉及的靶点主要在细胞增殖分化、迁徙、抑制能量代谢及抑制肿瘤进展等过程中发挥作用。
此外,GO功能富集分析结果也显示与细胞生长、蛋白磷酸化、氧化应激反应、对药物的反应、氧化应激反应等紧密相关。KEGG通路富集分析结果也显示,藤梨汤主要与PI3K-AKT信号通路、HIF-1信号通路、癌症中的蛋白多糖、Hepatitis B、ERbB信号通路、p53信号通路相关。HIF-1影响血管生成和新陈代谢重要通路之一,最终促进肿瘤的发生和进展,而可通过抑制HIF-1激活,促进肿瘤细胞凋亡,被认为是防治癌症有希望的靶点[34-35]。这些都进一步证实藤梨汤核心药效成分可以协同作用于AKT1、STAT3、p53等多个关键靶点,并在PI3K-AKT、Proteoglycans in cancer等多条通路参与调控下抑制CRC中基因表达及氧化应激反应损伤,控制相关炎症避免肠癌发生。而这些基因的表达也与CRC的预后情况密不可分。通过GBM机器学习算法预测模型对前15个交集基因进行预后风险评估,结果显示,高危组患者预后较差,总生存期及疾病特异性生存期较短,而在CRC TNM分期中基因表达高低也具有特异性,对CRC生存预后有影响,与文献报道一致[36]。
综上所述,藤梨汤可能通过槲皮素、异鼠李素、信阳冬凌草甲素等活性成分,基于TP53、AKT1、STAT3等靶点,调节PI3K-AKT信号通路、Proteoglycans in cancer通路、HIF-1信号通路等通路治疗CRC。表明藤梨汤治疗CRC具有多成分-多靶点-多途径的特点。通过模型预测,也表明基因的表达也对CRC的生存预后密切相关。然而研究仍有不足之处,因为研究数据来源于各大数据库,使用网络药理学研究时可能出现某些成分及靶点丢失,基因搜索不完全,同时,因为研究结果均为预测得出,藤梨汤治疗CRC的作用机制仍需进一步的动物及细胞实验验证。

