WTAP通过上调糖酵解抑制结直肠癌细胞分化
董可为,沈 尧,王 帅,樊小艳,徐 栋,郝 俊,李纪鹏,张 健
(空军军医大学:1基础医学院生物化学与分子生物学教研室,2西京医院实验外科,陕西 西安 710032)
结直肠癌是全球范围内最常见的恶性肿瘤之一。近年来,随着生活水平的提高和饮食习惯的改变,我国结直肠癌发病率呈现显著上升趋势,由结直肠癌带来的健康问题日益严峻。虽得益于治疗方法的改进,肿瘤相关致死率有所下降,但其依然位列恶性肿瘤第3位[1-2]。结直肠癌细胞具有潜在的分化能力,但其分化成熟却伴随着增殖减弱和细胞周期阻滞。尽管近年来结直肠癌分子遗传学相关研究进展迅速,但其增殖分化的调控机制尚不清楚。
N-6-甲基腺苷(N6-methyladenosine,m6A)是一种常见的RNA修饰方式,参与RNA转录、翻译、稳定性和核输出等过程,在肿瘤的发生发展中扮演重要角色[3-5]。Wilms肿瘤抑制因子1相关蛋白(Wilms’ tumor 1-associating protein,WTAP)作为RNA m6A修饰的重要元件,可与甲基转移酶样3(methyltransferase-like 3,METTL3)和METTL14等形成功能复合体,共同参与m6A修饰过程[6]。然而,对WTAP的功能及机制研究却远不如METTL3和METTL14那样详尽清晰。据报道,WTAP敲除可导致胚胎致死,且参与了大量的细胞过程,如选择性剪接、X染色体失活和细胞周期调节等[7-10]。WTAP在肿瘤中的功能研究仍少见,目前认为它可能通过m6A修饰或其他信号通路促进或抑制肿瘤进展[11-13]。
代谢重编程是肿瘤的标志性特征之一,本课题组及其他课题组相关研究表明结直肠癌的发生发展伴随着代谢表型的改变[14-15]。然而,在结直肠癌细胞增殖分化过程中,肿瘤细胞的代谢表型如何改变及其分子机制仍是未解之谜。有研究证实,敲降WTAP可抑制葡萄糖消耗、乳酸生成和糖酵解[16],而该过程是否在结直肠癌细胞分化进程中发挥作用尚未可知。因此,本研究明确了WTAP在结直肠癌细胞分化过程中的表达情况及生物学功能,并利用转录组学及分子生物学手段探索了WTAP影响结直肠癌细胞分化的分子机制,旨在初步明确WTAP在结直肠癌细胞分化过程中的表达和功能,以期为寻找结直肠癌治疗新靶点提供理论依据。
1 材料与方法
1.1 材料
细胞:结肠癌细胞系Caco2和HCT116为本实验室保藏。
试剂:DMEM细胞培养液、血清(Gibco公司,美国);5A细胞培养液(Sigma公司,美国);胰酶消化液(BioFroxx公司,德国);青链霉素混合液、BCA蛋白定量试剂盒(米鼠生物公司,中国);鼠抗β-actin(BM0627,1∶1 000,武汉博士德公司);兔抗WTAP(56501,1∶1 000)、兔抗E-cadherin(3195,1∶1 000)、辣根过氧化物酶标记马抗鼠IgG(7076,1∶3 000)、羊抗兔IgG(7074,1∶3 000,Cell Signaling Technology公司,美国);RIPA裂解液(碧云天生物公司,中国);ECL化学发光显影剂(杭州弗德生物公司);嘌呤霉素(Selleck公司,美国);Illumina Truseq试剂盒(Illumina公司,美国);Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix反转录试剂盒、Hieff®qRCR SYBR Green Master Mix实时荧光定量试剂盒(上海翌盛生物公司)。
仪器:S1000TM Thermal Cycler、CFX96TM Real-time System、Western blotting电泳仪、Western blotting转膜仪(Bio-Rad公司,美国);Centrifuge 5804离心机(Eppendorf公司,德国);Prism 7500 Real-time PCR仪、Heracell 150i细胞培养箱(Thermo公司,美国)。
1.2 方法
1.2.1 接触抑制分化模型 选取对数生长期的结肠癌细胞,消化、离心并重悬,随后在细胞培养箱中孵育,当细胞在培养皿中长满时,记录为“0 d”,继续培养,分别于0、3、6、9 d收取细胞样品,通过检测分化指标E-cadherin的表达水平确定细胞的分化程度。
1.2.2 建立WTAP敲降和过表达的稳转细胞株 将Flag-WTAP和短发卡WTAP构建入pCDH慢病毒表达载体感染结直肠癌细胞系,感染细胞48 h后加入嘌呤霉素(Selleck公司,货号:S7417)进行筛选,得到表达空载体(对照组)、Flag-WTAP(WTAP过表达组)和WTAP稳定敲低(WTAP敲降组)的细胞株。利用qRT-PCR和Western blotting方法对WTAPmRNA和蛋白的表达水平进行验证。
1.2.3 qRT-PCR 提取总RNA后对其进行反转录获得cDNA,作为后续定量PCR的反应模板。利用Primer Express(ABI,Foster City,美国)程序设计引物,在Prism 7500 Real-time PCR仪上进行反应。引物用荧光染料SYBR Green Ⅰ标记,PCR反应获得的数据用ABI Prism 7500 SDS软件进行分析。
1.2.4 Western blotting 将收集的细胞或组织用预冷的PBS洗涤2次,然后加入含有蛋白酶抑制剂的RIPA裂解液充分裂解细胞(若为组织需匀浆)。用BCA法测定蛋白含量,取40 μg蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,恒压转膜1.5 h后用50 g/L脱脂奶粉在室温封闭1 h,将NC膜与一抗置于4 ℃冰箱过夜;第2日取出膜复温后用TBST洗膜3次,每次5 min,加入二抗室温孵育1 h,再用TBST洗膜3次。利用化学发光法显影检测目的蛋白。
1.2.5 转录组学测序及数据分析 以细胞接触抑制分化模型中0 d和6 d的HCT116细胞为实验模型,采用RNA测序技术分析细胞分化对RNA表达水平的影响:采用Illumina Truseq 试剂盒建库,Illumina Hiseq 2500平台测序。每个样本获得平均10 G以上的有效数据,包括mRNA表达谱、RNA可变剪接及非编码RNA表达谱等;通过统计分析,选取矫正后的P<0.05、差异倍数≥2的基因作为差异表达的基因;并对显著差异基因进行GO功能富集和KEGG通路分析。
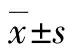
2 结果
2.1 结肠癌细胞诱导分化后WTAP表达水平下调
本研究首先构建了结直肠癌细胞Caco2接触抑制分化模型,利用qRT-PCR实验检测E-cadherin和WTAPmRNA水平,结果显示,E-cadherinmRNA表达水平在Caco2细胞接触抑制3 d时即显著上调(图1A),而与之相反,WTAPmRNA表达水平随着Caco2结直肠癌细胞分化呈显著下调趋势(图1B);利用Western blotting实验对E-cadherin和WTAP的蛋白水平进行检测,发现伴随着Caco2结直肠癌细胞分化,E-cadherin的蛋白水平显著上调,而WTAP则显著减少(图1C)。以上结果提示,WTAP在结肠癌细胞分化后表达下调。
2.2 敲降WTAP可诱导结肠癌细胞分化
为了探究WTAP对结直肠癌细胞分化的影响,本文成功构建了WTAP稳定过表达和敲降的HCT116结直肠癌细胞系(图2A),利用qRT-PCR实验对分化指标E-cadherinmRNA表达水平进行检测分析,发现WTAP过表达细胞中E-cadherinmRNA水平下调(P<0.01),而敲降WTAP后E-cadherinmRNA水平显著增加(图2B~D)。由此得出结论,WTAP可负调控结直肠癌细胞分化。

A~B:qRT-PCR检测WTAP过表达和敲降后WTAP mRNA的表达水平;C~D:qRT-PCR检测WTAP过表达和敲降后E-cadherin mRNA表达水平。aP<0.05,bP<0.01 vs 对照组。
2.3 结肠癌分化细胞的基因表达模式不同于对照组细胞
为了探索结直肠癌细胞分化的调控机制,利用HCT116细胞分化模型进行了转录组学测序分析。培养0 d和培养6 d分化的样本分别聚集在一起,说明两组样本转录组表型确有显著差异(图3A);通过统计分析,选取矫正后的P<0.05、差异倍数≥2的基因作为差异表达的基因,共筛选出2 432个与分化相关的显著差异基因,其中1 290个基因在分化后上调,而1 142个基因在分化后下调(图3B~C)。
2.4 结肠癌细胞分化过程中糖酵解途径显著异常
为了阐明分化过程中基因功能的变化,本文对筛选出的显著差异基因进行了GO富集分析(图4A)。接着,为了确定差异表达基因参与的最主要生化代谢途径和信号转导途径,进行了KEGG通路分析,发现细胞糖酵解/糖原生物合成途径是受细胞分化影响最显著的通路(图4B)。
2.5 WTAP促进糖酵解相关酶的表达
鉴于结直肠癌细胞分化进程中糖酵解途径显著异常,因此,本文推测WTAP对结直肠癌细胞分化的负调控作用可能是通过影响糖酵解途径实现的。为了初步证实这个猜想,通过构建的WTAP敲降及过表达的HCT116结肠癌稳转细胞系对糖酵解通路相关酶的表达水平进行检测分析发现,敲降WTAP可显著下调糖酵解通路中甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、葡萄糖转运蛋白1、葡萄糖转运蛋白4、烯醇化酶2、磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)和磷酸果糖激酶2 mRNA表达水平(P<0.05,P<0.01),而过表达WTAP则可使GAPDH、醛缩酶A、PGK1和己糖激酶2 mRNA表达上调(P<0.05,P<0.01,图5)。综上所述,WTAP可能通过促进结肠癌细胞糖酵解抑制其分化。

A:WTAP敲降对糖酵解相关酶mRNA表达水平的影响;B:WTAP过表达对糖酵解相关酶mRNA表达水平的影响。GAPDH:甘油醛-3-磷酸脱氢酶;GLUT1:葡萄糖转运蛋白1;GLUT4:葡萄糖转运蛋白4;ALDOA:醛缩酶A;ENO2:烯醇化酶2;LDHA:乳酸脱氢酶A;PGK1:磷酸甘油酸激酶1;HK2:己糖激酶2;PFK:磷酸果糖激酶2。aP<0.05,bP<0.01。
3 讨论
结直肠癌的发病率和肿瘤相关致死率均位于恶性肿瘤前列[17-18]。因此,寻找有效的治疗靶点仍是结直肠癌研究领域不可忽视的科学问题,对结直肠癌的预防和提高其治疗有重大意义。作为m6A修饰复合体的重要组分,WTAP在结直肠癌恶性进展中的作用尚不明确。本课题旨在明确WTAP在结肠癌细胞分化中的作用,以期为结直肠癌临床治疗提供新的药物靶点。
WTAP在结直肠癌中的作用尚不明确。有研究表明,WTAP在结直肠癌中表达上调,且常常提示预后不良。在机制方面,WTAP可通过RNA m6A修饰方式作用于其他分子,参与细胞增殖[16,19]、分化[13,20]和转移[21]等多种生物学进程。已有文献报道WTAP与结直肠癌细胞分化呈负相关[20]。本研究进一步证实了WTAP的表达水平随着结直肠癌细胞分化进程逐渐下降,并利用WTAP稳定敲降和过表达的细胞系证实了WTAP对结肠癌细胞分化的负调控作用。
代谢重编程为肿瘤细胞提供能量、大分子前体物质和氧化还原平衡微环境的支持,在结直肠癌的发生发展、转移播散和耐药复发等方面发挥了巨大作用[22]。20世纪20年代,“Warburg效应”的发现为肿瘤细胞的能量及物质来源提供了理论依据。本研究结果显示,结直肠癌分化细胞糖酵解途径显著异常,与其他人的研究结果一致,该研究认为分化程度较低的结肠癌干细胞有氧糖酵解显著上调。同时,本实验结果证实WTAP可促进糖酵解相关酶的表达,而之前已有研究证实,敲低WTAP抑制了葡萄糖消耗、乳酸生成和糖酵解[14],从而影响结直肠癌恶性进展。
综上所述,本研究通过综合转录组学和分子生物学分析手段证实了WTAP通过促进糖酵解途径负调控结肠癌细胞分化。研究初步明确了WTAP在结肠癌细胞分化中的表达模式和功能,然而,本研究存在一定局限性,WTAP调控糖酵解的具体分子机制尚不清楚。后续课题组将进一步完善WTAP调控结直肠癌细胞分化的理论基础,为靶向WTAP治疗结直肠癌提供更为充分的科学依据。

