吲哚美辛通过恢复自噬流减轻雨蛙素诱导的小鼠急性胰腺炎
楼立君,李人龙,李 雁,李 静,康晓宇,王向平,潘阳林
(国家消化系统疾病临床医学研究中心,消化系肿瘤整合防治全国重点实验室,空军军医大学西京消化病医院,陕西 西安710032)
急性胰腺炎(acute pancreatitis,AP)是由多种病因引起胰腺内胰蛋白酶原提前激活所导致的一种消化系统常见急腹症。AP的病因众多,在中国最常见的病因为胆石症,而欧美国家则为过量乙醇摄入,此外,经内镜逆行性胰胆管造影术(endoscopic retrograde cholangio-pancreatography,ERCP)、高脂血症、高钙血症等也是引起AP的常见病因[1-2]。AP病情复杂多变、预后不良,部分患者会出现不明原因的反复发作或进展为慢性胰腺炎,这些均给患者和医疗系统带来了沉重负担[3-4]。然而目前,AP的预防手段有限,缺乏早期针对性药物,临床治疗仍以对症治疗为主。
吲哚美辛是临床上常见的非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs),近年来,有多项高质量临床研究发现,吲哚美辛能够预防ERCP术后胰腺炎(post-ERCP pancreatitis,PEP),NSAIDs目前已成为预防PEP这一特殊类型AP的基石[5-7]。作为一类广泛使用的抗炎药物,吲哚美辛可能在除PEP外的各类AP的防治中有更广泛的适应证,然而其在AP中的保护作用与机制尚不清楚,在特定AP环境下对胰腺自噬过程的影响与调控仍有待研究。本研究拟通过构建常见的AP小鼠模型,探究吲哚美辛对AP的保护作用及其机制,为临床开发更特异、更有效的AP防治策略打下基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6小鼠(8周龄、雄性)购自空军军医大学实验动物中心,在SPF环境下饲养,环境温度(25±1)℃、相对湿度(60±5)%,按昼夜节律提供光照12 h,自由进食饮水,购买后所有小鼠适应性饲养1周。
1.1.2 主要试剂 雨蛙素(FI-6934,MCE,美国);吲哚美辛(I7378,Sigma,美国);苏木素染色液、EDTA抗原修复液(索莱宝,中国);即用型正常山羊血清(博士德公司,中国);DAB显色试剂盒(中杉金桥,中国);RNA提取试剂盒(Takara,日本);反转录试剂及扩增试剂(Abm,美国);脂肪酶检测试剂盒(MAK046,Sigma,美国);兔抗人髓过氧化物酶(myeloperoxidase,MPO)抗体(ab208670)、兔抗人LC3抗体(ab192890)、兔抗人P62抗体(ab109012)(Abcam,美国);鼠抗人β-actin抗体(SAB3500350,Sigma,美国)。
1.2 方法
1.2.1 模型构建及分组 随机挑取雄性C57BL/6小鼠28只,体质量20~22 g,小鼠适应性饲养1周,所有动物实验设计遵循3R原则。造模前所有小鼠均禁食12 h,根据实验目的将小鼠随机分为对照组、吲哚美辛组、雨蛙素组、雨蛙素+吲哚美辛组,每组7只。AP模型的建立方法及吲哚美辛给药方式见图1。对照组小鼠每隔1 h进行一次9 g/L生理盐水腹腔注射,共注射7次。雨蛙素胰腺炎造模小鼠每隔1 h进行一次50 μg/kg雨蛙素腹腔注射,共注射7次。雨蛙素+吲哚美辛组小鼠在第一次注射雨蛙素前6 h和0.5 h,按8 mg/kg剂量进行两次吲哚美辛腹腔注射,之后继续进行7次雨蛙素腹腔注射。吲哚美辛组小鼠按照8 mg/kg剂量进行两次单独吲哚美辛腹腔注射。所有小鼠均在第一次注射雨蛙素后12 h麻醉处死,解剖小鼠并于腹主动脉采血,取出胰腺组织,保存于-80 ℃冰箱。采集的血液在37 ℃条件下孵育30 min,4 ℃离心机中3 000 r/min离心15 min,分装上清并保存于-80 ℃冰箱以备后续使用。

图1 小鼠给药示意图
1.2.2 小鼠胰腺组织HE染色及组织病理学评分 使用40 g/L多聚甲醛固定小鼠胰腺组织,石蜡包埋后切片,切片厚度4 μm。经过烤片-脱蜡-苏木素染色-分化-伊红染色-脱水封片等步骤对切片进行HE染色。使用病理切片扫描仪(3DHISTECH)扫描切片并分析图像,每张切片随机选择5个视野,分别从水肿、炎症、坏死3个方面单独对每只小鼠的胰腺组织损伤情况进行双盲评分,3项评分总和即为该只小鼠组织病理学的总评分,计算每组小鼠各项评分及总分的平均值作为最终得分[8]。
1.2.3 小鼠血清淀粉酶与脂肪酶检测 取10 μL收集的血清样本用90 μL双蒸水稀释10倍,涡旋混匀,将样本放置于冰上送至西京医院检验科,利用全自动生化分析仪(日立,日本)检测样本血清淀粉酶与脂肪酶水平,得到的数值乘以10即为原始血清淀粉酶与脂肪酶水平。
1.2.4 小鼠胰腺组织MPO免疫组织染色 将包埋的胰腺组织切片,65 ℃烘烤2 h,依次进行脱蜡与脱水,使用EDTA抗原修复液进行抗原修复,之后进行过氧化氢封闭与山羊血清封闭,封闭后滴加一抗,将切片放于湿盒中4 ℃过夜。第2日洗涤切片并滴加二抗室温孵育1 h,在显微镜下进行DAB显色与苏木素染色,使用流水冲洗切片停止染色,然后进行脱水与封片,最后使用切片扫描仪(3DHISTECH)扫描切片并使用ImageJ软件对MPO表达阳性细胞进行计数。
1.2.5 小鼠胰腺组织RNA提取与qPCR测定炎症因子表达 小鼠胰腺组织RNA提取及反转录使用商品化试剂盒进行,其步骤简述如下:将组织放于RLT裂解液中充分裂解,使用试剂盒中离心柱去除DNA并吸附RNA,分别使用RWA与RWB溶液洗脱杂质,最后加入无核酸酶水收集RNA并使用NanoDrop微量分光光度计测定RNA的浓度与纯度。使用反转录试剂盒将提取的RNA反转录为cDNA,使用SYBR Green Master Mix进行qPCR,实验中所使用的引物序列如表1所示。
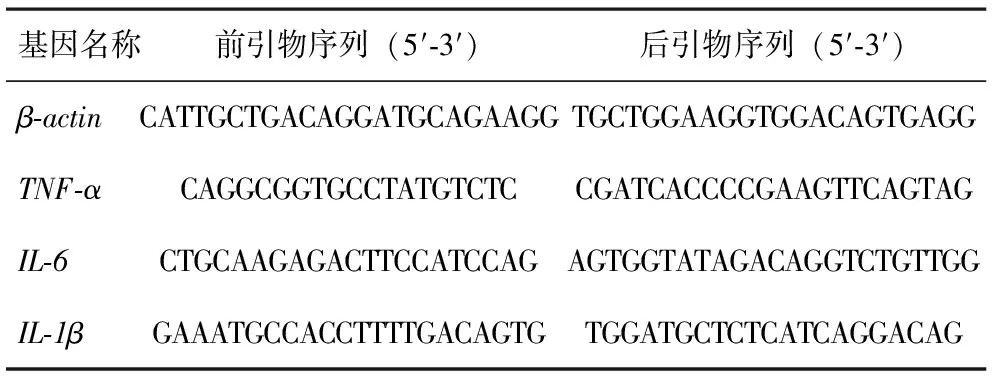
表1 引物序列
1.2.6 Western blotting检测自噬相关蛋白表达 取50 mg胰腺组织加入RIPA裂解液,研磨组织至乳糜状并超声匀浆,12 000 r/min离心15 min,留上清液作为上样蛋白。配制SDS-PAGE胶,根据实验计划按顺序在每孔加入40 μg的蛋白,设定上层压缩胶电压为80 V,下层分离胶电压条件为120 V,当溴酚蓝快到达分离胶下边界时停止电泳。电泳结束后使用转膜仪(Bio-Rad,美国)将蛋白转至硝酸纤维素膜上,设定转膜电压为100 V,根据目的分子大小设置转膜时间。转膜结束后使用50 g/L脱脂牛奶封闭条带1 h,TBST缓冲液洗净残留牛奶,使用对应一抗在4 ℃冰箱过夜孵育条带。第2日使用TBST缓冲液清洗条带3次,每次5 min,对应二抗室温孵育条带1 h,结束后使用TBST缓冲液清洗条带3次,每次5 min。使用凝胶成像设备(Bio-Rad,美国)进行显影、拍照,使用ImageJ软件分析条带灰度值。
1.2.7 电镜检测自噬小体 切取约1 mm×1 mm×1 mm新鲜胰腺组织,25 g/L戊二醛固定,4 ℃冰箱过夜;磷酸漂洗液漂洗样本并用10 mL/L锇酸固定样本2 h,乙醇梯度脱水,将样本置于丙酮溶液,室温置换3次,每次30 min;使用不同浓度丙酮与包埋剂浸渍样本,结束后37 ℃过夜包埋样本。将样本切为50~90 nm 的超薄切片,20 mL/L乙酸双氧铀和柠檬酸铅进行双染色,使用透射电镜观察并拍照。
2 结果
2.1 吲哚美辛减轻AP小鼠胰腺组织病理损伤
小鼠胰腺组织HE染色结果显示,对照组与吲哚美辛组胰腺组织致密,腺泡结构完整,组织无水肿或出血样改变;雨蛙素组胰腺组织水肿明显加重,间质内可见大量炎症细胞浸润,腺泡细胞呈空泡样变,部分腺泡细胞出现局部坏死;但雨蛙素+吲哚美辛组胰腺组织水肿程度较雨蛙素组减轻,炎症细胞浸润数量明显减少,腺泡细胞空泡样变与坏死程度减轻(图2A)。根据HE染色结果对小鼠胰腺组织损伤进行组织病理学评分,与对照组和吲哚美辛组相比,雨蛙素组的组织病理学评分明显增加(P<0.05),雨蛙素+吲哚美辛组的组织病理学评分较雨蛙素组则明显降低(P<0.05,图2B~E)。以上结果表明,吲哚美辛可以减轻AP时小鼠的胰腺组织损伤。

A:小鼠胰腺组织HE染色;B:胰腺组织水肿评分;C:胰腺组织炎症评分;D:胰腺组织坏死评分;E:胰腺组织病理学评分。aP<0.05 vs 对照组;cP<0.05 vs 胰腺炎组(n=7)。
2.2 吲哚美辛降低AP小鼠血清淀粉酶与脂肪酶水平
检测四组小鼠血清淀粉酶与脂肪酶的水平,结果发现,血清淀粉酶水平雨蛙素组较对照组和吲哚美辛组明显升高(P<0.05),而雨蛙素+吲哚美辛组则较雨蛙素组显著降低(P<0.05,图3A)。血清脂肪酶水平雨蛙素组较对照组和吲哚美辛组明显升高(P<0.05),而雨蛙素+吲哚美辛组则较雨蛙素组显著降低(P<0.05,图3B)。以上结果提示,吲哚美辛可以减轻胰腺组织的损伤程度,减少胰腺组织淀粉酶和脂肪酶的释放。

A:小鼠血清淀粉酶活性;B:小鼠血清脂肪酶活性。aP<0.05 vs 对照组;cP<0.05 vs 雨蛙素组(n=7)。
2.3 吲哚美辛减少AP小鼠胰腺组织MPO+细胞数量
MPO是一种存在于中性粒细胞嗜苯胺蓝颗粒中的溶酶体蛋白,胰腺、肺和其他组织中MPO的活性已被用作代表炎症发展过程中中性粒细胞水平及活性变化的标志物[9-10]。对小鼠胰腺组织切片进行MPO免疫组化染色,结果显示,与对照组比较,雨蛙素组组织间隙可见大量MPO表达阳性的细胞浸润,而雨蛙素+吲哚美辛组胰腺组织MPO阳性细胞浸润数量明显减少(P<0.05,图4)。以上结果提示,AP时大量中性粒细胞被招募至胰腺组织,吲哚美辛可以减少胰腺组织中中性粒细胞的活化与浸润。

A:吲哚美辛减少胰腺组织MPO+细胞浸润;B:MPO+细胞定量。aP<0.05 vs 对照组;cP<0.05 vs 雨蛙素组(n=7)。
2.4 吲哚美辛减轻AP小鼠胰腺组织炎症因子表达
进一步提取四组小鼠胰腺组织的RNA,通过qRT-PCR检测几个常见炎症因子在雨蛙素及吲哚美辛处理后mRNA表达水平的变化。结果显示,与对照组比较,雨蛙素组IL-6、IL-1β及TNF-α mRNA的表达水平均明显增加(P<0.05,图5);与雨蛙素组相比,雨蛙素+吲哚美辛组IL-6、IL-1β及TNF-α mRNA的表达水平均显著降低(P<0.05,图5)。
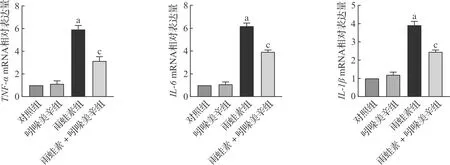
aP<0.05 vs 对照组;cP<0.05 vs 雨蛙素组(n=7)。
2.5 吲哚美辛对AP小鼠体内自噬通路的影响
电镜是检测自噬活动的金标准,为了探究吲哚美辛对AP小鼠自噬过程的影响,取小鼠胰腺组织进行透射电镜检测。结果显示,雨蛙素组小鼠胰腺组织自噬空泡较对照组增多,而雨蛙素+吲哚美辛组中包含未降解酶原颗粒的自噬溶酶体的数量减少(图6A),以上结果初步提示吲哚美辛可以减少AP过程中异常堆积的自噬空泡。进一步使用Western blotting检测自噬相关蛋白的变化,结果提示,与对照组及吲哚美辛组相比,雨蛙素组LC3-Ⅱ与P62蛋白的表达均显著增加(P<0.05),而雨蛙素+吲哚美辛组LC3-Ⅱ和P62蛋白的表达则较雨蛙素组均降低(P<0.05,图6B~C)。以上结果提示,雨蛙素诱导AP后自噬过程被激活,但是自噬流受损,吲哚美辛可以恢复受损的自噬流。

A:小鼠的代表性胰腺内自噬空泡电镜图(红色箭头指示包含未被降解的酶原颗粒的自噬溶酶体,黄色五角星代表细胞核);B:吲哚美辛降低胰腺组织内升高的LC3-Ⅱ、P62蛋白水平;C:LC3-Ⅱ、P62蛋白水平定量。aP<0.05 vs 对照组;cP<0.05 vs 雨蛙素组(n=7)。
3 讨论
吲哚美辛是临床常见的NSAIDs,具有广泛的抗炎镇痛作用,多项临床研究发现吲哚美辛可以降低PEP的发生率,术前预防性使用吲哚美辛已成为防治PEP的基石[6,11-12],然而其作用机制尚不明确。近些年来,随着AP动物模型的成熟,有几项基础研究探讨了吲哚美辛对AP动物模型发生发展过程的影响,LYU等[13]发现吲哚美辛对雨蛙素联合脂多糖诱导的大鼠重症AP起到了保护作用;GENG等[14]发现NSAIDs类药物吲哚美辛与帕瑞昔布注射可以减轻逆行胰胆管注射法诱导的大鼠AP损伤程度。除了吲哚美辛外,OZER CAKIR等[15-16]发现双氯芬酸钠和阿司匹林等临床常见的NSAIDs类药物也可以改善小鼠AP及相关肺损伤。然而,也有部分研究显示长期使用NSAIDs类药物可能对胰腺的再生产生负面影响,如BOMBARDO等[17]研究发现,给予AP小鼠布洛芬治疗虽然会降低胰腺炎症因子的mRNA水平并减少巨噬细胞的浸润,但这一过程伴随着胰腺腺泡细胞增殖和细胞分裂的受损。综上,先前的研究结果显示出吲哚美辛等NSAIDs类药物具有减轻AP的潜力,然而部分研究结果也提示这类药物在使用过程中可能会出现一定的副作用,吲哚美辛在AP中的具体保护机制也尚未阐明,因此尚需深入探究NSAIDs类药物在AP发生发展过程中的作用及其AP的具体保护机制。
目前在临床上常规推荐体质量为60 kg的患者在ERCP术前预防性使用100 mg吲哚美辛栓剂以预防PEP,根据人与动物之间药物剂量换算方法[18],我们将吲哚美辛用于小鼠的注射剂量设定为8 mg/kg,为了保证吲哚美辛在小鼠体内的血药浓度,在第一次雨蛙素注射前6 h和0.5 h给予小鼠两次吲哚美辛腹腔注射。我们的实验结果表明,雨蛙素造模组小鼠胰腺组织表现为明显炎症样改变,血清淀粉酶与脂肪酶水平明显升高,胰腺局部中性粒细胞浸润及炎症因子mRNA水平增加;雨蛙素+吲哚美辛组小鼠的胰腺组织病理学评分、血清淀粉酶与脂肪酶水平及炎症细胞浸润水平均下降,以上结果提示吲哚美辛可以减轻雨蛙素诱导的小鼠胰腺组织损伤。
吲哚美辛通过抑制环氧合酶(cyclooxygenase,COX)而发挥其抗炎镇痛的效果,这是NSAIDs类药物经典的作用机制[19],然而抑制COX1常会引起胃肠道、肾脏和心脏损害等诸多不良反应,这些均会导致胰腺损伤加重[20];部分研究也发现,特异性阻断COX2途径似乎对胰腺炎的炎症情况无明显保护作用[21-22],因此,经典的COX途径可能并未参与吲哚美辛在AP中的保护过程。
自噬是一种清除细胞内异常聚集的蛋白质、受损的细胞器和入侵的病原体的过程,它可以维持正常的细胞功能和细胞内稳态的动态平衡[23]。胰腺具有最高的蛋白质合成和运输速率,基础自噬可以负责清除合成有缺陷的蛋白质和细胞器,以维持腺泡细胞稳态[24-25]。胰腺腺泡细胞的自噬障碍是导致AP发生和进展的关键事件,具体表现为自噬小体的增多和溶酶体降解障碍,伴随着胰腺LC3-Ⅱ蛋白水平的增加、长寿命蛋白降解率降低及P62蛋白水平升高,提示胰腺炎过程中自噬流受损[26-28]。电镜是检测自噬活动的金标准,在本实验中,电镜结果显示,相较于对照组,胰腺炎自噬空泡及未被降解的酶原颗粒明显增多,而在雨蛙素+吲哚美辛组这种自噬溶酶体的异常堆积则减轻。Western blotting进一步检测自噬相关蛋白,结果显示,雨蛙素组LC3-Ⅱ与P62蛋白的表达明显升高,而雨蛙素+吲哚美辛组这两种蛋白的表达均下降。以上结果表明AP时自噬过程激活以及自噬降解的受损,而吲哚美辛处理可减少AP时自噬空泡的聚集以及自噬相关蛋白的表达,提示吲哚美辛可以激活自噬流,改善胰腺炎引起的自噬流受损。然而目前吲哚美辛调控自噬过程的具体方式还不清楚,其他非经典途径是否也参与吲哚美辛对于AP的保护作用仍需探索。
综上所述,本研究通过构建雨蛙素诱导的小鼠AP模型,验证了吲哚美辛可以减轻雨蛙素诱导的小鼠胰腺损伤,降低胰腺组织炎症细胞浸润程度与炎症因子mRNA表达,同时首次探究了吲哚美辛在特定的AP环境下对胰腺自噬过程的调控,我们的实验结果也提示吲哚美辛很可能通过恢复AP时受损的自噬流发挥其对小鼠胰腺损伤的保护作用,为开发更好的AP防治策略打下基础,但是阐明吲哚美辛防治AP的具体分子机制、自噬调控在AP发生发展过程中发挥的作用仍需进一步的探索。

