乌头汤联合甲氨蝶呤治疗大鼠类风湿关节炎的疗效及其与p38MAPK通路的相关性*
吴 丹,李洁芳,刘 君
(长沙市第四医院,湖南 长沙 410006)
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性自身免疫疾病,可能与自身免疫、遗传、感染、吸烟等因素有关,但确切病因还不明确,尚无有效的预防措施[1]。临床主要采用非甾体抗炎药、糖皮质激素和免疫抑制剂等药物对RA进行治疗,但胃肠道反应、肝功能损伤等副作用明显[2]。其中甲氨蝶呤是治疗RA的一线药物。乌头汤(Wutou decoction,WTD)可通过减少炎症因子的释放,调节血液免疫因子水平,来减轻关节疼痛。WTD治疗RA的临床疗效佳,但其作用机制尚未完全阐明[3]。p38丝裂原活化蛋白激酶(p38mitogen-activated protein kinase,p38MAPK)通路是决定滑膜炎症严重程度的重要因素[4]。故本研究拟探讨WTD联合甲氨蝶呤治疗大鼠RA的疗效及其与p38MAPK通路的相关性。
1 材料与方法
1.1 实验动物 75只6周龄雄性Wistar大鼠,购自湖南师范大学动物中心,动物生产许可证批号:SYXK(湘)2019-0008,体质量为(210.65±25.56)g。实验过程中所有大鼠均处在无病原体条件下,恒温(25±2)℃,相对湿度(45%~55%),12 h光/12 h暗循环饲养笼,大鼠可随意饮食。本研究通过长沙市第四医院伦理委员会审核批准(伦理审查批号:2018-0224)。
1.2 药物与试剂 WTD:制川乌,白芍,麻黄,炙甘草,黄芪。中药饮片均于本院中药房采购,由药学部邓菲药师鉴定为正品。制川乌、白芍、麻黄、炙甘草、黄芪的质量比例为6∶9∶9∶9∶9。上述药物混合,进行2次煎煮,煎煮时间均为1.5 h,过滤,合并2次滤液。旋蒸浓缩至所需体积,质量浓度为0.4 g/mL,药液放入4°C冰箱备用。甲氨蝶呤(湖南正清制药集团股份有限公司,批号:20210405)。将甲氨蝶呤片磨研成粉末,加入无菌蒸馏水混合均匀,配制成质量浓度为0.2 mg/mL的药物混悬液。
牛Ⅱ型胶原(北京博蕾德生物科技有限公司,批号:20021);完全弗氏佐剂(上海伟进生物科技有限公司,批号:08642852);一抗(兔抗)(批号:HZ-001)、二抗(羊抗兔)(批号:HZ-E5230)均购自上海沪震实业有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(ELIAS)试剂盒(批号:ER1393)、白介素-6(Interleukin-6,IL-6)ELISA试剂盒(批号:EY-18442)均购自北京博奥森生物技术有限公司;乙二胺四乙酸(EDTA)脱钙液(批号:AR1071)、二甲苯(批号:SA2024)均购自武汉博士德生物工程有限公司;TRIzol试剂(批号:488008);细胞质和核RNA纯化试剂盒(批号:2692521)、RevertAid H Minus First Strand cDNA合成试剂盒(批号:K1651)、SYBR Green PCR Master Mix(批号:14001013)均购自赛默飞世尔科技公司。
1.3 主要仪器 500 g天平(上海浦春设备有限公司,型号:JY502);精密天平(上海精密科学仪器公司,型号:JA31002);足趾容积测量仪(北京众实迪创科技发展有限责任公司,型号:ZS-TVM);超速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H-2050R);酶标仪(美国BIOTEK公司,型号:ELX-800);双垂直蛋白电泳仪(北京六一生物科技有限公司,型号:DYCZ-24DN);实时荧光定量聚合酶链式反应(Real-time PCR)仪(美国Biosystems公司,型号:Q5-7500型)。
1.4 分组与造模 75只大鼠按照随机数字表法分为空白组(15只)、RA模型组(15只)、甲氨蝶呤组(15只)、WTD组(15只)、WTD+甲氨蝶呤组(15只)。除空白组外的大鼠均进行胶原诱导造模。参照文献中方法[5]并进行改良,将牛Ⅱ型胶原(10 mg)与0.1 mol/L醋酸水(5 mL)混合均匀,配制成质量浓度为2 mg/mL的溶剂,置于4 ℃的环境下过夜,将5 mL上述溶剂与5 mL完全弗氏佐剂(CFA)混合均匀,置于4 ℃环境中直至完全乳化,配制成质量浓度为1 mg/mL的乳化液,给大鼠注射乳化液进行初次免疫,分别从尾根部选取1个点、后足掌选取1个点、背部选取3个点进行皮下注射,0.2 mL/只。初次免疫后第7天再次进行皮下注射乳化液。空白组大鼠在相同的时间皮下注射等剂量的生理盐水。造模成功标准:四肢足爪显现严重肿胀,其踝关节直径增长幅度大于2 mm,后爪体积增大≥0.8 mL。各组大鼠均造模成功。
1.5 实验给药 参照《药理实验方法学》[6]中的等效剂量系数折算法进行药物灌胃。甲氨蝶呤组大鼠灌胃甲氨蝶呤,1mg/(kg·d),1次/d,持续28 d;WTD组大鼠灌胃WTD,9.8 g/(kg·d),1次/d,持续28 d;WTD+甲氨蝶呤组分别予WTD[9.8 g/(kg·d)]和甲氨蝶呤[1 mg/(kg·d)]灌胃,1次/d,持续28 d;空白组及RA模型组大鼠灌胃等量生理盐水,1次/d,持续28 d。
1.6 观察指标
1.6.1 大体观察和组织学观察 (1)大体观察:取大鼠右后踝关节,用显微镜观察关节结构情况,进行Pelletier大体评分[7]。关节面完整,色泽正常为0分;关节面粗糙并有小的裂隙为1分;关节面糜烂并有软骨缺损为2分;关节面溃疡形成并有缺损达软骨深层为3分;软骨剥脱及软骨下骨质暴露为4分。(2)关节组织病理学观察:使用10%水合氯醛溶液腹腔注射(0.3 mL/100g)麻醉大鼠,使用皮剪剥离大鼠膝关节皮毛,并逐层暴露其膝关节,隔断周围韧带,暴露其膝关节腔,在尽量保证其完整的情况下用手术刀片分离膝关节滑膜后,放入液氮中保存备用,并切下大鼠踝关节,将取出的组织均放入4%多聚甲醛中室温保存。对组织进行HE染色切片,观察其病理改变情况,并通过光镜软骨检测评价标准(Mankin)[8]对大鼠的踝关节进行组织学评分。①软骨结构:正常计0分,表面不规则计1分,血管翳形成和表面不规则计2分,裂隙进入过渡层计3分,裂隙进入辐射层计4分,裂隙进入钙化层计5分,结构完全破坏计6分;②软骨细胞:正常计0分,弥漫性细胞增加计1分,局部细胞增加计2分,细胞数目明显减少计3分;③软骨基质染色:正常计0分,轻度减少计1分,中度减少计2分,重度减少计3分,无着色计4分;③潮线完整性:完整计0分,被血管破坏计1分。
1.6.2 大鼠软骨细胞Ⅱ型胶原mRNA及p38MAPK mRNA表达水平 采用聚合酶链反应(PCR)检测Ⅱ型胶原mRNA及P38MAPK mRNA表达。使用TRIzol试剂从大鼠软骨细胞中分离总RNA。使用细胞质和核RNA纯化试剂盒提取RNA。然后通过苯酚-氯仿提取纯化RNA,并使用RevertAid H Minus First Strand cDNA合成试剂盒合成第一链cDNA。使用SYBR Green PCR Master Mix在PCR仪中进行定量实时PCR。β-actin为参照表达量。引物序列见表1。

表1 引物序列
1.6.3 滑膜组织p38MAPK蛋白表达水平 采用Western blotting法检测滑膜组织p38MAPK蛋白相对表达量。取出“1.6.1”中保存的滑膜组织,在各组滑膜组织中加入组织裂解液(4 ℃预冷);Vortex混匀,冰上裂解30 min;4 ℃,12 000 r/min(离心半径为10 cm)离心30 min后,取上清液,采用Bradford方法测蛋白浓度,-80 ℃保存备用。SDS-PAGE电泳:20 μg总蛋白进行12%SDS-PAGE电泳分离,100 V电泳2 h。Bio-Rad:100 V,使蛋白质转移至硝酸纤维素滤膜。印迹膜用5%脱脂牛奶(封闭液)室温封闭2 h。印迹膜与一抗(1∶2 000)4 ℃孵育过夜,TBST缓冲液洗膜3次,10 min/次。将膜与HRP标记的二抗(1∶2 000)室温孵育1h,TBST缓冲液洗膜3次,10min/次。ECL试剂发光,显影及定影。以β-actin(1∶800)为内参。实验重复3次。用Quantity one软件分析p38MAPK在大鼠滑膜组织中的表达,计算相对表达量。
1.6.4 血清TNF-α、IL-6的水平 各组大鼠给药28 d后,取尾静脉血2 mL,3 500 r/min(离心半径为10 cm)离心15 min,吸取上层血清标本。采用ELIAS试剂盒检测血清TNF-α、IL-6的水平。
1.7 统计学方法 采用SPSS 26.0软件进行数据分析。计量资料符合正态分布且方差齐,多组间比较采用单因素方差分析,两两比较采用LSD-t检验或SNK-q检验,相关分析采用Pearson线性相关分析法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠踝关节Pelletier评分和Mankin评分比较 空白组大鼠踝关节未出现肿胀;RA模型组大鼠踝关节明显肿胀,并伴有跛行;甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠踝关节肿胀情况较模型组轻,未见跛行。RA模型组、甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠踝关节Pelletier和Mankin评分均高于空白组(P<0.05);甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠踝关节Pelletier和Mankin评分均低于RA模型组(P<0.05);WTD+甲氨蝶呤组大鼠踝关节Pelletier和Mankin评分低于WTD组、甲氨蝶呤组(P<0.05)。(见图1)

图1 各组大鼠踝关节Pelletier评分和Mankin评分比较(±s,n=15)
2.2 各组大鼠软骨细胞Ⅱ型胶原mRNA相对表达量比较 RA模型组大鼠软骨细胞Ⅱ型胶原mRNA相对表达量低于空白组(P<0.05);甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠软骨细胞Ⅱ型胶原mRNA相对表达量高于RA模型组(P<0.05);WTD+甲氨蝶呤组大鼠软骨细胞Ⅱ型胶原mRNA相对表达量高于WTD组、甲氨蝶呤组(P<0.05)。(见图2)
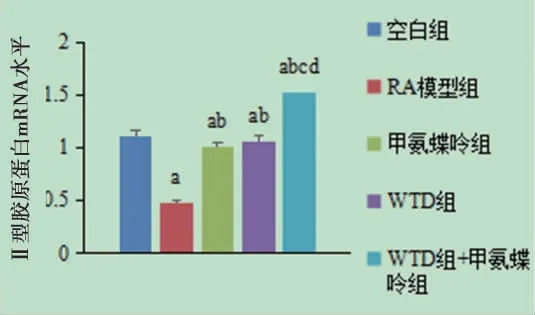
图2 各组大鼠软骨细胞Ⅱ型胶原mRNA相对表达量比较(±s,n=15)
2.3 各组大鼠软骨细胞p38MAPK mRNA相对表达量比较RA模型组大鼠软骨细胞p38MAPK mRNA相对表达量高于空白组(P<0.05);甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠软骨细胞p38MAPK mRNA相对表达量均低于RA模型组(P<0.05);WTD+甲氨蝶呤大鼠软骨细胞p38MAPK mRNA相对表达量低于WTD组、甲氨蝶呤组(P<0.05)。(见图3)

图3 各组大鼠软骨细胞p38MAPK mRNA相对表达量比较(±s,n=15)
2.4 各组大鼠滑膜组织p38MAPK蛋白相对表达量比较 RA模型组大鼠滑膜组织p38MAPK蛋白相对表达量高于空白组(P<0.05);甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠滑膜组织p38MAPK蛋白相对表达量均低于RA模型组(P<0.05);WTD+甲氨蝶呤组大鼠滑膜组织p38MAPK蛋白相对表达量低于WTD组、甲氨蝶呤组(P<0.05)。(见图4~5)

图4 各组大鼠滑膜组织p38MAPK蛋白相对表达量比较(±s,n=15)

图5 大鼠滑膜组织p38MAPK蛋白表达Western blotting图
2.5 各组大鼠血清TNF-α、IL-6水平比较 RA模型组大鼠血清TNF-α、IL-6水平高于空白组(P<0.05);甲氨蝶呤组、WTD组、WTD+甲氨蝶呤组大鼠血清TNF-α、IL-6水平均低于RA模型组(P<0.05);WTD+甲氨蝶呤组大鼠血清TNF-α、IL-6水平低于WTD组、甲氨蝶呤组(P<0.05)。(见图6)

图6 各组大鼠血清TNF-α、IL-6水平比较 (±s,n=15)
2.6 血清TNF-α、IL-6水平与软骨细胞p38MAPK mRNA相对表达量相关性分析 各组血清TNF-α、IL-6与软骨细胞p38MAPK mRNA相对表达量呈正相关(P<0.05)。(见表2、图7~8)。
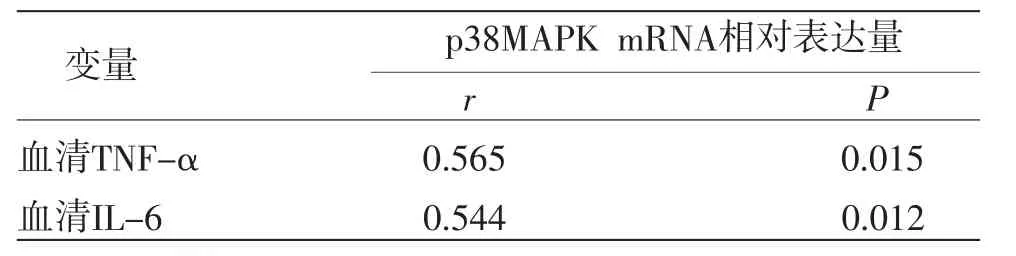
表2 血清TNF-α、IL-6水平与软骨细胞p38MAPK mRNA相对表达量的相关分析
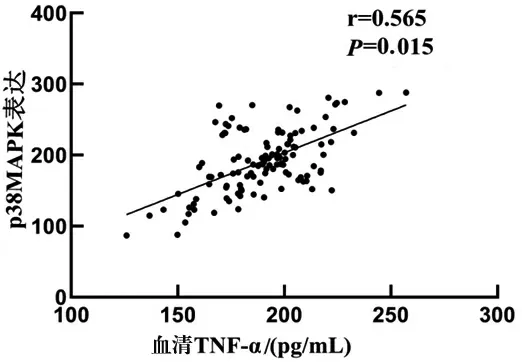
图7 血清TNF-α水平与p38MAPK mRNA相对表达量相关分析散点图与直线拟合

图8 血清IL-6水平与P38MAPK mRNA相对表达量相关分析散点图与直线拟合
3 讨 论
RA是一种以关节滑膜炎症为主要病理基础的自身免疫疾病,其关节病理表现为滑膜细胞大量增生。近年数据显示其致残率较高,产生心血管疾病等合并症的概率较高[9]。甲氨蝶呤治疗RA可取得较好的疗效,但仍存在由于药物不耐受而导致疗效不佳的情况,因此探索更好的治疗药物对RA患者的预后具有积极意义[10]。近年来,中医学在RA的治疗上有颇多进展,可通过祛邪通络、补益肝肾等治法调节机体阴阳平衡,达到控制关节症状的目的[11-12]。WTD出自《金匮要略》,主治寒湿历节,可改善RA患者关节疼痛、肿胀等症状[13]。目前WTD治疗RA的作用机制尚不明确。p38MAPK信号通路是参与RA炎症发展的重要途径,p38MAPK信号通路在RA慢性炎症的诱导及维持中起重要作用,故本研究旨在探讨WTD联合甲氨蝶呤治疗大鼠RA的疗效及其与p38MAPK通路的相关性。
中医学将RA归属为“尪痹”“痹病”等范畴,治疗以“寒者热之”“治寒以热”为主要原则[14]。WTD的温经散寒力强,并能祛风除湿。《金匮要略》指出:“病历节,不可屈伸,疼痛,乌头汤主之。”其原方由川乌、麻黄、黄芪、白芍和甘草组成,具有温经散寒、祛风除湿之效[15]。方中乌头为君药,能升能降,通经络,利关节,有温经散寒、除湿止痛之功;麻黄为臣药,有宣散透表、祛寒湿之效。二者配伍,同气相求,药力专宏,外能宣表通阳达邪,内可透发凝结之寒邪,外攘内安,痹痛自无。白芍宣痹行血,黄芪益气固卫。两者合用既助麻黄、乌头温经止痛,亦制麻黄过散之性,为佐药。炙甘草为使药,缓急止痛。诸药相伍,使寒湿去而阳气宣通,关节疼痛解除而屈伸自如。乌头具有镇痛作用,可以减轻疼痛[16];炙甘草中的甘草酸和黄芪中的黄芪苷具有抗炎作用,可以减轻炎症反应,并且炙甘草中的甘草酸还具有免疫调节作用,可以调节免疫系统功能,促进机体免疫力恢复[17];白芍中的芍药苷可以抑制血管内皮细胞增殖和炎症反应,从而减轻关节肿胀和疼痛[18];黄芪中的黄芪苷具有抗氧化作用,可以减轻氧化应激对关节的损伤[19];麻黄中的麻黄碱可以促进关节的血液循环,加速关节的康复[20]。
研究[21]发现,乌头汤与西药联用可有效改善关节炎活动期的临床症状和相关生化指标,疗效优于单用西药,且副作用较小,安全性较高。Ⅱ型胶原在维持软骨生物力学性能方面具有重要作用。软骨细胞Ⅱ型胶原减少,会导致软骨结构破坏,影响软骨细胞生长微环境,进而使得软骨细胞凋亡,因此Ⅱ型胶原的合成在RA的发生发展中具有重要作用[22-23]。本研究结果显示,WTD+甲氨蝶呤组大鼠软骨细胞Ⅱ型胶原mRNA表达水平高于WTD组、甲氨蝶呤组,体现了WTD与甲氨蝶呤联用可在维持关节结构中发挥作用[24-25]。
p38MAPK信号通路在RA滑膜中可被强烈激活。研究[26-27]表明,阻断或减少p38MAPK的表达会对软骨起到保护作用。本研究结果显示,WTD+甲氨蝶呤组p38MAPK mRNA、p38MAPK蛋白相对表达量均低于WTD组、甲氨蝶呤组,提示WTD+甲氨蝶呤可抑制p38MAPK信号通路,阻断和减少p38MAPKA的表达,保护大鼠软骨。WTD+甲氨蝶呤组大鼠血清TNF-α、IL-6水平低于WTD组、甲氨蝶呤组,说明WTD联合甲氨蝶呤可有效减轻炎症。RA的发病与细胞因子介导的炎症反应具有重要联系。如TNF-α、IL-6对软骨细胞和滑膜细胞中的胶原酶和前列腺素E2活性具有刺激作用,还可进一步促进细胞产生更多炎症因子,从而加重炎症反应,促使滑膜增生[28-29]。炎症小鼠全身TNF过度表达会导致关节组织中p38MAPK活化[30]。Pearson相关分析显示,大鼠血清TNF-α、IL-6与p38MAPK mRNA相对表达量呈正相关,提示WTD和甲氨蝶呤可能是通过抑制p38MAPK mRNA的表达,抑制RA的炎症发展。但本研究未考察WTD量效关系,以及其单独对RA进行用药是否与抑制p38MAPK信号通路有关,应进行深入研究分析。
综上所述,WTD联合甲氨蝶呤治疗大鼠RA的效果佳,其作用机制可能与抑制p38MAPK信号通路有关。

