鲑降钙素对虹鳟鳞组织miRNA 表达的影响
周启苓,马 骞,2*,王刘永,毛非凡,杨二军,陈 刚,2
(1.广东海洋大学水产学院,广东 湛江 524025;2.广东海洋大学,南方海洋科学与工程广东省实验室 (湛江),广东 湛江 524025)
硬骨鱼体内约99%的钙以碳酸钙和羟基磷灰石的形式储存在各种骨组织中[1]。这些骨组织通过形成和再吸收的动态循环过程不断被重塑,以维持鱼体的骨稳态,骨骼的这种新陈代谢过程即为鱼类的骨代谢。骨代谢的表现形式主要为钙的生物矿化(骨形成)及再活化(骨吸收),分别由成骨细胞[2]和破骨细胞[3]来完成。因此,钙代谢可作为骨代谢的重要表征之一。鱼类的骨骼系统由内骨骼(头骨、脊柱和肋骨等)及外骨骼(鳍和鳞)共同组成。鳞是鱼类外骨骼的重要组成部分,其在细胞组成方面与其他高等脊椎动物骨骼相似[2-3]。据报道,硬骨鱼类中鳞组织的钙含量可高达机体总钙的20%[1,3]。与其他内骨骼相比,鳞组织中的钙化盐在机体对钙的需求增加时最优先被活化利用[1,3-4]。此外,鳞组织还具有数量多、易于采集等特点,因此可作为鱼类骨代谢研究的优良载体。
降钙素(calcitonin,CT)是由甲状腺滤泡旁细胞(C 细胞)分泌的一种小分子多肽激素,可特异性作用于破骨细胞上的降钙素受体,抑制破骨细胞的活性,从而达到抑制骨盐溶解、阻碍钙由骨组织中释出并最终降低血钙的作用,在维持钙稳态方面具有重要作用[5-6]。此外,CT 能够刺激成骨细胞增殖和分化,增强成骨细胞黏附能力;还可通过促进OPG表达,抑制成骨细胞的凋亡,使成骨细胞数量增加[7-8]。已有研究表明,CT 对骨形成过程的调节作用主要通过Wnt/β-catenin 和RANKL/RANK/OPG 信号通路完成[9]。
鲑降钙素(salmon calcitonin,sCT)主要是从鲑科(Salmonidae)鱼类鳃中分离纯化而来,具有活性高、半衰期长等优点[10]。Gou 等[11]研究发现,皮下注射sCT 可减轻大鼠(Rattus norvegicus)软骨表面病变并显著增加其软骨厚度。在饥饿处理的金鱼(Carassius auratus)中,腹腔注射sCT 可降低其血浆中的Ca 含量,并促进鳞、肋骨和咽骨等组织的钙沉积[12]。腹腔注射sCT 也能够显著降低乌鳢(Channa punctatus)血钙水平,同时显著提高骨骼中的钙含量[13]。由此可见,sCT 作为脊椎动物、尤其是硬骨鱼类钙代谢过程的有效钙调因子,对于骨代谢水平具有较强的调节作用。
miRNA 是一类长约18~25 nt 的具有调控功能的非编码单链RNA[14]。脊椎动物中,miRNA 可通过与mRNA 的3′端非翻译区(UTR)中的互补序列结合,在转录后调节基因表达。已有研究表明,部分miRNA 可通过调节成骨细胞、破骨细胞和软骨细胞等骨细胞的增殖和分化,参与调控高等脊椎动物的骨代谢过程[15]。例如,在人(Homo sapiens)和大鼠的骨髓间充质干细胞(BMSCs)中,miR-31 可通过抑制其靶基因OSTERIX[16]、SATB2和RUNX2[17]的表达来抑制成骨细胞分化。在人和小鼠(Mus musculus)的BMSCs 中,miR-204 和miR-211 可通过抑制RUNX2 基因的表达来参与骨代谢调控[18]。Wang 等[19]研究发现,在人胚胎成骨细胞系(hFOB)中,miR-27 通过激活Wnt 信号通路,从而促进成骨分化,也可通过促进碱性磷酸酶(ALP)和骨钙素mRNA 的表达来促进成骨。He 等[20]研究发现,在miR-20b 介导的人间充质干细胞(hMSCs)成骨过程中,miR-20b 可通过负调控PPARγ、BAMBI和CRIM1,提高RUNX2 表达量,分阶段激活BMP/Runx2 信号通路,促进成骨细胞分化;miR-140 可通过调控斑马鱼(Danio rerio)软骨组织中骨转化因子sox9 来抑制成骨[21]。目前,关于miRNA 在鱼类骨代谢调控过程中的作用机制鲜有报道。
虹鳟(Oncorhynchus mykiss)属鲑形目(Salmoniformes)鲑科太平洋鲑属(Oncorhynchus),是我国养殖产量最高的鲑鳟鱼类[22],是sCT 的天然来源生物之一。本研究通过对虹鳟幼鱼进行sCT腹腔注射,并于注射后24 h 采集鳞片用于转录组测序。通过分析注射组及对照组鳞片组织中miRNA 的表达水平,筛选差异表达miRNA (DEMs),并对其进行靶基因预测。随后,对预测的靶基因进行GO 功能注释和KEGG 通路富集分析,进一步分析miRNA 在骨代谢过程中的作用机制。最后,采用实时荧光定量PCR (qRT-PCR)技术对部分DEMs 的表达量进行检测,验证测序结果的可靠性。本研究筛选到的可能参与虹鳟骨代谢调控过程的miRNA,可为阐明鱼类骨代谢的调控机制提供研究素材。
1 材料与方法
1.1 实验材料
实验用鱼来自山东省潍坊市临朐县淡水虹鳟养殖基地。实验开始前置于有效体积为1 000 L(直径1.6 m,高0.6 m)的PE 桶中,水深约为桶高度的1/2,暂养7 d (盐度28,水温14~16 °C),光周期为12 h∶12 h,每天早上8:00 和下午4:00 投喂配合饲料(总投喂量约为鱼体重的3%)。随后挑选健康且有活力的个体进行实验。
1.2 鲑降钙素注射处理及样品的采集
使用MS-222 麻醉虹鳟幼鱼后,注射组(IG)虹鳟腹腔注射sCT (sCT 配制浓度为0.2 μg/mL,注射剂量为2 μg/kg 鱼体重),对照组(CG)腹腔注射等体积生理盐水[13,23]。注射24 h 后分别刮取两组虹鳟幼鱼[体长(16.33±1.30) cm,体重(52.21±7.24) g]鱼体左侧鳞片(背鳍基部下方至尾柄处),并立即置于液氮速冻,后转移至-80 °C 保存,用于转录组测序和qRT-PCR 检测。实验过程中操作人员严格遵守相关法律法规及伦理规范,并按照广东海洋大学动物实验伦理委员会制定的规章制度执行。
1.3 总RNA 提取及miRNA 测序
使用TRIzol (Invitrogen,美国)提取IG 和CG 组的鳞组织总RNA。采用1.5%琼脂糖凝胶电泳检测其完整性,使用Nanodrop 2 000 核酸蛋白测定仪检测样品的浓度及纯度。对检测合格的样品,利用15%聚丙烯酰胺凝胶电泳(PAGE)分离纯化18~26 nt 的小分子RNA。使用TruSeq Small RNA Sample Prep 试剂盒(Illumina,美国)进行miRNA 文库构建。通过Illumina Hiseq 2 500 测序平台进行高通量测序,测序读长为single-end (SE)50 nt。miRNA 测序由杭州联川生物技术股份有限公司完成。
1.4 数据处理及生物信息学分析
使用miRNA 分析软件ACGT101-miR (LC Sciences,美国)过滤数据,得到碱基长度为18~26 nt 的序列。将剩余序列比对到mRNA、RFam和Repbase 数据库,筛选并剔除mRNA、rRNA、tRNA、snRNA、snoRNA和重复序列等相关序列后获得Valid read。再将Valid read 与miRBase 数据库比对,序列完全匹配的为已知miRNA。根据miRNA 标志性发夹结构,通过Pre-miRNA (mirs/MIRs)数据库信息比对,运用miREvo[24]和miRDeep2[25]软件预测新的3p 和5p miRNA。
计算各样品中miRNA 的表达量,使用TPM进行归一化处理。采用t检验方法对IG 和CG 组中miRNA 进行差异表达分析,按照表达量倍数差异(fold change)>2.0 或<0.5 和表达差异显著性P<0.05 筛选出DEMs。使用TargetScan (筛选阈值为>80)和miRanda (筛选阈值为<–20)数据库对显著性差异的miRNA 分别进行靶基因预测,取两数据库的交集作为差异miRNA 的最终靶基因。再利用GO 和KEGG 数据库分别对DEMs 靶基因的集合进行功能注释和通路富集分析。
1.5 实时荧光定量PCR 检测
随机选取8 个DEMs 进行qRT-PCR 检测。以U6 为内参,通用下游引物qPCR-MICRO-R 由SYBR Green QPCR Mix (DF Biotech,中国)试剂盒提供,上游引物由北京擎科生物科技有限公司合成(表1)。所有qRT-PCR 反应均为3 个生物重复,每个重复包括4 个技术重复。根据试剂盒说明书进行qRT-PCR 检 测。10 μL 反应体系:cDNA 模板1 μL,上、下游引物各0.5 μL,2×SYBR®Green Supermix 5 μL,ddH2O 3 μL。利用analytikjenaqTOWER 2.2 型qRT-PCR 仪(Analytik Jena AG,德国)进行扩增反应,反应条件为95 °C 预变性3 min;95 °C 变性10 s,60 °C 退火30 s,72 °C 延伸30 s,循环39 次;阈循环(Ct)值采用软件默认设置,利用2-△△Ct计算各样品的miRNA 相对表达量[26]。以平均值±标准差(=3)表示差异miRNA的相对表达值。利用SPSS 19.0 软件中的单因素方差(One-Way ANOVA)法,分析miRNA 表达量在IG 和CG 组鳞片中的差异水平,并进行Duncan氏多重比较,P<0.05 为差异显著,P<0.01 为差异极显著。

表1 用于qRT-PCR 检测的引物序列Tab.1 Primer sequences used for qRT-PCR
2 结果
2.1 虹鳟鳞片转录组测序结果
对IG 和CG 组的虹鳟鳞片进行转录组测序及数据处理,分别获得27 877 410 和33 156 331条Raw read,经多次过滤后,分别获得14 051 631(唯一序列739 250 条)和15 816 147 (唯一序列783 756 条)条Valid read (表2)。两组样品的Valid read 特征相似,其中22 nt 的miRNA 最丰富,分别占IG 和CG 组鳞片miRNA 总数的24.75%和25.73%,其次是23 nt 的miRNA,分别占两组样品miRNA 总数的22.21%和24.01% (图1)。

图1 虹鳟鳞片中表达的miRNA 的片段长度分布Fig.1 Fragment length distribution of miRNA expressed in scales of O.mykiss

表2 虹鳟鳞片中表达miRNA 的原始数据及已过滤序列的读取分布Tab.2 Original data of miRNA expression in O.mykiss scales and the sequence reading distribution of filtered sequences
2.2 虹鳟鳞组织miRNA 鉴定
将Valid read 与miRBase 数据库比对,共鉴定到629 种已知成熟miRNA,分属于103 个不同的miRNA 家族,其中IG 组包括568 种miRNA,CG 组包括592 种(图2)。

图2 虹鳟鳞片中表达的miRNA 的鉴定橙色区域为共有miRNA,粉色区域为注射组特异表达miRNA,绿色区域为对照组特异表达miRNA。Fig.2 Identification of miRNA expressed in O.mykiss scalesThe orange region is the common miRNA,the pink region is the miRNA specific to injection group (IG),and the green region is the miRNA specific to control group (CG).
2.3 差异表达miRNA 筛选及其靶基因预测
根据筛选标准(|log2(fold change)|>1,且P<0.05)对差异miRNA 进行评估,共获得24 个DEMs。其中已知miRNA 21 个,新预测的miRNA 3 个。这些DEMs 中有9 个表达上调,15 个表达下调(图3)。利用TargetScan 和miRanda 数据库分别对上述24 个miRNA 进行靶基因预测,共获得5 376个靶基因,其中每一DEMs 的靶基因预测结果见表3。
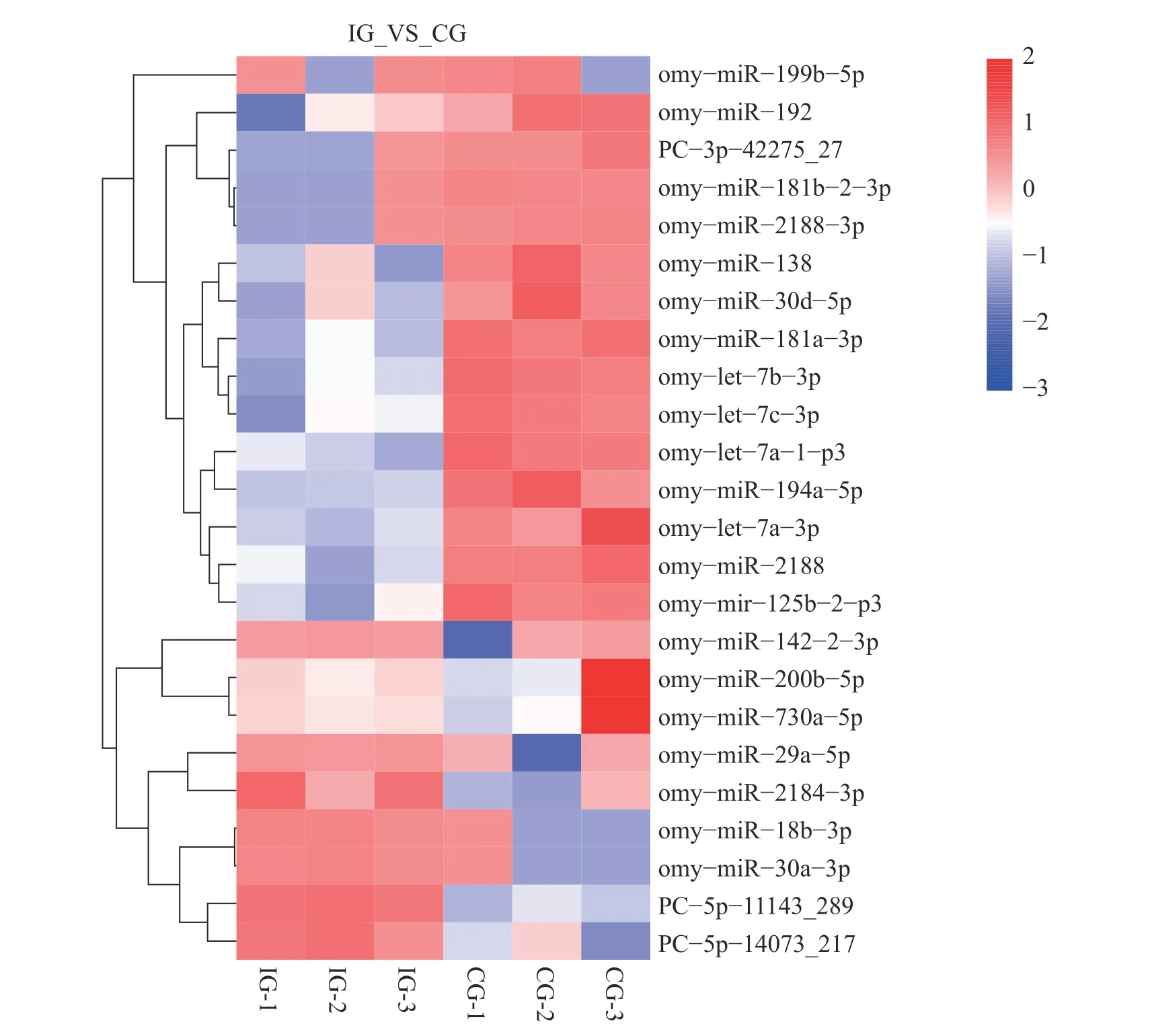
图3 差异表达miRNA 热图Fig.3 Heat map of differentially expressed miRNA
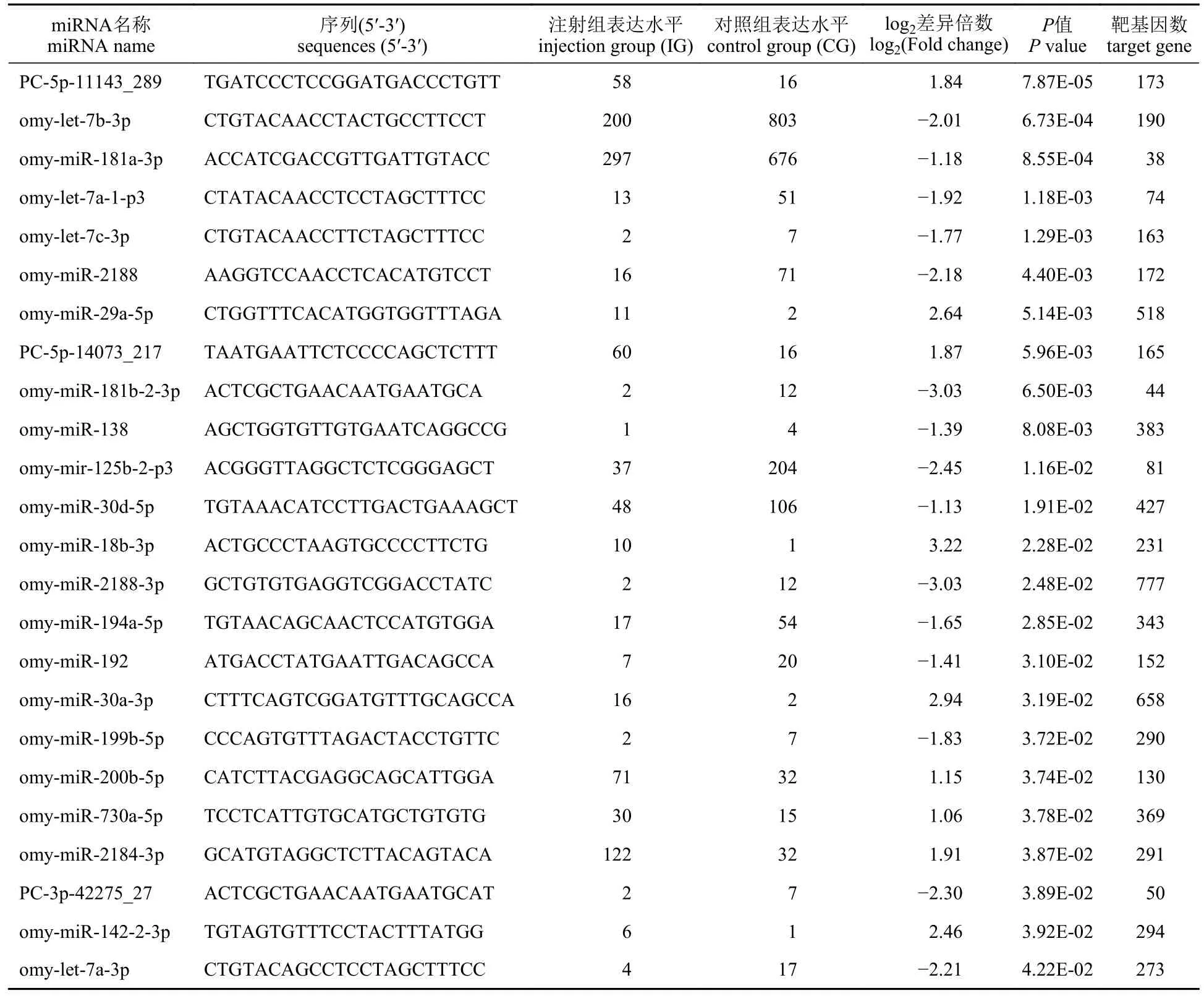
表3 差异表达miRNA 与预测靶基因数Tab.3 Differentially expressed miRNA and the number of target genes
2.4 差异表达miRNA 靶基因GO 注释及富集分析
对DEMs 的靶基因进行GO 功能注释和富集分析。靶基因注释结果包括细胞组分(cellular component)、生物过程(biological process)和分子功能(molecular function)三大功能类别(图4)。在生物过程类别中,注释到靶基因数目最多的功能依次为:转录调控-DNA 模板、信号转导、多细胞生物发育和细胞黏附等。在细胞组分分类中,以膜、膜的组成部分、核和细胞质等功能注释靶基因较多。分子功能类别中以金属离子结合、蛋白质结合、DNA 结合和钙离子结合等功能注释靶基因最多。最显著富集的靶基因GO 功能依次为NF-kappaB 输入细胞核的负调节、β-连环蛋白结合、宿主对病毒基因组复制的负调控和TGF-β 结合等功能(图5)。

图4 差异表达miRNA 靶基因的GO 富集1.转录调控,DNA-模板;2.信号转导;3.转录,DNA-模板化;4.多细胞生物发育;5.细胞黏附;6.RNA 聚合酶Ⅱ启动子的转录调控;7.G-蛋白偶联受体信号通路;8.蛋白质水解;9.Wnt 信号通路;10.运输;11.神经系统发育;12.磷酸化;13.确定左右对称性;14.小GTPase 介导的信号转导;15.蛋白质磷酸化;16.神经嵴细胞迁移;17.RNA 聚合酶Ⅱ启动子转录的正调控;18.经典Wnt 信号通路;19.氨基酸跨膜转运;20.外胚层参与原肠形成及口腔第二次形成;21.氧化还原过程;22.脂质代谢过程;23.背/腹模式形成;24.细胞分化;25.基因表达的正调控;26.膜;27.膜的组成部分;28.核;29.细胞质;30.质膜;31.质膜的组成部分;32.内质网;33.内质网膜;34.细胞外泌体;35.细胞外间隙;36.胞外区;37.胞质溶胶;38.高尔基体;39.蛋白质细胞外基质;40.线粒体;41.金属离子结合;42.蛋白质结合;43.DNA 结合;44.钙离子结合;45.序列特异性DNA 结合;46.转移酶活性;47.核酸结合;48.核苷酸结合;49.ATP 结合;50.锌离子结合。Fig.4 GO enrichment of target genes of differentially expressed miRNA1.regulation of transcription,DNA-templated;2.signal transduction;3.transcription,DNA-templated;4.multicellular organism development;5.cell adhesion;6.regulation of transcription from RNA polymerase Ⅱ promoter;7.G-protein coupled receptor signaling pathway;8.proteolysis;9.Wnt signaling pathway;10.transport;11.nervous system development;12.phosphorylation;13.determination of left/right symmetry;14.small GTPase mediated signal transduction;15.protein phosphorylation;16.neural crest cell migration;17.positive regulation of transcription from RNA polymerase Ⅱpromoter;18.canonical Wnt signaling pathway;19.amino acid transmembrane transport;20.epiboly involved in gastrulation with mouth forming second;21.oxidation-reduction process;22.lipid metabolic process;23.dorsal/ventral pattern formation;24.cell differentiation;25.positive regulation of gene expression;26.membrane;27.integral component of membrane;28.nucleus;29.cytoplasm;30.plasma membrane;31.integral component of plasma membrane;32.endoplasmic reticulum;33.endoplasmic reticulum membrane;34.extracellular exosome;35.extracellular space;36.extracellular region;37.cytosol;38.Golgi apparatus;39.proteinaceous extracellular matrix;40.mitochondrion;41.metal ion binding;42.protein binding;43.DNA binding;44.calcium ion binding;45.sequence-specific DNA binding;46.transferase activity;47.nucleic acid binding;48.nucleotide binding;49.ATP binding;50.zinc ion binding.

图5 差异表达miRNA 靶基因显著富集的前20 个GO 注释条目圆圈代表一个GO 条目,圆圈颜色代表P 值,颜色越绿代表显著富集性越可靠,圆圈越大代表富集的靶基因数目越多,下同。1.白细胞介素-1β 分泌的负调节;2.茎环结合;3.参与炎症的细胞因子产生的负调节;4.甲基化-DNA-[蛋白质]-半胱氨酸S-甲基转移酶活性;5.内质网膜的外在成分;6.RNA 磷酸二酯键水解;7.表皮发育;8.阴离子运输的调节;9.自噬的正调控;10.轴突再生的正调控;11.蛋白质寡聚化;12.氨基酸跨膜转运;13.钙依赖性半胱氨酸型内肽酶活性;14.细胞对酸性pH 值的反应;15.脊髓背侧/腹侧模式;16.对活性氧反应的调节;17.TGF-β 结合;18.宿主对病毒基因组复制的负调控;19.β-连环蛋白结合;20.NF-kappaB输入细胞核的负调节。Fig.5 Top 20 GO terms with significant enrichment of differentially expressed miRNA target genesThe circle represents a GO term,the color of the circle represents P. The deeper the green color,the more reliable the significant enrichment,and the larger the circle,the greater the number of enriched target genes,the same below.1.negative regulation of interleukin-1 beta secretion;2.RNA stem-loop binding;3.negative regulation of cytokine production involved in inflammation;4.methylated-DNA-[protein]-cysteine Smethyltransferase activity;5.extrinsic component of endoplasmic reticulum membrane;6.RNA phosphodiester bond hydrolysis;7.epidermis development;8.regulation of anion transport;9.positive regulation of autophagy;10.positive regulation of axon regeneration;11.protein oligomerization;12.amino acid transmembrane transport;13.calciumdependent cysteine-type endopeptidase activity;14.cellular response to acidic pH;15.spinal cord dorsal/ventral patterning;16.regulation of response to reactive oxygen species;17.transforming growth factor beta binding;18.negative regulation by host of viral genome replication;19.Beta-catenin binding;20.negative regulation of NF-kappaB import into nucleus,NF-kappaB.
2.5 差异表达miRNA 靶基因KEGG 富集分析
虹鳟鳞片中DEMs 靶基因共富集到315 条通路,其中显著富集通路79 条。排名前20 的DEMs 靶基因富集通路信息见图6。最显著富集的通路是细菌入侵上皮细胞,其次为黑色素生成、甘油磷脂代谢、致心律失常性右心室心肌病(ARVC)、醚脂代谢和金黄色葡萄球菌(Staphylococcus aureus)感染等通路。

图6 差异表达miRNA 靶基因显著富集的前20 条KEGG 通路1.细胞因子-细胞因子受体相互作用;2.长寿通路调节-蠕虫;3.吞噬体;4.阿尔茨海默氏症;5.咖啡因代谢;6.酮体的合成与降解;7.Hippo 信号通路;8.内质网中的蛋白质加工;9.病毒性心肌炎;10.雌激素信号通路;11.化学致癌;12.toll 样受体信号通路;13.磷酸戊糖途径;14.麻疹;15.金黄色葡萄球菌感染;16.醚脂类代谢;17.致心律失常性右心室心肌病 (ARVC);18.甘油磷脂代谢;19.黑色素生成;20.细菌入侵上皮细胞。Fig.6 Top 20 KEGG pathways with significant enrichment of differentially expressed miRNA target genes1.cytokine-cytokine receptor interaction;2.longevity regulating pathway-worm;3.phagosome;4.alzheimer's disease;5.caffeine metabolism;6.synthesis and degradation of ketone bodies;7.hippo signaling pathway;8.protein processing in endoplasmic reticulum;9.viral myocarditis;10.estrogen signaling pathway;11.chemical carcinogenesis;12.Toll-like receptor signaling pathway;13.pentose phosphate pathway;14.measles;15.Staphylococcus aureus infection;16.ether lipid metabolism;17.arrhythmogenic right ventricular cardiomyopathy(ARVC);18.glycerophospholipid metabolism;19.melanogenesis;20.bacterial invasion of epithelial cells.
2.6 miRNA 的qRT-PCR 检测
随机选择8 个DEMs (7 个已知miRNA 和1个新预测miRNA)进行qRT-PCR 检测。8 个miRNA 在IG 与CG 组鳞片中的表达量差异均极显著(P<0.01)。8 个差异miRNA 中有3 个miRNA上调、5 个下调,各miRNA 的表达模式均与测序结果一致(图7),表明转录组测序结果可靠。

图7 差异表达miRNA 的qRT-PCR 检测Fig.7 qRT-PCR detection of differentially expressed miRNA
3 讨论
注射sCT 24 h 后,虹鳟鳞片中共筛选出24个显著DEMs (9 个表达上调,15 个表达下调)。表达上调的miRNA 中,omy-miR-29a-5p 和omymiR-200b-5p 的靶基因主要富集于Wnt、TGF-β 和Notch 等信号通路。据报道,经典Wnt 通路中的部分基因不仅能促进小鼠成骨细胞的分化、骨基质的形成及矿化,还能够抑制破骨细胞的发生及骨吸收功能[27]。其中,miR-29a/b 靶向基因为成骨细胞外基质蛋白编码基因,是促进成骨细胞分化的关键调控因子。在体外培养的hFOB 中,miR-29a 可通过下调DKK1、KREMEN2 和SFRP2 等在Wnt 信号通路中起负调控作用的基因,来增强Wnt 信号转导,进而促进成骨细胞分化[28-29]。而miR-29b 可通过下调抑制成骨细胞分化的HDAC4、TGF-β3、ACVR2A、CTNNBIP1 和DUSP2 等靶 基因的表达来促进成骨[29-30]。由此可推测,omy-miR-29a-5p 在虹鳟鳞片的骨代谢过程中具有调节作用。此外,miR-200b 可通过激活成骨样细胞系(MG-63)中骨形成信号及软骨相关信号通路,促进成骨[31]。在人牙龈上皮细胞Ca9-22 中,miR-200b 还可通过靶向作用于IKKβ和ZEB1 基因来抑制AMTN基因的表达,并抑制IL-6 的表达,抑制破骨细胞活性[32]。本研究中,omy-miR-200b-5p 靶基因预测结果显示,该miRNA 靶向作用于bmp4 和bmp15 等骨形态发生家族基因,进一步揭示了omy-miR-200b 参与调节骨细胞分化增殖过程的作用机制,印证了BMP 和TGF-β 等相关信号通路在促进成骨过程的重要作用。综上,上述两个差异miRNA 及其靶基因富集的信号通路在虹鳟骨代谢过程中具有重要调节作用。
表达下调的DEMs 中,omy-miR-30d-5p 靶基因为蛋白激酶C α (protein kinase C alpha type)基因,该基因的KEGG 富集分析结果显示其参与MAPK、Wnt 和VEGF 等骨代谢相关信号通路的调控过程。此外,miR-30 家族成员可通过靶向作用于小鼠Smad1 和Runx2 基因,抑制Bmp-2 诱导的成骨细胞分化,从而抑制BMSCs 向成骨细胞分化[33]。因此,可选取该miRNA 家族作为候选基因深入开展鱼类骨代谢研究。另一显著下调DEMs,omy-miR-138 靶基因包括可促进成骨细胞分化及骨形成的bmp1a和bmp4 基因。miRNA-138 是hMSCs 成骨细胞分化的负调节因子,可通过抑制FAKERK1/2 信号通路中与成骨过程密切相关的RUNX2 和OSX的表达来抑制成骨作用[34]。据此推测,omy-miR-138 表达水平下降对于维持虹鳟鳞组织中成骨细胞分化过程具有重要意义。omymiR-199b-5p 靶基因为钙/钙调素依赖的蛋白激酶Ⅱ型亚基β (calcium/calmodulin-dependent protein kinase type Ⅱ subunit beta),该基因富集于钙信号通路和Wnt 信号通路。上述表达下调的DEMs 其靶基因多富集于Wnt、MAPK 和TGF-β 等信号通路,其在鱼类钙代谢及骨代谢过程的调节作用有待进一步研究。
本研究筛选出的DEMs 靶基因多注释到钙离子结合、金属离子结合和G 蛋白偶联受体信号通路等功能上,这些功能在钙代谢调控过程中具有重要作用。钙代谢作为骨代谢的重要表征之一,在一定程度上反映了sCT 对于虹鳟骨代谢过程的调节作用。据报道,小鼠G 蛋白偶联受体信号通路可通过激活Wnt 信号通路,促进MSCs 向成骨细胞方向分化。由此可见,各关键信号通路在成骨细胞分化过程中的作用各异且相互调节。此外,DEMs 靶基因极显著富集在NF-kappaB 输入细胞核的负调节和il-1β分泌的负调节功能上。NF-KB在破骨细胞形成、分化、成熟和抗凋亡过程中具有重要作用[35]。IL-1β可通过多种方式促进破骨细胞的增殖分化,促进骨吸收;还可通过抑制OPG的表达,抑制骨形成[36]。据此,基于GO 注释结果筛选出的关键DEMs 可为揭示骨代谢调控机制提供研究素材。
KEGG 富集分析结果显示,DEMs 靶基因主要被显著富集于Toll 样受体信号通路、雌激素信号通路等重要的骨代谢调节通路。在Toll 样受体信号通路(TLR 信号通路)中,TLR2 可通过诱导小鼠巨噬细胞分泌TNF-α 或激活Nf-kb促进破骨细胞分化以及介导骨吸收,TLR4 可促进Il-1β过表达,促进破骨细胞形成及骨吸收[37]。雌激素是重要的骨代谢调控激素,可直接作用于成骨细胞,促进成骨细胞的增殖和抗凋亡;可通过促进胶原及BMP 合成,来促进骨矿化;与雌激素受体结合抑制破骨细胞活性;或通过抑制成骨细胞分泌IL-6 以及通过调节OPG、RANKL和M-CSF等细胞因子的平衡来抑制破骨细胞活性,还可通过促进TGF-β的表达诱导破骨细胞凋亡[36-38]。除此之外,DEMs 靶基因还被富集于各种能量代谢相关信号通路中,可见该通路中的相关基因在鱼类骨代谢调节过程中可能具有重要作用。
本研究应用高通量测序技术对sCT 注射组和对照组虹鳟鳞片进行miRNA 测序,获得了鳞片miRNA 表达谱,并利用生物信息学方法从中筛选可能参与鱼类钙代谢、骨代谢调控过程的DEMs。基于DEMs 靶基因功能注释及富集分析结果,筛选 到omy-miR-29a-5p、omy-miR-200b-5p、omymiR-30d-5p、omy-miR-138 和omy-miR-199b-5p 等多个目标miRNA,这些miRNA 在表达水平上受到sCT 影响,其对应的靶基因不仅在功能上参与骨形成、骨吸收等骨代谢的调控过程,还多显著富集于与骨代谢相关的代谢通路,上述DEMs 的发现可为揭示鱼类骨代谢的调控机制研究提供素材。
(作者声明本文无实际或潜在的利益冲突)

