大菱鲆29 个脂质代谢相关基因的组织表达
刘国旭,孟晓雪,马 强,卫育良,梁萌青,徐后国*
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071)
与哺乳动物不同,鱼类不能很好地利用碳水化合物作为能量来源,因此,脂质是鱼类除蛋白质之外的最主要能量来源,同时,脂肪和脂肪酸还在鱼类的生理、发育和生殖过程中发挥重要作用[1]。脂质代谢是一个复杂的生理过程,包括脂质的吸收、运输、沉积和供能动员等过程,许多关键酶和转录因子参与了这些代谢过程[2]。
在鱼类中,脂肪组织的分布具有多样化的特点。同时,脂肪组织的分布对脂肪代谢具有重要的影响。脂肪组织不但是脂质存储器官,也是脊椎动物重要的代谢器官,可以调节能量稳态并参与生物体内多个生理生化反应[3]。不同鱼类的脂肪组织分布模式具有较大差异,如红鳍东方鲀(Takifugu rubripes)的脂质几乎完全储存在肝脏中,没有腹膜内脂肪组织,肌肉中的脂质含量也非常低[4]。鲑鳟鱼类则将很大一部分脂质储存在骨骼肌中[5-6]。草鱼(Ctenopharyngodon idella)、莫桑比克罗非鱼(Oreochroms mossambcus)、卵形鲳鲹(Trachinotus ovatus)和大黄鱼 (Larimichthys crocea)则以肠系膜脂肪组织为主,紧密地包裹在肠道周围[7]。牙鲆(Paralichthys olivaceus)的脂肪组织分布在眼侧和鱼鳍,将肝脏及鱼鳍周围的皮下组织作为脂肪储存的主要部位[8]。
大菱鲆(Scophthalmus maximus)是我国重要的海水经济养殖鱼类,其生长速率快、抗逆性强、肉质鲜美,目前已成为我国北方海水养殖产业的支柱之一[9]。大菱鲆内脏中脂肪组织很少,利用核磁共振成像(MRI)技术在其皮肤下检测到了清晰的脂肪信号,而在内脏中脂肪信号不明显,这表明在大菱鲆中,鳍条附近的皮下脂肪组织是其主要的脂肪组织[5]。一般认为内脏脂肪组织、肝脏和肌肉是鱼类脂肪沉积的主要部位[5],但事实上皮下和内脏脂肪组织容易受到营养、病理或环境因素的影响,被认为是许多代谢综合征的预测因子[10],皮下脂肪组织应引起更多的关注。
以大菱鲆为模型研究脂肪代谢关键基因表达的组织差异,有助于揭示特定储脂类型鱼类中的典型脂肪代谢特征,从而有助于完善鱼类脂肪代谢理论。本研究对大菱鲆全组织29 个脂质代谢关键基因(表1)的组织差异表达进行分析,以初步探究大菱鲆不同组织中的脂质代谢特点。该29 个关键基因所涉及的生理过程包括脂肪酸合成、脂肪酸β氧化、甘油三酯的合成和水解、脂质运输、脂质代谢以及胆汁酸和胆固醇代谢。研究结果将有助于更好地了解大菱鲆脂代谢特点,从而有助于更科学的脂肪营养管理。
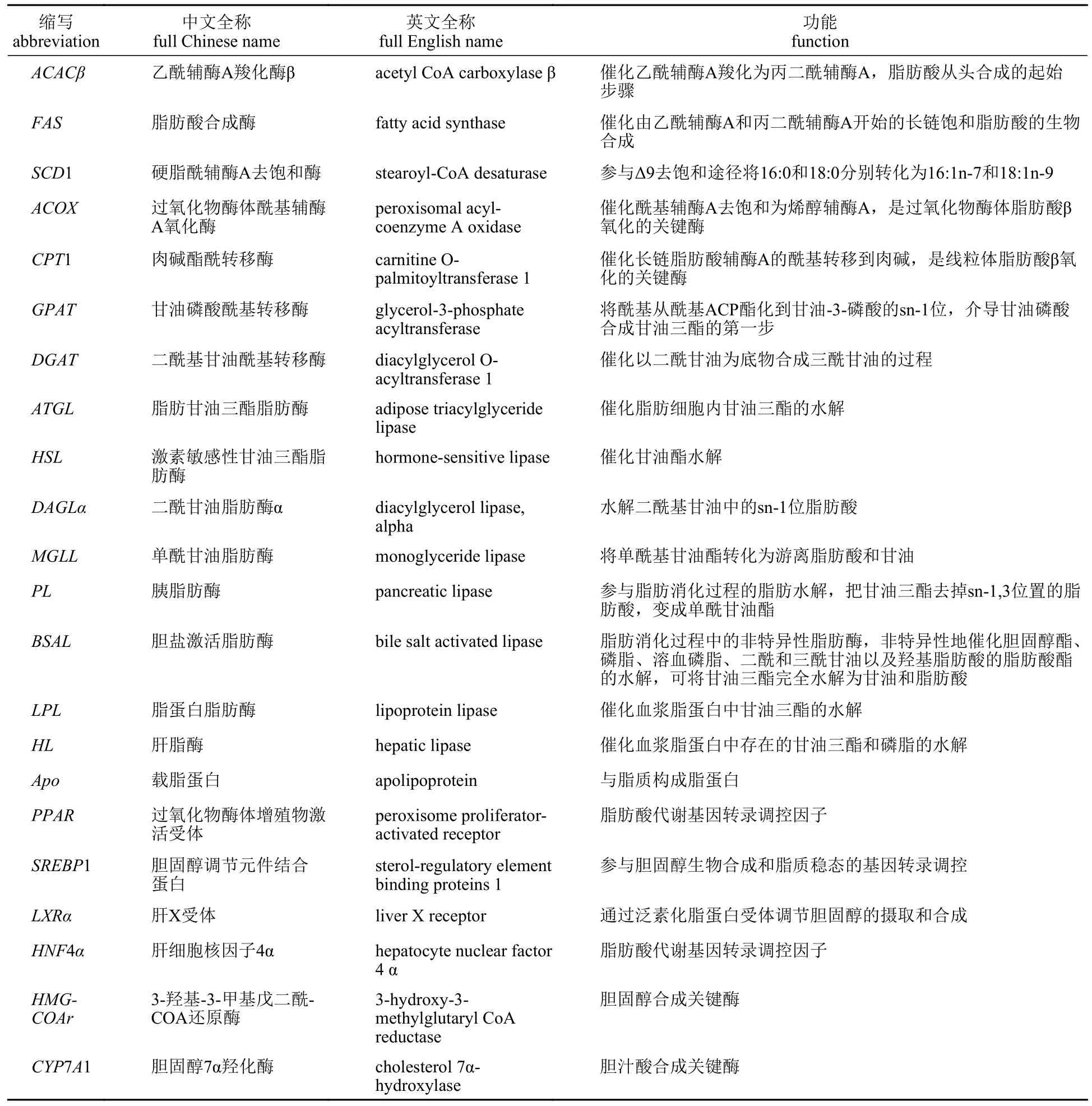
表1 关键基因的缩写及功能对照表Tab.1 Abbreviation and function of genes investigated
1 材料与方法
1.1 实验对象
本研究采用黄海水产养殖有限公司(中国海阳)提供的同一批大菱鲆幼鱼(平均体重约20 g)。采样前,用商品饲料(蛋白质含量50%,干物质脂肪含量10%)喂养1 个月。从30 尾鱼中采集眼、鳃、脑、皮肤、肌肉、肝脏、胃、肾脏、脾脏、心脏、前肠、幽门盲囊、后肠、盲肠和鳍条附近皮下脂肪组织(在后续图表及描述中以“脂肪组织”简称)的样本,每个组织中收集10 尾鱼的等量样品作为一个生物学重复,共3 个生物学重复。实验过程中操作人员严格遵守动物实验伦理规范,并按照相关的规章制度执行。
1.2 RNA 提取、cDNA 合成、实 时定量PCR反应(qRT-PCR)分析
使用RNAiso Plus [宝生物工程(大连)有限公司]提取样本(每个组织3 个重复)中的总RNA。将组织样品(50~100 mg)用液氮研磨成粉末状,加入1 mL Trizol 试剂在Rnase free 管中充分混合。离心(12 000×g,4 °C,10 min)后,取上清液转移到新离心管中,加入0.2 mL 氯仿,剧烈振荡30 s,冰上静置3 min。离心(12 000×g,4 °C,15 min),将上清液转到新离心管中,加入等体积异丙醇,混匀,-20 °C 保存20 min。离心(12 000×g,4 °C,10 min),弃上清液,管底和管壁形成RNA 沉淀,加入1 mL 75%乙醇,混匀,离心(12 000×g,4 °C,10 min),再弃上清液,加1 mL 75%乙醇,混匀,离心(12 000×g,4 °C,10 min)。弃上清液,将上清液风干,加DEPC 水 (20~30 μL)溶解获得的RNA。使用1.5%的琼脂糖凝胶电泳检测RNA 的污染和降解度。用Colibri 超微量分光光度计(Titertek-Berthold,德国)对RNA 的浓度和纯度进行检测。然后根据用户手册使用Evo M-mLV RT Mix Kit with gDNA Clean for qPCR(艾科瑞生物技术有限公司,长沙)进行反转录,用于后续的实时荧光定量分析。
根据NCBI 中的序列设计目标基因和内参基因的引物(表2),由擎科生物科技有限公司(青岛)合成。内参基因选用在大菱鲆各组织均稳定表达的EF1α和RPL13。梯度稀释的模板用于验证目标基因,绘制标准曲线,所有引物的扩增效率为95%~105%,线性回归系数(R2)大于0.99。采用SYBR®GreenPro TaqHS 预混型qPCR 试剂盒Ⅱ(艾科瑞生物技术有限公司,长沙)和实时荧光定量PCR 仪(Roche,瑞士)进行qPCR 反应。反应体系由2 μL cDNA 模板(稀释10 倍)、10 μL SYBR®GreenPro TaqHS Premix Ⅱ (2×)、0.8 μL正向引物(10 μmol/L)、0.8 μL 反向引物(10 μmol/L)和6.4 μL 无菌水组成。程序:95 °C 30 s;95 °C 5 s,57 °C 30 s,72 °C 30 s,40 个循环。在PCR 反应结束时,系统地进行熔解曲线(95 °C 10 s,65 °C 60 s,97 °C 1 s)分析,每个样品3 个重复。采用2-△△CT法研究各基因的表达水平[11]。对某个基因,以表达量最低的组织中的表达量作为1,其他组织中的表达量表示为该组织表达量的倍数。
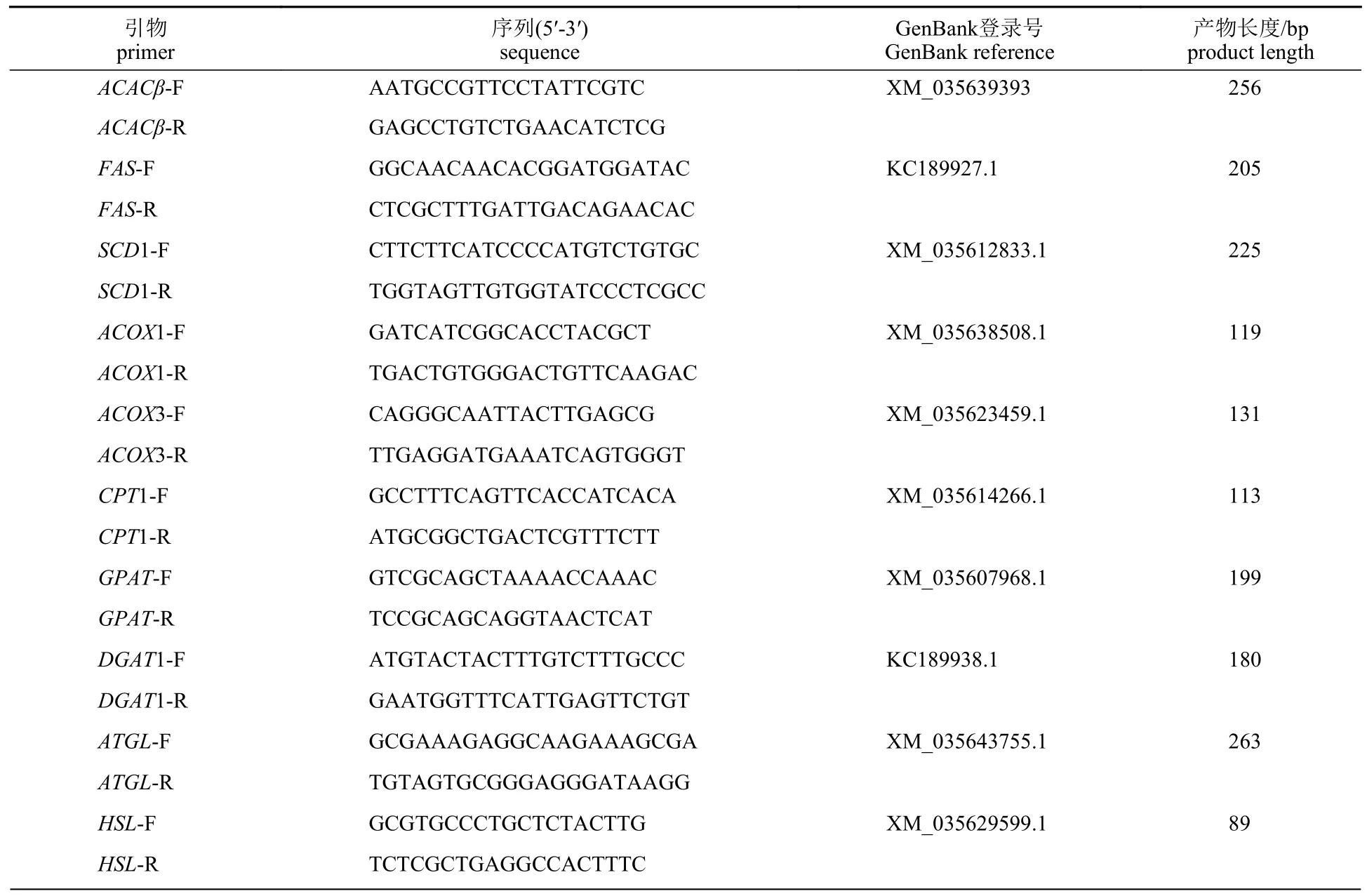
表2 实验所涉及的引物序列Tab.2 Sequences of the primers used
1.3 数据分析
用SPSS 16.0 软件对基因表达数据进行单因素方差分析。采用Tukey 氏的多重检验来检测均值之间的显著差异。显著性水平为P<0.05。但由于不同组织间的数量级差异,大多数数据无法通过方差齐性检验。因此结果中没有使用P值和标准误,仅以平均值表示。
2 结果
2.1 脂肪合成相关基因
本研究对ACACβ、FAS和SCD1 这3 个脂质合成基因进行了定量分析(图1)。ACACβ在心脏和肠中表达量最高,在脂肪组织中表达量最低。FAS和SCD1 均在脑中表达量最高,在肝脏中表达量最低,另外,SCD1 在眼中表达量也相对较高。

图1 大菱鲆脂肪合成基因的组织分布(a) ACACβ,(b) FAS,(c) SCD1。以表达量最低的组织中的表达量为1。1.眼,2.脑,3.鳃,4.心脏,5.皮肤,6.脂肪组织,7.肌肉,8.肝脏,9.肾脏,10.脾脏,11.胃,12.幽门,13.前肠,14.后肠,15.盲肠;下同。Fig.1 Tissue distribution of lipogenic genes in S.maximus(a) ACACβ, (b) FAS, (c) SCD1.The expression in the tissue with the lowest expression is 1.1.eye,2.brain,3.gill,4.heart,5.skin,6.adipose tissue,7.muscle,8.liver,9.kidney,10.spleen,11.stomach,12.pylorus,13.foregut,14.hindgut,15.cecum;the same below.
2.2 脂肪氧化分解相关基因
ACOX1 与ACOX3 的组织表达分布模式相似,均在肠中表达量最高,在脂肪组织和肌肉中表达量最低,另外ACOX1 在脑中表达量也较高(图2)。CPT1 在鳃中表达量最高,其次是肾脏、脑和胃,在肝脏和肠中表达量最低。

图2 大菱鲆脂肪氧化分解基因的组织分布Fig.2 Tissue distribution of fat oxidative decomposition genes in S.maximus
2.3 甘油三酯合成
GPAT3 在肝脏中表达量最高,在脂肪组织和肌肉中表达量最低(图3)。DGAT在盲肠中表达量最高,其次是前肠和后肠,在心脏和鳃中表达量最低。
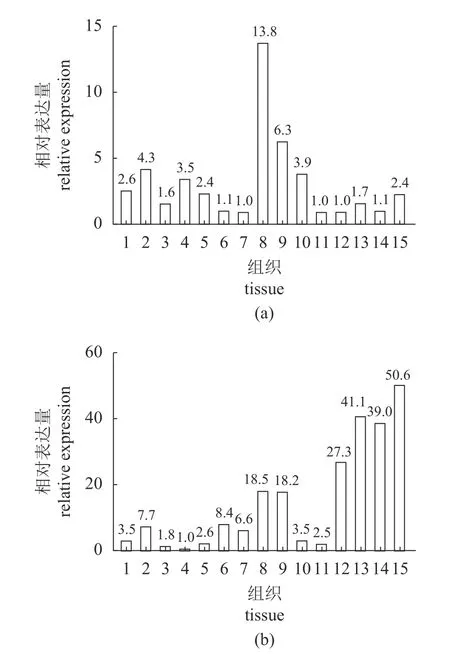
图3 大菱鲆甘油酯合成相关基因的组织分布Fig.3 Tissue distribution of glyceride synthesis-related genes in S.maximus
2.4 甘油三酯水解
ATGL主要在肝脏中表达,其次是心脏(图4)。HSL在眼中表达量最高,其次是脂肪组织,在肠道中表达量很低。DAGLα在脑中表达量最高,其次是眼睛和心脏,在肝脏中表达量最低。MGLL在脑中表达量最高,在肌肉中表达量最低。

图4 大菱鲆细胞内甘油酯酶的组织分布Fig.4 Tissue distribution of intracellular glyceridases in S.maximus
2.5 肠道内甘油酯水解
PL和BSAL-Like在大菱鲆中组织分布相似,均在幽门盲囊、肠道和脾脏中表达量较高,在鳃、心脏和肾脏中表达量较低(图5)。

图5 大菱鲆肠道内甘油酯酶的组织分布Fig.5 Tissue distribution of glycerol esterase in the intestine of S.maximus
2.6 血管内甘油酯水解
LPL在所有组织中均有表达,在肝脏中表达量最高,其次为脂肪组织、肌肉和鳃,在肾脏和肠道中表达量最低(图6)。HL在肝脏中表达量最高,在肠道内表达量较高,在肾脏中表达量最低,但在脑、鳃、心脏、脂肪组织和肌肉中并未检出。
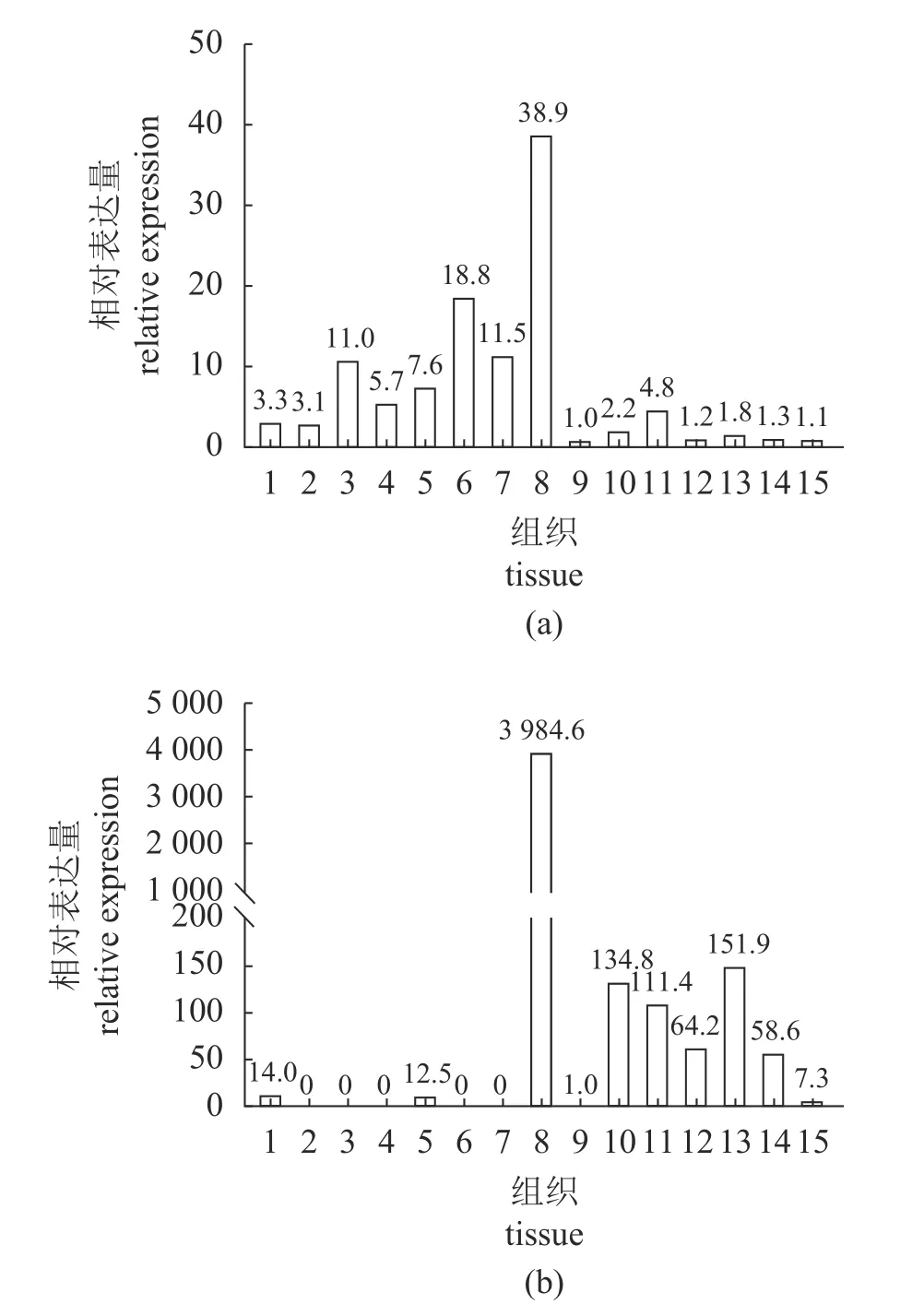
图6 大菱鲆血管中甘油酯酶的组织分布Fig.6 Tissue distribution of intravascular glycerol esterase in S.maximus
2.7 脂肪酸转运
载脂蛋白的组织分布非常不平衡。ApoA1 在所有组织中都有表达,但在肝脏和肠道中的表达水平极高(图7)。ApoA4 在肠道中表达量极高,在肝脏中表达量中等,但其他组织中几乎未检出。ApoB100 在肝脏和肠道中表达量极高,在眼、脑和鳃等部位表达量极低。ApoEα主要在肠和肝脏中表达,在其他组织中表达量较低。

图7 大菱鲆载脂蛋白基因的组织分布Fig.7 Tissue distribution of apolipoprotein genes in S.maximus
2.8 胆汁酸和胆固醇代谢
HMF-CoAr在各组织中均有表达,在肠道中表达量最高,其次为肝脏,在肌肉中表达量最低(图8)。CYP7A1 在肠道和肝脏中表达量很高,在其他组织中表达量很低,且在心脏、肌肉和脂肪组织中并未检测到其表达。

图8 大菱鲆胆汁酸和胆固醇代谢相关基因的组织分布Fig.8 Tissue distribution of genes related to bile acid and cholesterol metabolism in S.maximus
2.9 脂代谢相关转录因子
PPARα在所有组织中均有表达,但PPARα1和PPARα2 的组织分布模式不同(图9)。PPARα1在肠中高表达,其次是胃,而PPARα2 在心脏中高表达,在其他组织中表达量较低。PPARβ在肝脏中表达量最高,在其他组织中表达量较低。PPARγ在肠中表达量较高,在肝脏中具有中等表达量,在其他组织中表达量较低。SREBP1 在所有组织中均有表达,在眼和脑中表达量最高。LXR-α在肝脏中表达量最高,其次为肾脏和脾脏。HNF4α在肠道中表达量较高,在肝脏中具有中等表达量,在其他组织中表达量很低。

图9 大菱鲆脂代谢相关转录因子的组织分布Fig.9 Tissue distribution of transcription factors related to lipid metabolism in S.maximus
3 讨论
分析脂代谢基因的组织分布有助于更好地理解这些基因在脂肪代谢中的生理作用,也有助于了解不同组织在脂肪代谢中的特定功能。脂肪合成相关基因ACACβ、FAS和SCD1 在大菱鲆肝脏中的表达量都很低。ACACβ和FAS是催化脂肪酸生物合成的关键酶,SCD1 可以通过Δ9 去饱和途径,将16:0 和18:0 分别转化为16:1 和18:1[12]。ACACβ在肠中表达量最高,FAS和SCD1 在脑中表达量最高,与脂肪生成有关的转录因子PPARα1 和HNF4α也在大菱鲆的肠道中高表达,这表明在大菱鲆体内,肠道和大脑的脂肪生成可能比肝脏更活跃。LC-PUFA (long chain polyunsaturated fatty acids,C≥20)在促进神经系统的发育方面发挥着重要作用[13]。FAS和SCD1 在大菱鲆的脑中高表达,可能是因为这些脂肪酸在大脑中被选择性合成以满足自身需求。肠道是重要的消化器官,脂质在其中被消化和吸收。然而,目前的结果表明,肠道可能不仅是营养吸收的场所,也是LC-PUFA 生物合成的重要器官[14]。在其他鱼类物种中也观察到了这种情况,如舌齿鲈(Dicentrarchus labrax)[15]、红鳍东方鲀[4]和大西洋鲑(Salmo salar)[16-17]。尤其是在大西洋鳕(Gadus morhua)中,肠细胞的LC-PUFA 生物合成比肝细胞高7 倍[18]。虽然在很多鱼类中,肝脏被证明是脂肪生成的主要部位[19-20],但本研究的结果表明,肠道在大菱鲆的脂质合成中起着重要作用。
脂肪酸氧化代谢主要通过线粒体β氧化进行[21]。CPT1 是线粒体内脂肪酸β氧化的限速酶,催化酰基辅酶A 转化为酰基肉碱进入线粒体基质[22]。CPT1 在大菱鲆鳃中高表达,这与矛尾复虾虎鱼(Synechogobius hasta)[23]组织分布结果一致。但在红鳍东方鲀[4]和黄颡鱼(Pelteobagrus fulvidraco)[24]中,CPT1 主要在心脏和肌肉这些具有高脂肪酸β氧化需求的组织中表达。鉴于CPT1 在脂肪代谢和能量稳态中的意义,不同鱼类之间CPT1 基因的差异表达可能与其对能量需求和营养状况变化的反应有关[23]。并且,CPT1 存在两种亚型,在哺乳动物中,CPT-1A广泛表达于肝脏、脾脏、肠道和心脏等大多数组织中,而CPT-1B主要表达于肌肉、脂肪组织、心脏和睾丸[25]。两种CPT1亚型(CPT-1A和CPT-1B)在代谢过程和调节中可能起到不同的作用[23]。
ACOX1 与ACOX3 是过氧化物酶体脂肪酸β氧化的限速酶,催化酰基辅酶A 去饱和为烯醇辅酶A[26]。一般来说,肝脏是过氧化物酶体脂肪酸β氧化的主要部位,在南极隆头鱼(Notothenia gibberifrons)中,过氧化物酶体β氧化可能占肝脏总活性的30%[27]。但在大菱鲆中,ACOX1 与ACOX3主要在肠道中表达,这与大西洋鲑的组织表达结果一致[14],但是目前关于鱼类过氧化物酶体脂肪酸β氧化的文献较少,关于肠细胞过氧化物酶体脂肪酸代谢,以及肝细胞和其他细胞中脂肪酸过氧化物酶体脂肪酸β氧化途径的相互作用还有待研究[28]。
关于甘油三酯的生物合成和水解,GPAT3、DGAT、ATGL、HSL、DAGLα和MGLL的组织表达特点很好地表明了大菱鲆脂肪消化和吸收的特点。肠道中甘油三酯(TAG)的合成有两种路径:一条是甘油一酯(MAG)路径,就是把吸收的MAG在单酰甘油酰基转移酶(MGAT)作用下,变成二酰甘油(DAG),然后再在二酰基甘油酰基转移酶(DGAT)作用下变成TAG。另一条是甘油-3-磷酸(G-3-P)路径,它以甘油为底物,甘油先通过甘油激酶磷酸化,生产α-甘油磷酸(或者直接以糖酵解产生的α-甘油磷酸为底物)。α-甘油磷酸在甘油-3-磷酸酰基转移酶(GPAT)作用下生成二酰甘油[29],接着DGAT发挥作用,生成TAG[30]。在本研究中,DGAT在肠道中高表达,而GPAT只在肝脏中高表达。这表明在大菱鲆中,MAG 途径可能比G-3-P 途径占优势。
两种主要脂肪酶ATGL和HSL对肝脏和脂肪组织中的脂解至关重要。ATGL是TAG 水解、生成DAG 和脂肪酸的第一步的限速酶,而HSL负责随后DAG 的降解,生成MAG 和脂肪酸[31]。在本研究中,ATGL主要在大菱鲆肝脏中表达,这与大黄鱼组织表达结果相似[32]。MGLL与HSL有着协同作用,将脂肪细胞和其他细胞内储存的TAG 水解为甘油和脂肪酸,MGLL还可以补充脂蛋白脂肪酶,水解脂蛋白TAG 降解产生的单甘酯[33]。MGLL主要在大菱鲆的脑中表达,HSL主要在眼和脂肪组织中表达,这与红鳍东方鲀组织表达结果相似[4]。但是在矛尾复虾虎鱼[23]中,HSL主要在肠中表达。组织特异性表达的差异表明,不同动物之间可能存在不同的脂质代谢机制[32]。DAGLα主要催化具有不同长脂肪酰基链的MAG的“按需”生物合成[34]。大脑中DAGLα的高表达证明了其在大菱鲆脑中的特殊功能,而且DAGL还可生物合成2-花生四烯酸甘油、2-亚油酸甘油、2-油酸甘油和2-棕榈酰甘油,这对中枢神经系统的神经调节很重要[34]。
PL主要由胰腺腺泡细胞分泌,并在十二指肠中起消化脂肪的作用[35]。PL主要在大菱鲆的脾脏和肠道中表达,可能在脂肪的消化方面起着重要作用。BSAL具有广泛的底物特异性,不仅参与肠道内三酰甘油的消化,还可参与脂溶性维生素酯和胆固醇酯的消化[36]。BSAL在大菱鲆的肠道和脾脏中高度表达,表明这种酶可能在这些组织中合成,然后分泌到消化道进行TAG消化。
HL和LPL是参与脂肪降解的关键酶[37]。LPL水解血浆脂蛋白中存在的三酰甘油,并提供游离脂肪酸,用于脂肪组织中的储存或在其他组织中的β氧化,在调节鱼体内脂质含量方面起着关键作用[38]。HL属于与血液循环中内源性TAG代谢有关的酶之一,与LPL在功能上有相似之处,然而却是两种不同性质的酶,HL主要作用于小颗粒脂蛋白,调节胆固醇从周围组织转运到肝脏[39]。在本研究中,LPL在肝脏中的表达占主导地位,这与虹鳟(Oncorhynchus mykiss)和真鲷(Pagrus major)中的报告类似[40-41],表明LPL基因主要表达在对脂肪酸β氧化或储存有高脂质需求的组织中[23]。HL也主要在大菱鲆肝脏中表达,可能与肝脏中胆固醇代谢调节有关。
关于载脂蛋白,其基因表达的组织分布与其功能高度相关。载脂蛋白ApoA1 是血浆高密度脂蛋白(HDL)的主要载脂蛋白,是磷脂和游离胆固醇的优先受体[42]。ApoA4 主要作用于肠道脂质吸收[16]。ApoB100 是低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)的主要蛋白质成分[43]。ApoEα可以通过与不同细胞受体的相互作用,介导胆固醇和脂质的运输和摄取[44]。在本研究中,载脂蛋白主要在大菱鲆肝脏和肠道中表达,这与中华鲟(Acipenser sinensis)[45]、塞内加尔鳎(Solea Senegalensi)[46]、金头鲷(Sparus aurata)[47]和石斑鱼(Epinephelussp.)[48]的结果相似。大多数载脂蛋白基因在肠道和肝脏中高表达,可能与脂蛋白将肠道中吸收的脂质运输到肝脏储存或代谢的功能有关。
胆固醇的生物合成由反馈机制控制,关键酶是HMG-CoAr[49],在大菱鲆的肠道和肝脏中高表达。胆汁酸在脂肪消化和脂肪吸收方面有着不可替代的作用[50],CYP7A1 是胆汁酸合成的第一限速酶,对肝脏中胆汁酸的合成至关重要[51]。在哺乳动物中,CYP7A1 仅在肝脏中表达[52-53]。在大菱鲆中,主要在肠道和肝脏中表达,这与虹鳟的组织表达结果相似[51],说明这些组织可能与胆汁酸合成及其肠肝循环有关[54]。
PPARα存在两个亚型,即PPARα1 和PPARα2,二者功能多样化,PPARα1 主要参与脂肪的生成,PPARα2 主要参与脂肪酸的β氧化[55]。在哺乳动物中,PPARα主要在脂质代谢活跃的组织中表达,如肝脏、心脏和肌肉[56]。在鱼类中,矛尾复虾虎鱼[23]、拟庸鲽(Pleuronectes platessa)和金头鲷[57]中的PPARα也在肝脏和心脏中高表达,但在褐鳟(S.trutta)中,PPARα主要在肌肉中表达[58]。在本研究中,PPARα1 主要在大菱鲆的肠道和胃中表达,PPARα2 主要在心脏中表达。PPARα是一种配体激活的转录因子,可以与相应的反应元件结合以激活脂肪酸β氧化中的靶基因。因此,推测PPARα2 在心脏脂质代谢过程中可能发挥关键作用。
迄今为止,PPARβ在鱼类中的作用尚不清楚,该基因在大菱鲆所有组织中的表达量均较低。一项关于长鳍篮子鱼(Siganus canaliculatus)的研究表明,鳃具有最高的PPARβ表达[59]。在红鳍东方鲀中,PPARβ在眼睛、心脏和脑中具有相对高的表达[4]。本研究结果显示,PPARβ在大菱鲆的肝脏中表达量较高,推测可能是PPARβ参与了某些特定脂肪酸的代谢。
PPARγ可以控制脂肪组织中脂质的储存及脂肪组织的分化[60-61]。在大菱鲆中,PPARγ主要表达在肠道和肝脏中,与红鳍东方鲀[4]以及长鳍篮子鱼[59]实验中观察到的情况类似。有研究报告称,脂肪组织和肝脏是PPARγ表达的主要部位[57-62],这表明PPARγ可能在控制鱼类这些组织的脂质代谢和储存功能中起着关键作用。
SREBP-1 是一种膜结合转录因子,调节脂肪生成基因如FAS和ACAC的表达,是测定脂肪生成能力的指标基因之一[63]。在矛尾复虾虎鱼[23]和黄颡鱼[24]中,SREBP-1 主要在肝脏中表达,但在本研究中,SREBP-1 主要在眼和脑中特异性表达,SREBP-1 可能在这些组织的脂肪生成调节中起重要作用。
LXRα在调节胆固醇稳态中起着重要作用,通过泛素化脂蛋白受体调节胆固醇的摄取[64]。在本研究中,LXRα主要在大菱鲆的肝脏、肾脏和脾脏中表达,在红鳍东方鲀[4]和虹鳟[65]中,LXRα主要在脾脏表达,表明该基因可能参与鱼类健康调节。
HNF4α参与碳水化合物代谢,是糖异生速率控制酶磷酸烯醇式丙酮酸羧激酶(PEPCK)的主要调节蛋白[66]。HNF4α也在大菱鲆的肠道和肝脏中高表达,说明大菱鲆的肠道和肝脏可能是碳水化合物代谢的主要场所,而碳水化合物能以多种方式与脂质代谢产生相互作用[67]。
综上所述,本实验详细研究了29 个脂代谢关键基因在大菱鲆体内的组织表达情况,为研究大菱鲆脂代谢特征及探索不同储脂类型鱼类中脂肪代谢的多样性提供了基础数据。
(作者声明本文无实际或潜在的利益冲突)

