治疗疼痛的抗体药物的临床进展
王永梅,彭凯婷,王琪,王桂凤,王春河
(中国科学院上海药物研究所,上海 201203)
2020年,国际疼痛学会对疼痛的定义为“疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历”[1]。它极大地影响着人们的生活质量。按照病因,疼痛可分为由组织损伤引起的痛觉性疼痛、神经损伤引发的神经病理性疼痛或神经系统敏感引起的神经痉挛性疼痛[2]。按照其持续时间,疼痛可分为急性疼痛和慢性疼痛。急性疼痛主要由组织损伤引起,其作用在于向机体发出危险信号。慢性疼痛往往是一种疾病,主要由感觉神经系统的病变引起[2]。在慢性疼痛中,中枢和外周神经都被敏化,导致机体对疼痛的反应被放大。
疼痛是一种常见的疾病,其中患者人数最多的是慢性疼痛。根据最新发布的《中国疼痛医学发展报告(2020)》,我国慢性疼痛患者已超3亿,且每年以1000万至2000万人的速度快速增长[3]。临床数据显示,接近20%的慢性疼痛患者6个月内因疼痛治疗产生的个体费用超过5000元[3]。慢性疼痛极大地增大了患者的经济负担,影响患者的生活质量。
目前临床上用于治疗慢性疼痛的药物种类繁多,主要是阿片类、非甾体类小分子药物。阿片类药物镇痛效果显著,但由于其具有便秘、呼吸抑制和易成瘾性等严重不良反应,限制了它们的临床应用[4]。非甾体抗炎药也有对胃肠道造成损伤、升高血压和增加心力衰竭等不良反应的风险[5]。基于这些药物的种种弊端,开发新型镇痛药物具有迫切的临床需求。在过去的10年中,随着抗体技术的发展,抗体药物在治疗慢性疼痛方面显示出独特的优点,获得越来越多研究者和药物开发公司的关注。
目前治疗疼痛的抗体药物主要研发机制包括阻断疼痛信号传导、降低神经敏化、减少神经炎症,靶点包含神经生长因子(nerve growth factor,NGF)、原肌球蛋白受体激酶A(tropomyosin receptor kinase A,TrkA)、降钙素基因相关肽(calcitonin gene related peptide,CGRP)、降钙素基因相关肽受体(calcitonin gene related peptide receptor,CGRPR)、垂体腺苷酸环化酶激活肽38(pituitary adenylate cyclaseactivating polypeptide 38,PACAP38)、垂体腺苷酸环化酶激活肽受体1(pituitary adenylate cyclaseactivating polypeptide type 1 receptor,PAC1R)等。
1 神经生长因子及其受体原肌球蛋白受体激酶A
1.1 神经生长因子及其受体在疼痛机制中的相关作用
NGF属于神经营养因子家族,对胚胎发育过程神经元的存活起着重要作用[6]。在成年人体及动物中,NGF主要在损伤、炎症等情况下调节炎症反应,敏化痛觉感受器[7]。NGF水平在各种急性和慢性疼痛状态下升高,包括类风湿性关节炎、脊柱关节炎和退行性椎间盘疾病等[8]。作为外周疼痛介质,它主要通过以下3种方式参与多种炎症和神经病理性疼痛:1)通过与位于痛觉感受器表面的特异性高亲和力NGF受体——TrkA结合[9],激活下游丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)等信号通路,降低神经元动作电位阈值,提高神经元兴奋性,敏化痛觉[10]。2)通过上调传入神经元上的离子通道和受体,如瞬时受体电位香草酸1型受体(transient receptor potential vanilloid-1,TRPV1)、缓激肽受体和电压门控钠通道等[11],使痛觉神经元对疼痛刺激敏感[12]。3)增加疼痛介质的释放,如 P 物质、组胺、缓激肽等,从而增强疼痛反应[13]。
当NGF抗体阻断NGF与TrkA受体的结合时,能有效阻断由肌肉、皮肤和器官组织产生的疼痛信号,抑制这些信号向脊髓和大脑的传导。这种机制可以减轻神经细胞的敏感性,并起到镇痛的作用[14]。与阿片类镇痛药相比,靶向NGF的药物没有成瘾性,且在多项针对不同类型疼痛的临床研究中,以NGF为靶点的多种药物已经被证实可有效缓解疼痛[15-16]。
1.2 靶向神经生长因子的抗体临床进展
NGF作为治疗疼痛的靶点的巨大价值已得到业内广泛认可。鉴于NGF抑制剂市场的巨大商业前景,国内外许多制药企业已积极开展相关药物的研发,目前有9款NGF抗体药物(8款单克隆抗体、1款双特异性抗体)处于临床试验阶段,如表1所示。迄今为止一共有3款抗体进入过Ⅲ期临床,分别是tanezumab(礼来和辉瑞共同研发)、fasinumab(再生元和梯瓦共同开发)和fulranumab(安进和强生共同开发),但fulranumab目前已停止开发。

表1 应用于疼痛领域的靶向NGF的抗体研究进展Table 1 Advances in antibodies targeting NGF for pain treatment
由礼来和辉瑞公司共同研发的tanezumab是全球首款靶向NGF的单克隆抗体。作为疼痛领域药物开发的领先者,礼来公司最早于2006年开展适应证为中度至重度膝关节炎的Ⅱ期临床试验,发现tanezumab具有良好的改善关节疼痛的效果[15];并且长期重复给药时不良反应低[17]。但在2009年开展的治疗骨关节炎的Ⅲ期临床试验中,发现受试者出现骨坏死和全关节置换的安全问题[18],2010年美国食品药品监督管理局(Food and Drug Administration,FDA) 暂停了NGF抗体除治疗癌痛以外的所有临床试验[18]。随后,美国FDA 关节炎咨询委员会审查了tanezumab 骨关节炎的临床数据并进行深入分析,但未能明确证明使用tanezumab会增加骨坏死风险[19]。2015年,FDA允许礼来公司恢复tanezumab的临床试验。但在tanezumab与非甾体类镇痛药联合使用时,有明确数据证明其会显著增加快速进展性骨关节炎(rapidly progressive osteoarthritis,RPOA)的风险[14,20-21]。
在随后的Ⅲ期临床试验中,tanezumab开发人员采用了降低治疗剂量、实施严格的风险缓解策略(对潜在志愿者进行严格的入组前放射学评估,排除已有肩、髋或膝关节异常的志愿者[22])、调整给药方式(由静脉注射改成皮下注射)等改良策略。在适应证为髋关节或膝关节骨关节炎疼痛的临床试验中,tanezumab在开始治疗后第4周会缓解髋关节或膝关节骨关节炎疼痛,改善膝关节和髋关节的功能,这种效果可持续到第16或24周[23-25]。但高剂量组比低剂量组更频繁地发生 RPOA和异常外周感觉(abnormal peripheral sensation,APS)的不良反应[23]。
在另一项适应证为慢性腰痛的Ⅲ期临床试验中,与安慰剂相比,10 mg的tanezumab能明显改善难以治疗的慢性腰背痛患者的疼痛和腰背功能[26];在第16周时10 mg的tanezumab镇痛效果优于临床上常用的阿片药物曲马多[27]。在一项比较tanezumab与非甾体抗炎药萘普生、塞来昔布或双氯芬酸的镇痛效果的临床试验中,皮下注射5 mg的tanezumab在16周时改善髋关节或膝关节炎疼痛的效果优于非甾体抗炎药,但也伴随着更高的RPOA风险[28],复合关节安全事件发生率分别是7.15%和1.48%(tanezumab组vs. 非甾体抗炎药组)[29]。
综合平衡安全性和有效性,礼来医学设计部门将治疗组中tanezumab的最大剂量限制在5 mg,并禁止在治疗组中同时使用非甾体类抗炎药。根据已有的临床数据再次进行系统评价和荟萃分析,与非甾体抗炎药和阿片类药物组相比,低剂量的tanezumab组(5 mg)的RPOA和APS的发生率偏高[30]。总的来说,NGF抗体在临床试验中显示了优于非甾体镇痛药的卓越镇痛效果,但同时也伴随着RPOA和APS发生率增高的风险。因此,在适应证为骨关节炎疼痛时,仍需要更多的研究来确定最佳剂量,并结合放射性诊疗手段确定最佳受试者,来降低风险。RPOA和APS是此类临床试验最受关注的不良反应。
梯瓦与再生元共同研发的fasinumab单抗,近期完成了治疗中度至重度慢性腰痛Ⅱ/Ⅲ期双盲试验,其受试群体选择为对乙酰氨基酚、非甾体抗炎药和阿片类药物不耐受或者疼痛缓解不足的患者。试验数据显示,每4周或每8周注射9 mg的fasinumab能够有效改善慢性腰背痛患者的疼痛与腰背功能[31]。在不良事件发生率方面,fasinumab组和安慰剂组相似(分别为65.6%和67.1%)[31];但fasinumab组RPOA发生率很高(共17例,16例在fasinumab组)[32]。这说明虽然NGF单抗在镇痛方面具有优越性,但也需要对伴有或不伴有外周骨关节炎的慢性腰痛患者进行进一步鉴别研究,以确定其最佳获益者。
强生公司的fulranumab在Ⅱ期临床试验中能够长效持续性改善中度至重度骨关节炎疼痛,但同样存在RPOA的风险[33]。在一项针对髋关节和膝关节炎的安全性和有效性的Ⅲ期临床试验中,强生过早地终止了fulranumab的Ⅲ期临床试验[34],目前已不再开发。
达石药业开发的DS002是国内首个靶向NGF的单克隆抗体,在大鼠体内已经证明DS002对外周神经性病变导致的疼痛具有良好的缓解效果[35]。2022年4月已完成Ⅰ期临床的研究,在皮下给药后长达120 d的观察期内,未发生任何严重不良反应事件,总体安全性良好。目前正在展开Ⅱ期临床研究。适应证为骨转移癌症疼痛和化疗药引起的疼痛[36],其治疗潜力未来可期。
在靶向NGF 的双特异性抗体药物开发方面,阿斯利康公司研发的NGF + 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的双特异性抗体MEDI-7352,其临床试验适应证为膝关节炎、糖尿病和慢性疼痛,目前已经进入Ⅱ期临床试验(NCT02508155和NCT04675034)。但目前尚未有临床数据披露,期待其临床表现。
尽管存在关节炎和其他不良反应的风险,以NGF为靶点的药物在疼痛治疗方面依然显示出巨大的应用潜力,值得进一步开发。当前,如何降低和控制RPOA和APS等不良反应已成为各药企亟待解决的问题。关于RPOA发生的机制尚不清晰,需要从分子和细胞水平深入探究这类不良反应的发生机制,以期优化药物的安全性。
1.3 靶向原肌球蛋白受体激酶A的抗体临床进展
TrkA 是NGF的2种受体之一,另一种NGF受体是低亲和力的 p75 神经营养因子受体(p75 neurotrophin receptor,p75NTR)[12],p75NTR 调节神经元凋亡、轴突生长、细胞增殖和突触可塑性[37]。
TrkA通过与作为疼痛介质的NGF的结合诱导寡聚化,启动下游细胞内信号转导,继而导致疼痛传递。此外,TrkA 感觉神经还参与器官和组织再生[38]。迄今为止,开发靶向TrkA的单克隆抗体药物失败率较高、进展较慢。首款靶向TrkA的抗体药物候选分子是由Glenmark公司开发的GBR900,于2014年进入Ⅰ期临床(No. NCT02235727),但后续没有更新,且该分子已经不在该公司的管线中。RottaPharma公司开发的CRB0089曾经出现在公司2019年的临床前管线中,但现在已被放弃。国内首位进行TrkA抗体开发的是熙源安健医药公司,其TrkA抗体BR01T已在美国进行I期临床试验,适应证为慢性腰痛,现已完成首次给药[39]。针对NGF和TrkA的抗体开发在疼痛治疗方面具有重要意义,相关抗体的开发特点见表2。

表2 分别靶向NGF和TrkA 2个靶点的抗体比较分析Table 2 Comparison of antibodies targeting NGF and TrkA
2 降钙素基因相关肽及降钙素基因相关肽受体
2.1 降钙素基因相关肽及其受体在疼痛机制中的相关作用
CGRP是三叉神经被激活后由血管周围神经纤维释放的血管舒张神经肽,分为α和β 2种亚型[41]。α-CGRP分布广于β-CGRP,主要在外周和中枢神经系统,其中发挥主要功能的是α亚型[42]。CGRP受体由3种独立的蛋白质组成:G蛋白偶联受体(G-protein couped receptor,GPCR)、降钙素受体样受体(calcitonin receptor-like receptor,CLR)和受体活化修饰蛋白1(receptor activity modifying protein 1,RAMP1)[1]。当CGRP与其受体结合后,会激活腺苷酸环化酶,上调细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)表达水平,激活MAPK和 细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)的表达,从而在血管内皮细胞、三叉神经节神经元及神经胶质细胞中引发不同的信号级联反应,参与疼痛的传导[43]。
CGRP在偏头痛的病理机制中起关键作用[41]。研究发现,由人体三叉神经节上的C-纤维释放的CGRP,激活卫星神经胶质细胞和三叉神经 Aδ 纤维上的 CGRP 受体,会导致三叉神经Aδ纤维的敏感化,放大外周和中枢信号传导,参与疼痛的感知[44]。此外,CGRP 在三叉神经末梢释放,诱导血管扩张、水肿和硬膜肥大细胞脱颗粒,导致神经源性炎症,继而激活感觉神经,进行疼痛信号传导[45]。在患者偏头痛发作期间,CGRP的释放水平明显升高,并与头痛严重程度呈正相关[46]。
2.2 靶向降钙素基因相关肽及其受体的抗体临床进展
目前已上市的靶向CGRP或CGRPR的药物主要是小分子拮抗剂和单克隆抗体。已上市的药物有3种口服小分子药物(rimegepant、 ubrogepant、atogepant),1种鼻内喷剂vazegepant和4种单抗[44]。小分子药物均为CGRP受体拮抗剂。单抗药物中,3种单抗靶向 CGRP(galcanezumab、fremanezumab 和 eptinezumab);1种单抗靶向CGRPR(erenumab)[44]。这些药物均能显著减少三叉神经的感觉神经周围释放的过量 CGRP[47],起到良好的镇痛效果。
靶向CGRP及其受体的抗体类镇痛药的适应证多为偏头痛。礼来的galcanezumab(商品名Emgality,恩瑞迪)采用每月皮下注射2次的方式,每次120 mg。在偏头痛临床试验中,Galcanezumab组患者每月偏头痛天数从13.4 d平均减少了4.1 d,安慰剂组从13 d平均减少了1 d,安全性和耐受性良好[48]。Teva和辉瑞联合开发的fremanezumab(商品名Ajovy,阿若维)适用于成人偏头痛的预防治疗,其Ⅲ期临床数据显示,在低给药频次下(每季度或每月给药1次),Fremanezumab对发作性偏头痛(每月发作频率为6 ~ 14 d)和慢性偏头痛(每月发作频率≥15 d)患者都表现出持久的预防效果,且耐受性良好[49-50],并减少了合并抑郁症患者偏头痛的发生[51]。在对慢性偏头痛患者重复给药的临床试验中发现,Eptinezumab可以持续减少患者的偏头痛发作频率,并改善与健康相关的生活质量,其长期使用安全性良好,免疫原性较低[52]。诺华和安进联合开发的erenumab(商品名Aimovig,艾莫维)采用皮下注射方式,初始使用剂量为70 mg,后可增加至140 mg[53-55],镇痛效果显著,能改善偏头痛患者的整体认知能力和生活质量[56]。
国内进行靶向CGRP的抗体药物开发的公司有君实生物,其单抗JS-010目前正在进行Ⅰ期临床试验[57]。综上,用于治疗疼痛的靶向CGRP的抗体药物进展汇总见表3。

表3 应用于疼痛领域的靶向CGRP和CGRPR的抗体研究进展Table 3 Advances in antibodies targeting CGRP and CGRPR for pain treatment
3 垂体腺苷酸环化酶激活肽38及垂体腺苷酸环化酶激活肽受体1
3.1 PACAP 38及PAC1R在疼痛机制中的相关作用
PACAP是由ADCYAP1基因编码的神经激活肽类物质,属于血管活性肠多肽-胰高血糖素-生长激素释放因子-促胰液素超家族[58]。其有2种主要的表达形式:含有38个氨基酸的PACAP38和含有27个氨基酸的PACAP27。 PACAP38 的分布比PACAP27更广,是PACAP 的主要生物活性形式,在哺乳动物组织中占PACAP 形式的90%[59]。已发现的PACAP38的受体有3个,分别是PAC1R、血管活性肠多肽受体1(vasoactive intestinal peptide receptor type 1,VPAC1)、VPAC2,均属于G蛋白偶联受体家族[60]。PACAP38与PAC1R结合后会激活腺苷酸环化酶,增加细胞内cAMP,从而进行细胞内信号转导、调节神经元的兴奋性。PACAP38和PACAP 受体都表达在偏头痛病理生理学的关键区域,如三叉神经节、三叉颈复合体和硬脑膜、蝶腭神经节等[61]。
与CGRP相似,PACAP也是一种血管扩张剂,由三叉神经血管系统受到刺激后在三叉神经节的神经末梢释放,能导致硬脑膜中的血管扩张并刺激血管中的痛觉感受器[61]。越来越多的研究证明,PACAP在偏头痛的病理机制中有重要作用。偏头痛患者发作期间血浆中PACAP 水平升高[62]。在早期的一项临床试验中,研究人员对健康志愿者和12名偏头痛患者进行了注射PACAP38的处理,结果发现所有健康志愿者和11名偏头痛患者均出现了头痛症状[63]。当受试者接受舒马普坦治疗时,颈外静脉的PACAP水平随着偏头痛的改善而降低[64]。一项用核磁共振成像技术的血管造影研究显示,PACAP38诱发的偏头痛与颅外动脉持续扩张有关[65]。
除了持续的血管舒张外,PACAP38引起肥大细胞脱颗粒也被认为是PACAP38引起偏头痛的机制之一[66]。肥大细胞将可溶性介质例如组胺、TNF-α和类胰蛋白酶释放到机体中,导致促炎环境和超敏反应[59]。
PACAP诱发偏头痛的确切机制尚不清楚,但就目前的试验和临床数据表明PACAP在原发性头痛的发病机制中发挥重要作用,可以作为偏头痛治疗的潜在靶标。PACAP38途径似乎与CGRP途径不同[67]。因此,对于那些对CGRP拮抗剂无法产生反应的患者来说,这可能是一种新型的治疗选择。
3.2 靶向垂体腺苷酸环化酶激活肽38的抗体临床进展
针对PACAP38目前有2家公司研发的药物进入到了Ⅱ期临床,分别是Lundbeck公司的Lu-AG09222和礼来公司的LY-3451838。Lu-AG09222是靶向PACAP38/27 的单克隆抗体,通过与PACAP38上的一个表位结合并阻断其与受体结合,完全拮抗PACAP38对PAC1R、VPAC1 和VPAC2 的激活[68]。一项干预性、双盲试验表明,Lu-AG09222可以抑制PACAP38诱导的血管舒张和心率增加,并减少伴随的头痛[69]。近期,Lundbeck宣布了Lu-AG09222在偏头痛预防方面II期概念验证结果,与安慰剂组相比,Lu-AG09222组在第1至第4周每月偏头痛天数显著减少[70]。LY-3451838是针对PACAP38的单克隆抗体,目前正在开展针对难治性偏头痛随机、双盲、安慰剂对照的II期临床研究(NCT04498910),目前尚未有公布的临床数据。
3.3 靶向垂体腺苷酸环化酶激活肽受体1的抗体临床进展
VPAC1 和 VPAC2 对 PACAP 和血管活性肠多肽(vasoactive intestinal polypeptide,VIP)的亲和力相同,但 PAC1R对 PACAP27和PACAP38 的亲和力高于对VIP 的100 倍[58]。因此有研究人员认为,偏头痛可能通过激活 PAC1受体而发生,使其成为药物开发的靶点。目前推进的最快的是安进公司开发的AMG 301,一个靶向PAC1受体的单克隆抗体。但AMG 301的Ⅱ期临床试验数据显示,与安慰剂相比,AMG 301在预防偏头痛方面没有益处[71]。可能是因为除了PAC1R之外,PACAP38还作用于其他受体来诱导偏头痛。目前有关PACAP38及其受体PAC1R的抗体药物临床进展汇总见表4。
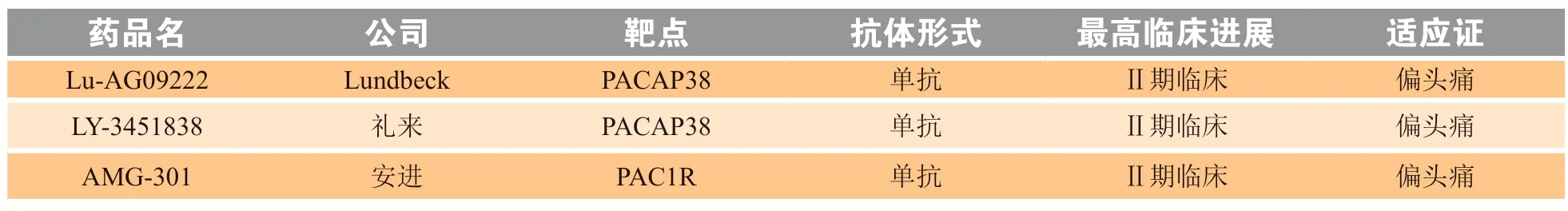
表4 应用于疼痛领域的靶向PACAP38和其受体PAC1R的抗体研究进展Table 4 Advances in antibodies targeting PACAP38 and PAC1R for pain treatment
4 结语与展望
抗体药物在治疗相关疼痛领域取得重大进展,得益于新型靶标的发现与疼痛机制的进一步揭示。目前已有多款抗体药物获批上市,应用于多种疼痛相关疾病,如癌症疼痛、关节炎痛、腰痛、偏头痛等。随着抗体技术的发展,药物形式也不仅仅局限于单克隆抗体,目前也有双特异性抗体进入临床试验。抗体药物作为一种新兴的治疗手段,在疼痛治疗领域展现出了巨大的潜力。通过选择性的结合特定靶点,阻断疼痛传导的信号,抗体药物可以减少患者的疼痛症状,并提供长期的疼痛缓解效果。不仅如此,单克隆抗体与小分子药物相比具有独特的优势(见表5),比如较长的半衰期和较低的肝毒性等不良反应风险,为患者带来更加安全和有效的选择。研究人员将靶向CGRP和CGRPR的单克隆抗体与经典阳性药物托吡酯在预防发作性偏头痛方面的数据进行了Meta分析,结果显示,CGRP和CGRPR单克隆抗体不仅表现出与托吡酯类似的效力,而且安全性更高[72]。

表5 镇痛领域单克隆抗体与小分子药物的比较Table 5 Comparison of monoclonal antibodies and small molecule drugs for pain treatment
单克隆抗体表现出巨大的前景,有诸多的优势,然而在使用单抗治疗疼痛的过程中也发现了一些缺点:由于属于蛋白质易被胃降解,因此必须采用静脉、肌肉或皮下注射给药,给药方式上不如小分子方便。此外,单克隆抗体相对分子质量较大,无法穿过血脑屏障。由于中枢神经系统在疼痛中扮演着重要的角色,这可能会限制其在治疗中枢神经系统相关疼痛方面的药效。从这个角度上说,抗体疗法主要针对外周疼痛靶点。在临床应用上,单抗与中枢渗透的小分子药物联合疗法比单一疗法更加有效。综上所述,抗体药物的发展对解决患者疼痛问题提供了一种新型治疗方案,为广大患者带来福音。

