靶向多次跨膜蛋白的抗体药物研究进展
丁燕超,曾子颜,郑培源,霍苑桐,杜娟娟
(清华大学药学院 生命有机磷化学教育部重点实验室,北京 100084)
作为细胞与外界环境交流的门户,细胞表面膜蛋白在维持细胞结构、促进细胞通讯、调节细胞内外分子的运输等方面发挥重要功能[1]。同时,它们的功能与诸多疾病相关,如癌症、呼吸系统疾病、代谢疾病和自身免疫疾病等,约占可成药蛋白质组的30%[2]。其中,多次跨膜蛋白(multipass membrane protein,MMP)是一类包含2个或多个跨膜结构域的蛋白,是重要的药物靶点。MMP主要类型包括G蛋白偶联受体(G protein-coupled receptor,GPCR)[3]、离子通道(ion channel)[4]和转运蛋白(transporter)[5]等,该类蛋白在细胞的跨膜信号传导、物质跨膜运输、能量利用、免疫识别等方面都起到至关重要的作用。
GPCR,又称7次跨膜受体,由胞外氨基末端、胞内羧基末端和7段α-螺旋跨膜结构域组成。该类受体蛋白作为信号转换器将细胞外刺激(激素、神经递质、离子等)传导到细胞内,与胞内效应蛋白结合后介导一系列生理或病理反应,对人类正常生理过程和疾病的发生至关重要[6]。基于已有的数据分析表明,已批准上市的药物中超40%的药物靶向该类受体,涉及免疫系统、中枢神经系统、呼吸系统、胃肠道系统、心血管、视网膜等器官和组织[7]。针对该类靶点,已批准上市的药物类型主要包括小分子、天然产物、多肽、抗体等,其中小分子类药物约占92%,蛋白类药物约占2%。
离子通道是一种成孔跨膜蛋白,是继GPCR之后用于药物发现的第2大类膜蛋白[8]。离子通道是在磷脂双分子层中具有高度选择性的亲水性孔道,通过响应膜电位或特定化学物质等信号,选择性地控制特定离子透过磷脂双分子层。离子通道的生物学功能包括建立静息膜电位、形成动作电位等电信号、调节细胞体积等,按照其激活机制的不同可分为电压门控、配体门控、机械门控等类型[9]。离子通道目前是治疗2型糖尿病、高血压、癫痫、心律失常和焦虑等疾病的重要药物靶点。尽管离子通道是许多疾病的诱因,但批准的药物仅适用于离子通道类蛋白的一小部分类型(约8%)[10]。迄今为止,大多数离子通道药物开发都集中在小分子和多肽类调节剂,多是在缺乏结构和功能信息情况下的偶然发现。许多离子通道调节剂的发现源于对天然物质的研究,例如来自植物和有毒动物的毒素[11]。尽管早期的离子通道调节剂研发取得了成功,自20世纪90年代以来小分子/化合物文库的筛选工具也取得重大进展,但近年来针对离子通道的创新药研究进展却较为缓慢,自2012年以来,美国食品药品监督管理局(FDA)批准的靶向新靶点的离子通道药物仅有2个(即ivacaftor和crofelemer)。
转运蛋白帮助离子和生物分子跨越磷脂双分子层进行运输[12]。转运体可分为2大类:溶质载体转运体(solute carrier,SLC)和ATP结合盒转运体(ATP binding cassette,ABC)。该类蛋白对人类的多种生理过程至关重要,主要涉及营养吸收、离子稳态、药物外排等。SLC转运体是治疗抑郁症和糖尿病的靶点[13]。ABC转运体与药物耐药有密切的关系,可能成为克服耐药的潜在靶点[14]。然而,针对转运蛋白的功能和药物的研究仍然较少,难以充分开发这些蛋白作为药物靶点的潜力。
目前针对MMP的药物开发主要以小分子药物和多肽药物为主。MMP中存在的配体结合口袋为小分子/多肽药物设计提供了独特的机会。例如,GPCR的天然配体的结合口袋,即正构位点,可以被多种合成配体所结合,为小分子/多肽药物调控靶点功能提供了直接的途径[15-16]。同时,GPCR中也存在多个别构位点,为小分子药物提供了额外的潜在调控机制[17-18]。在离子通道中,孔道区、电压感受域和配体结合区中均存在可能结合的口袋[19-21]。转运蛋白的正构位点是其转运底物的结合区域,是竞争性功能调控的有效结合口袋[22-23]。另外,转运蛋白中也存在别构位点,可以调控其结构和功能[24-25]。基于小分子与这些口袋的结合,科学家们设计出多种针对MMP的小分子药物,在肿瘤、神经系统疾病、炎症等疾病治疗中起到重要的作用。尽管小分子药物在这类靶点的药物开发中取得了长足的进展,但选择性和成药性的潜在问题致使了小分子/多肽新药发现的成功率低。目前,许多MMP靶点尚无针对性小分子/多肽药物,小分子/多肽药物尚不能完全满足针对MMP靶点的药物开发。
在过去的30年中,单克隆抗体(monoclonal antibody,mAb)已经彻底改变了许多疾病的治疗,并显著提升了医学的精准度[26]。然而,目前获批的抗体药物的靶标仍然主要局限于分泌蛋白和具有较大胞外域的单次跨膜蛋白[2]。近年来,越来越多的研究者开始关注MMP靶点的抗体研发。然而,针对MMP的抗体药物研发仍然十分具有挑战性。因此,探索合适的药物研发策略对于解决此类问题具有重要的临床意义。本文概述了靶向MMP的抗体类药物研发面临的挑战及解决办法,并对近年来MMP的抗体类药物的研究进展进行简要总结。
1 多次跨膜蛋白药物研发的挑战
长期以来,MMP被认为是具有挑战性的抗体药物靶点。面向MMP的抗体开发主要面临如下挑战:MMP自身结构的特殊性使其胞外抗原表位有限,抗原制备难度较大,在高通量筛选时难以保证高特异性[27];部分MMP缺乏关键的晶体结构信息,使得基于结构的药物开发面临挑战;MMP多以家族形式存在,具有不同的亚型和不同的构象/状态,因此在实现亚型、构象/状态选择性上难度较大[28]。此外,抗体的结合亲和力并不完全等同于其功能性,部分抗体可与抗原结合但不影响受体功能[29]。下面将针对MMP抗体开发中面临的主要挑战进行讨论。
1.1 抗原表位有限
很多MMP的结构具有如下特点:蛋白大部分嵌入细胞膜中,导致细胞外抗原表位可及性较低;因此,高特异性抗体类药物的获取有一定难度。例如,对于许多电压门控离子通道(voltage-gated ion channel,VGIC)以及A类GPCR,mAb最有可能结合的细胞外环很短并且包含很少的潜在表位(见图1)[30]。此外,这些外环在氨基酸序列上往往存在物种间的保守性,在把免疫哺乳动物作为宿主时难以产生高效的免疫反应[31]。
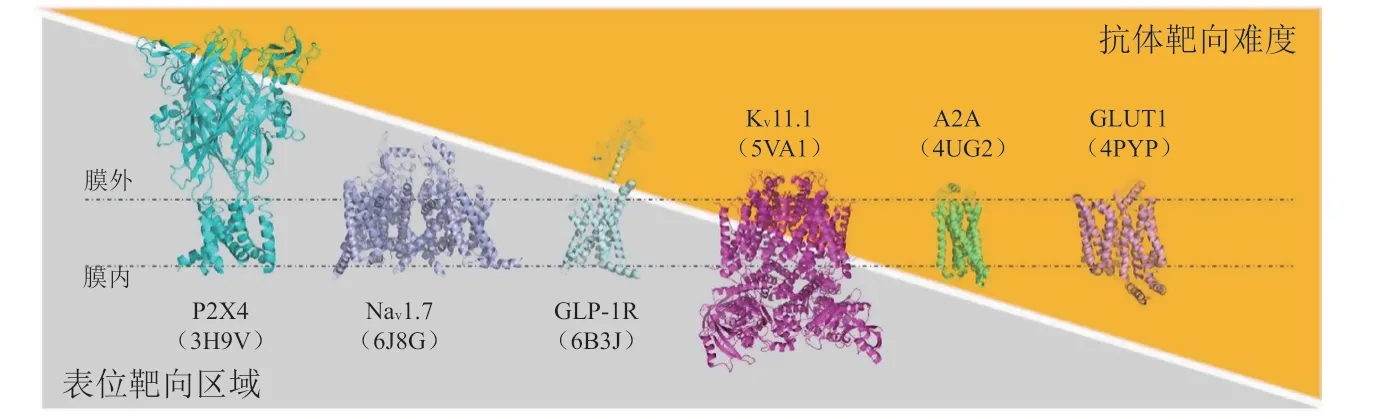
图1 膜蛋白的胞外域的大小和抗体发现难度的关系示意图Figure 1 The correlation between extracellular domain of membrane proteins and the difficulty of discovering functional antibodies
纳米抗体(nanobody,Nb)由于其具有更长的互补决定区3(complementarity-determining region 3,CDR3),可以结合MMP表面的凹形口袋,较之于传统的mAb,可以与MMP形成更强的相互作用[32]。同时,由于其尺寸小、结构简单、稳定性高,Nb具有克服传统mAb的其他局限性的潜力。例如,较小尺寸的Nb可以改善组织渗透性,可以穿透传统mAb无法穿透的肿瘤,能够在靶标附近得到更高的富集,实现更特异和更有效的药物输送[33]。因此,Nb也是针对MMP抗体研发中的一个具有前景的领域。
1.2 抗原制备难度大
抗原制备是开发靶向MMP的抗体类药物的首要前提。理想状态下,靶抗原需要包含与抗体识别相关的全部表位;即使不需要完整的抗原分子,但其关键表位的相关区域应是不可或缺的,同时还要尽可能地保留目的抗原蛋白的构象和生物活性等特性。但是,MMP抗原制备难度较大,存在诸多技术挑战。首先,由于MMP自身结构中包含多个跨膜结构域,需要磷脂双层膜或者其他去垢剂的存在以维持稳定性,加之自然条件下MMP表达量的限制,重组生产足够量的全长蛋白用于药物研发具有挑战性[34-36]。同时,虽然磷脂双层膜或者其他去垢剂可以保持MMP的结构,但在免疫动物或体外筛选的过程中,MMP仍可能失活,为抗体筛选增加了挑战[37]。同时,MMP的异源表达需要寻求最佳表达系统来改善其低丰度表达水平,在一定程度上增加了药物研发成本[38]。
虽然部分抗原制备方法具有一定局限性,但为了兼顾抗原表位结构的准确性以及制备的简便性,目前经常采取的抗原制备方法主要包括体外合成多肽、过表达目的MMP细胞株、体外纯化抗原等[34,39]。体外合成的多肽通常为较简单的线性或环状结构,虽然难以完全模拟复杂膜蛋白的自然构象,可以呈现的表位数量也非常有限,但其合成工艺简单、易于大量生产,可以部分模拟蛋白的天然构象,仍然是目前对于MMP抗体开发使用最广泛的方法之一[40]。
以过表达目的靶蛋白的完整细胞作为抗原,能够更好地保持抗原的三维结构,并且具备必要的翻译后修饰[41]。然而,蛋白的糖基化受细胞的影响,全细胞过表达抗原中的糖基化与天然条件下往往存在差异。同时,过表达抗原给细胞带来压力,可能导致其三维结构与天然构象不同。最后,全细胞抗原的免疫也会产生针对细胞上其他蛋白的抗体,需要进行大量的负向筛选来获得目标抗原的特异性抗体。
体外纯化的全长抗原是较为理想的抗原种类,其关键在于如何引入磷脂双分子层维持抗原稳定性,确保纯化后的抗原能够保持天然构象。目前,比较成熟的MMP纯化方法涉及纳米盘、病毒样颗粒(virus-like particle,VLP)等。纳米盘技术平台替代了传统的去垢剂,利用由膜骨架蛋白和磷脂分子构成磷脂双分子层类膜结构,将MMP整合到该结构中,最大限度地维持其天然构象及稳定性,保持其生物学活性并有良好的水溶性[42]。VLP技术平台能够将完整天然构象的膜蛋白展示在类病毒颗粒的表面,与纳米盘相比更接近于天然的细胞膜,与过表达细胞系相比,其表面的目标蛋白丰度更高,结合免疫方案的优化能够获得特异性较高的抗体药物[43]。此外,还可以在宿主体内注射编码抗原蛋白的DNA或mRNA,使宿主细胞表达产生抗原,并进一步促进宿主产生特异性的抗体[44-45]。
1.3 靶点的动态构象致使构象特异性的抗体筛选困难
MMP在行使生物学功能时常处于多种构象动态变化的过程中,与不同构象结合的抗体也往往具有不同的调控功能。例如,GPCR跨细胞膜传递信号的能力取决于其跨膜螺旋、细胞外环和细胞内环的构象重排。GPCR激活后将信号传递到细胞内并招募下游效应蛋白,包括异源三聚体G蛋白(例如Gs、Gi/o、Gq、G12)和β-抑制蛋白(β-arrestin)等,以介导不同的生理效应[15]。针对于异源三聚体G蛋白通路,每个Gα亚基能独立发出信号,而Gβ和Gγ亚基作为Gβγ异二聚体发挥作用;β-arrestin既可作为负性调节蛋白终止G蛋白信号传导并导致受体脱敏,也可作为独立的信号蛋白发挥信号传导作用。传统的配体分子与内源性配体结合于相同的受体位点——正构位点,分别均匀激活或抑制受体信号传导途径。这种机制存在固有的缺点,信号通路的统一激活和内源性配体节律性调节的破坏导致潜在的在靶副作用(on-target side effects),而高度保守的正构位点使其难以实现受体亚型选择性,从而导致脱靶副作用(off-target side effects)[46]。随着对GPCR研究的深入,发现在信号传导过程中GPCR与潜在效应蛋白进行优先偶联,从而激活该类受体介导的完整信号库中的通路子集,实现信号的偏向性激活[47]。GPCR偏向性激动的研究是一个相对较新的领域,它正在改变GPCR信号传导的概念化方式。发挥信号偏向性传导的配体多结合在正构位点之外的变构位点,靶向该位点的变构调节药物能够将信号从变构位点传递到正构位点和/或直接传递到胞内效应蛋白,以调节受体活性[48]。但很多GPCR靶点缺乏变构位点的位置和结构信息,使变构调节剂的开发受限。
离子通道和转运蛋白也存在动态构象,与特定构象的偏向性结合可能会影响药物的活性。离子通道在其门控周期中经历关闭、打开和失活等多个状态。通常认为,对于电压门控钠离子通道阻断剂,最理想的目标状态为打开或失活状态,而对于电压门控钾离子通道激动剂,理想的目标状态则为关闭状态[49]。然而,也有观点认为非状态选择性的药物可能具有更优的疗效[50-51]。在针对离子通道进行药物筛选时,如果神经元离子通道在HEK293或CHO细胞中表达,它们的电压感应域(voltage-sensing domain,VSD)暴露于相对去极化的静息膜电位(约-40 mV),而不是神经元相对超极化的静息膜电位(约-70 mV)[49]。这意味着,在过表达细胞系上,通道主要处于开放或失活状态,这使得针对关闭状态的离子通道进行药物开发变得更有挑战性。转运蛋白的主要构象包括外向开口构象和内向开口构象。长期以来,对于小分子调节剂设计,人们认为最佳的转运体构象是外向开口构象,例如血清素转运体(serotonin transporter,SERT)——依地普仑(escitalopram)复合体中SERT的构象[52-53]。最近,也有针对内向开口构象的小分子抑制剂被开发出来[54-57]。针对转运蛋白的抗体开发也可以获得不同的构象选择性的抗体[58],为转运蛋白的新药开发提供了新的思路。
2 抗体类药物研究进展
近年来,针对MMP诸多研究机构开展了抗体类药物的研究,并发展出mAb、双特异性抗体(bispecific Antibody,bsAb)、Nb、抗体偶联药物(antibody-drug conjugate,ADC)等多个种类的靶向MMP的抗体类药物(或候选物)。下面我们将分别针对GPCR、离子通道和转运蛋白这3个类别的MMP简述近年来针对这些靶点的抗体类药物的研究进展。
2.1 针对GPCR的抗体类药物
2.1.1 针对GPCR的单克隆抗体研发进展对于靶向GPCR小分子药物而言,获得优异的靶点选择性是该类药物开发的难题。相对地,mAb具有高度特异性,有望减轻脱靶效应提高安全性。除此之外,mAb还具有潜在的优势,包括:1)限制性的中枢神经系统(central nervous system,CNS)渗透(多针对外周靶点而言);2)患者的药代动力学差异性较低;3)具有较长的作用持续时间导致用药频次减少,增加患者的用药依从性[59-61]。针对Fc结构域可进行蛋白质工程改造,可根据自身需要消除或增强抗体介导的效应功能,例如抗体依赖性细胞介导的细胞毒性(antibody-dependent cellmediated cytotoxicity,ADCC)、补体介导的细胞毒性(complement-dependent cytotoxicity,CDC)或抗体依赖性细胞介导的吞噬作用(antibody-dependent cellular phagocytosis,ADCP)[62]。通过针对特定构象进行筛选,也有可能产生识别GPCR不同构象状态的mAb。此外,通过完善的先导mAb方法可以进一步增强其针对靶标的亲和力和效力。
尽管mAb具有诸多优势,但从严格意义上讲并未有一款对于GPCR功能有调控作用的mAb药物上市。目前获批上市的靶向降钙素基因相关肽(calcitonin gene-related peptide,CGRP)的mAb药物eptinezumab、galcanezumab和fremanezumab并没有改变其受体的功能,而是通过阻断CGRP与细胞表面的受体结合发挥作用治疗偏头痛[63];此外,临床应用的efalizumab等通过与细胞表面受体相互结合,产生占位效应,阻止内源性配体与受体结合发挥治疗作用。处于临床试验阶段的mAb药物目前已超过30款(见表1),其中有3款已被终止研发;另外,有近50款靶向MMP的mAb处于药物发现及临床前阶段。

表1 部分靶向GPCR的单克隆抗体药物*Table 1 Selected monoclonal antibodies targeting GPCR

续表1
2.1.2 针对GPCR的双(多)特异性抗体研发进展得益于mAb生产和重组技术的改进,推动了抗体新形式——bsAb的发展。bsAb可以用于识别2种不同表位或抗原,其有多种形式存在,从仅由2个相连的抗原结合片段组成的相对较小的蛋白质到带有附加结构域的大型免疫球蛋白G(IgG)样分子。bsAb的主要作用机制包括:1)招募T细胞或自然杀伤细胞,与其进行交联,导致免疫细胞重定向至靶细胞(多指肿瘤细胞),增强其对靶细胞的杀伤力;2)同时阻断致病进程中2种不同的信号传导通路,从而发挥独特的或叠加的功能,影响靶细胞的生长增殖、存活及免疫逃逸等;3)同时靶向细胞表面不同的抗原或表位,增强其与靶细胞的特异性结合并直接杀伤靶细胞[64]。bsAb的作用机制提高了抗体的选择性和亲合力,改善了药物的安全性和有效性,与2种mAb连用相比减少了开发成本。bsAb与靶抗原结合既可以是按照时间上的先后顺序进行,也可以同时发生,允许bsAb以不同的作用机制发挥多种特定的生物学效应。
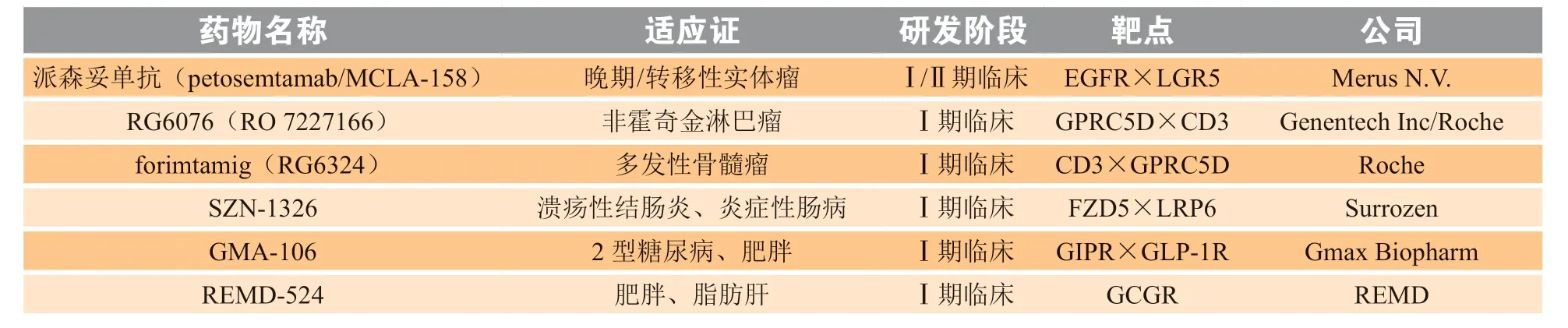
截至目前,仅有强生研发的一款靶向CD3×G蛋白偶联受体5家族亚型D(GPRC5D)的双抗——talquetamab(TALVEY™)于2023年8月获FDA加速批准上市,成为全球范围内首个获批上市的靶向GPRC5D的“现货型”双特异性T细胞结合抗体,能够激活带有CD3受体的T细胞,并诱导其杀伤GPRC5D+的MM细胞,用于治疗复发或难治性MM成人患者[65]。2023年10月12日,强生递交的talquetamab新临床适应证试验获国内默示许可。此外,另有2款bsAb——gefurulimab和tebotelimab进入Ⅲ期临床试验,7款进入Ⅰ/Ⅱ期临床试验(见表2),13款处于药物发现阶段,其中包括2款多特异性抗体(MBS314[66]和SCR8572[67])。

表2 部分靶向GPCR的双(多)特异性抗体*Table 2 Selected bispecific/multispecific antibodies targeting GPCRs
续表2
2.1.3 针对GPCR的Nb研发进展尽管mAb在临床上成功用于肿瘤治疗,但由于肿瘤渗透性等问题限制其在治疗开发中的应用。Nb作为一种单域抗体,在具有强大的抗原靶向和结合能力同时,更容易渗透到组织中,适合靶向实体瘤的治疗;Nb还可以有效地穿过血脑屏障,为脑部疾病的治疗提供了一种新的方法;此外,Nb因其尺寸小可以更方便地设计成多价/多特异性Nb,以获得更多用于治疗的功能。Nb在保持对抗原的高结合亲和力(达到皮摩尔级别)的同时,其较长且灵活的CDR3允许其与目标抗原的裂口和空腔结合,可以识别mAb难以识别的隐匿表位。Nb的另一个重要优势是易于生产制造,其制造成本较mAb显著降低。Nb只有一个链内二硫键的结构域,与传统mAb相比其折叠结构相对稳定;由于缺乏轻链以及重链,骨架中疏水性残基被亲水性残基取代,Nb表现出比mAb更高的溶解度;这些特性允许对Nb进行比其他类型抗体更严苛的化学修饰。Nb缺乏可触发与免疫原性相关的Fc结构域,具有低免疫原性[68]。此外,Nb的人源化为长期治疗提供了安全的选择。因此,Nb在对于多种疾病的治疗研究中受到广泛关注。
Nb作为抗原相关识别和调节的下一代抗体衍生物,已经开发出许多Nb并在不同阶段的癌症治疗临床试验中进行评估。针对GPCR靶点,仅有2款Nb进入临床试验,分别是靶向CXC型趋化因子受体3(C-X-C chemokine receptor type 3,CXCR3)的BI655088和靶向CXCR4的AD-114/214。另有一款靶向CXCR4的Nb(ALX-0651)因管线优先级问题已被放弃研发。目前,共有8款靶向GPCR的Nb处于临床前/药物发现阶段(见表3)。
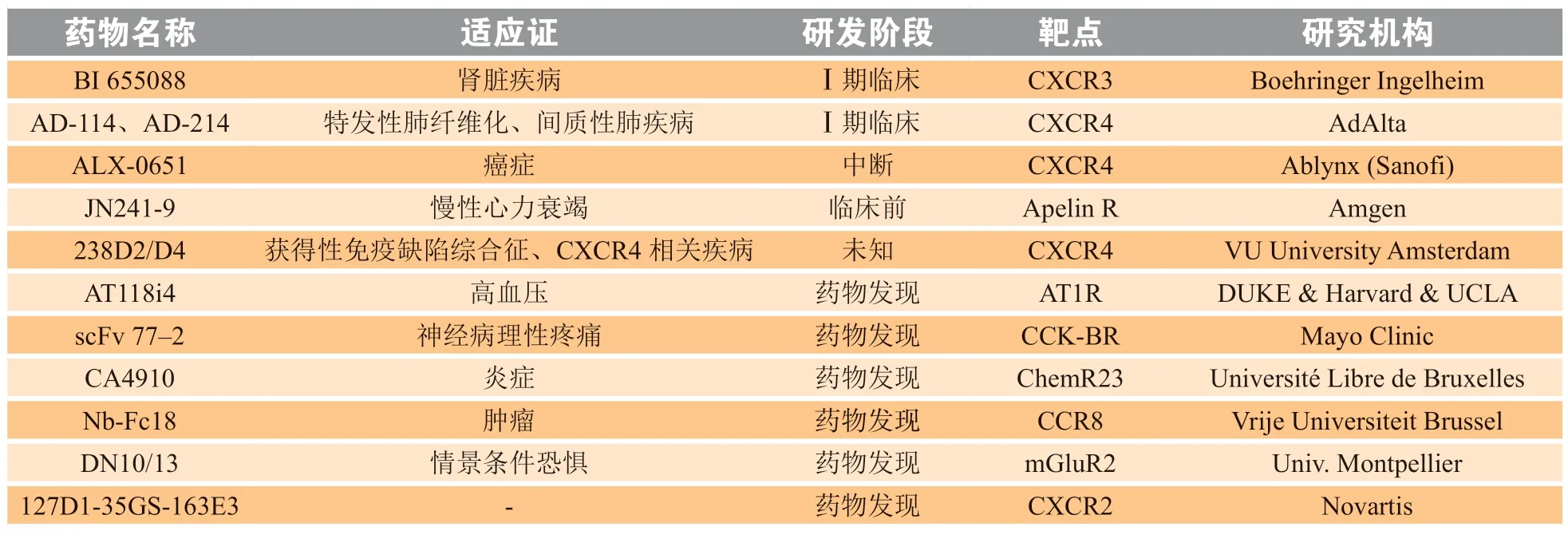
表3 部分靶向GPCR的在研纳米抗体*Table 3 Selected investigational nanobodies targeting GPCRs
2.1.4 其他针对GPCR的抗体类药物研发进展随着生物技术的不断革新,各种偶联药物(X-drug conjugates,XDC)不断涌现,形成了万物皆可偶联的药物发展态势。针对GPCR药物研发领域,以ADC、抗体多肽偶联物(antibody-peptide conjugation,APC)的发展最为迅速。ADC通过化学连接子将细胞毒性药物和mAb以合适的方法进行共价连接,偶联物既结合了mAb高度特异性的靶向能力,又含有细胞毒性药物的强效杀伤作用,实现精准高效消灭癌细胞的目的,已成为抗癌药物研发的热点之一[69]。多年来,对GPCR功能、靶向治疗的持续研究意味着已经有大量信息可以为靶向GPCR的ADC合理设计提供基础。得益于抗体疗法的蓬勃发展与GPCR结构的广泛解析,表明GPCR可作为ADC开发的理想抗原。目前,超过20款靶向GPCR的ADC处于临床(前)阶段。其中,礼新医药基于自身知识产权LX-ADC™技术平台开发的LM-305已进入Ⅰ/Ⅱ期临床试验(NCT05647512),该款ADC靶向GPRC5D,用于MM的治疗[70]。此外,礼新医药就该款ADC于2023年5月12日和阿斯利康达成全球独家授权协议,本次交易总值达6亿美元。抗体与多肽进行位点特异性偶联产生的APC多靶向于胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R),发挥激动剂活性,主要用于2型糖尿病、肥胖的治疗[71]。此外,针对GPCR的嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)疗法[72]、基于Nb的溶瘤病毒治疗方法也在进一步的开发当中[73]。
2.2 针对离子通道的抗体类药物
相比于GPCR,离子通道具有更加复杂的结构,致使其抗体开发更具挑战性[30],目前主要在研抗体如表4所示。唯一一个进入临床试验的针对离子通道的抗体是针对基底细胞癌的抗非功能P2X嘌呤受体7(nonfunctional P2X purinoceptor 7,nfP2X7)受体抑制剂BIL-010t[74],是一种多克隆抗体。P2X嘌呤受体7(P2X purinoceptor 7,P2X7)是一个胞外域较大的离子通道,较容易获得针对其的抗体。该多克隆抗体在2016年完成Ⅰ期临床试验后[74],并未启动Ⅱ期临床试验。BIL-010t的研发机构(Bioceptre International)进一步从多克隆抗体中筛选了1个mAb BIL-03s[75],但其研究目前仍然停留在临床前阶段。

表4 部分靶向离子通道的在研抗体类药物*Table 4 Selected investigational antibody therapeutics targeting ion channels
VGSC也是抗体药物开发的热门靶点,其中NaV1.7、NaV1.8和NaV1.9 被认为是镇痛的靶点,然而,VGSC具有较少的胞外表位,且全长蛋白表达较为困难,为其抗体开发带来了挑战。目前,有多家公司针对这几个离子通道展开了抗体的开发,其中Ucb Pharma、Regeneron公司采用传统的多肽免疫的方法获得的mAb亲和力中等,但是未在临床前试验展示出镇痛效果[76-77]。Shionogi公司用类似的方法获得的1株mAb则在动物模型中展示出了一定的阵痛效果[78],说明采用多肽免疫的方法,针对这类离子通道的抗体筛选颇具挑战,但是通过选择合适的抗原肽仍然可以获得较好的抗体。Oblique Therapeutics和Visterra等公司聚焦于如何选择更好的抗原表位用于离子通道的抗体发现[79]。另一方面,Abilita Therapeutics、Tetragenetics和Integral Molecular等多家公司采用新的全长膜蛋白表达技术[80-81],来获取针对VGSC的mAb。这些新技术有望解决离子通道的抗体开发难点,但这些抗体仍然处于早期发现阶段尚未有其药效研究结果公布。
除了上述2类靶点,NMDAR[82]、钙释放激活钙调节因子1(calcium release-activated calcium channel protein 1,CRCM1,也称ORAI1)[83]、TRPM8[84]和Kv1.3[85],也被选为靶点进行药物的开发,用以治疗肿瘤、疼痛以及自身免疫系统疾病。针对这些离子通道的抗体开发,为后续同类的研究提供了重要的参考价值。
2.3 针对转运蛋白的抗体类药物
针对转运蛋白的抗体发现主要集中在如下几类靶点(见表5)。第1类是在肿瘤细胞中高表达的转运蛋白。例如,2b型钠依赖性磷酸盐转运体(sodium-dependent phosphate transport protein 2B,NaPi-2b,又称SLC34A2)在非小细胞肺癌和卵巢癌中有异常表达,还与肺泡微石症、低磷血症、不孕症、睾丸微石症和其他恶性肿瘤(包括甲状腺癌、乳腺癌等)有关[86-87]。 目前有多个在研项目针对这一靶点开发治疗性的抗体、ADC或者抗体-核素偶联物,其主要作用机制是通过靶向表达NaPi-2b的肿瘤细胞,并杀死这些细胞。目前进展较快的ADC药物 Upifitamab Rilsodotin已进入Ⅲ期临床试验[88]。锌转运蛋白(zinc transporter,ZIP6,又称SLC39A6或LIV-1)在胰腺癌、乳腺癌、肝癌、前列腺癌和宫颈癌等肿瘤细胞中存在着过表达,从而成为对于抗体和ADC药物的潜在候选靶点[89]。目前,默克、西雅图基因等多家公司均致力于针对LIV-1的ADC药物研发,其中,Ladiratuzumab vedotin已经启动Ⅱ期临床试验。胆碱转运蛋白样蛋白4(choline transporter-like protein 4,CTL4)在多种癌症中上调,也被作为ADC的靶点进行药物研发,其中ASG-5ME在完成了Ⅰ期临床试验后由于其较窄的治疗窗导致没有进入后续的临床试验[90]。在这些在研抗体类药物中,抗体主要功能不是调控靶点功能,而是识别肿瘤细胞,并通过招募免疫细胞或者激活补体系统来介导针对肿瘤的杀伤。

表5 部分靶向转运蛋白的在研抗体类药物*Table 5 Selected investigational antibodies targeting transporters
谷氨酰胺转运蛋白在多种肿瘤中高表达,并在肿瘤生长中起着关键作用。近年来,谷氨酰胺转运蛋白的研究越来越受到重视,其中,多个研究团队针对丙氨酸半胱氨酸丝氨酸转运蛋白2(alanine-serinecysteine transporter 2,ASCT2,也称SLC1A5)、由SLC7A5和SLC3A2二聚组成的L型氨基酸转运蛋白1(L-type amino acid transporter 1,LAT1)和胱氨酸-谷氨酸交换转运蛋白(cystine/glutamate antiporter,xCT,也称SLC7A11)开发了mAb或ADC。 针对这些氨基酸转运蛋白的抗体,往往可以抑制其转运功能,从而抑制肿瘤的生长;同时这些在研抗体或者ADC可以进一步的结合抗体介导的ADCC作用,或者通过递送细胞毒性的小分子载荷,从而实现对肿瘤细胞更有效的杀伤。
3E10 是一个从MRL/lpr红斑狼疮小鼠模型中分离出来的抗DNA抗体,其可以在相对无毒的条件下进入细胞核[91],因此可以用于胞内大分子递送。后期研究证明该抗体通过与细胞膜上的平衡核苷转运蛋白2(equilibrative nucleoside transporter 2,ENT2)结合进入细胞[92],并可以通过该受体跨越血脑屏障进入脑部[93]。3E10的人源化抗体与视黄酸诱导基因蛋白1(retinoic acid-inducible 1,RIG 1)激动剂的偶联物正在多个肿瘤中被评估其治疗潜力[94]。
葡萄糖转运蛋白(glucose transporter member,GLUT)负责人体组织细胞的葡萄糖摄取,GLUT1,也称SLC2A1,被认为是肿瘤、糖尿病和心肌梗死等疾病的治疗靶点[95-99]。Avaxia Biologics公司开发了针对GLUT1的多克隆抗体,并利用自然界中在消化道稳定的牛抗体形式,以期实现口服给药。同时,Immix Biopharma公司利用GLUT1在激活的免疫细胞上表达量上调这一现象,使用抗GLUT1的抗体进行药物的递送。针对这一家族中的另一个转运蛋白GLUT4,来自Integral Molecular的Tucker等[100]采用VLP作为膜蛋白表达的载体,并采用噬菌体展示技术筛选获得了构象特异性的mAb,证明了mAb稳定特定转运蛋白构象的可能性。
3 结语与展望
MMP作为潜在的治疗靶点,对于多种疾病的治疗具有重要的价值。近年来,针对MMP进行抗体药物研发的不断探索为该领域带来了长足的进展。在临床研究方面,针对GPCRs的mAbs的应用得到了极大的拓展。这些抗体药物在肿瘤学、免疫学等领域展现出了巨大的治疗潜力。同时,bsAb和抗体药物复合物等下一代抗体药物方法的出现,进一步丰富了对GPCR靶点的应用。 针对离子通道和转运蛋白的抗体药物研究相对滞后,目前,针对这2类膜蛋白的抗体药物研发仍然主要停留在临床前的阶段,但也在Nav1.7、NaPi-2b、LIV-1等靶点上显示出了潜力。
虽然这一领域近年来已经取得了可喜的进展,目前仍存在许多技术障碍需要克服。例如,胞外表位的可及性差、稳定的全长蛋白制备困难、蛋白结构动态性高、跨越血脑屏障能力差等。但是,随着技术的不断进步,已经出现一些创新的方法来解决这些问题。例如,Nb的伸展的CDR区域给触及凹形的抗原表位提供了可能。使用纳米盘、类病毒纳米颗粒等作为载体稳定全长MMP,为解决MMP稳定性问题提供了新的思路,降低针对MMP抗体开发的难度。采用蛋白工程使抗体在消化道稳定,利用脑血管内皮细胞表面转铁蛋白受体等受体介导的转胞吞作用设计的脑部递送系统,也为针对中枢神经系统的抗体药物和口服抗体带来新的契机。
近年来,随着科学技术研究的深入,我们对膜蛋白的结构和生物功能的理解取得了显著进展,这为针对MMP的抗体设计提供了新的支持。针对MMP的结构生物学研究为靶点表面可及表位的鉴定、蛋白构象和功能之间的关联提供了重要的参考信息,也为阐述抗体和靶点的相互作用,以及后续的抗体优化提供了强大的工具。通过对MMP生物学的研究,我们可以更好地理解其在疾病中的作用和功能。这将为我们发现和开发新的治疗策略提供重要的指导。
近年来,人工智能的发展对于MMP抗体设计起到了重要的推动作用。随着深度学习、机器学习等技术的不断进步,人工智能已经能够自动化地处理大量数据,并从中提取出有价值的信息。在抗体药物设计中,人工智能可以通过对MMP的结构和功能进行模拟和预测[101],帮助研究者更好地理解这些蛋白质的行为,从而设计出更有效的抗体药物。同时,人工智能可能预测蛋白的动态构象[102],为MMP抗体设计提供了更丰富的结构信息。人工智能的发展还推动了抗体药物的智能化设计和优化。通过深度学习和机器学习等技术,人工智能可以对抗体药物的亲和力、稳定性和免疫原性等进行预测和优化[103-104]。这种方法可以帮助研究者设计出更具有临床应用价值的抗体药物。
综上所述,MMP作为潜在的治疗靶点具有巨大的发展潜力。随着我们对MMP生物学的深入理解、抗体筛选技术的成熟和新兴技术的发展,我们有信心克服目前所面临的技术障碍,开发出更加有效的治疗策略和药物。这些进展将为生物医学领域的发展提供重要的推动力,为人类健康事业做出更大的贡献。

