Y染色体短串联重复序列微流控芯片复合扩增检测体系研究*
王道宇 万 群 庄 斌 赵丽健 韩俊萍 李彩霞
(1)中国人民公安大学侦查学院,北京 100038;2)山东第一医科大学基础医学院,济南 250000;3)北京博奥晶典生物技术有限公司,北京 101111;4)北京市公安局朝阳分局刑事侦查支队,北京 100025;5)公安部鉴定中心,现场物证溯源技术国家工程实验室,北京市现场物证检验工程技术研究中心,北京 100038)
Y染色体作为男性所特有的染色体,其95%的区域为非重组区(non-recombining,NRY),该区域在减数分裂时不能与X染色体发生交换重组[1]。除发生突变外,该区域可完整从父亲遗传至儿子。由于Y染色体遗传特殊性,其在与男性相关的法医鉴定中具有重要作用,如性侵案件中男女混合斑鉴定[2-3]、父系亲缘关系鉴定[4]、大规模灾难受害者身份识别[5]、家系排查[6]、族源推断[7]等法医学应用。法医学常用的Y染色体遗传标记为Y染色体短串联重复序列(Y-chromosomal short tandem repeat,Y-STR),但是目前其检测方法主要依赖传统实验室DNA 检测技术,包括DNA 提取-定量、PCR 扩增、毛细管电泳检测,整个过程耗时耗力,且需要专业人员在专业实验室操作。近年来,基于微流控芯片技术[8-10]的DNA 快速检测仪因具有全自动、高度集成、车载便捷的性能而快速发展并相继上市销售,如RapidHⅠTTM200、RapidHⅠT®ⅠD、ANDETM6C 等,学界对上述仪器及配套试剂开展了大量验证评估[11-14]。上述国外DNA 快检仪配套试剂均为常染色体短串联重复序列(STR)个体识别试剂[15-18],尚未出现集成Y-STR 试剂的芯片卡盒。本项目组前期研发出国产Quick TargSeq 法医DNA 快速检测仪,配套了常染色体STR 个体识别[19]和插入缺失多态性(insertion/deletion polymorphism,DⅠP)[20-21]族群推断两类试剂。Y-STR父系家系排查是目前案件侦查常用手段,为实现Y-STR的快速全集成检测,本研究构建了Y-STR微流控芯片检测试剂,并根据DNA 分析方法科学工作组(SWGDAM)[22]指南对其灵敏度、抗抑制性、成功率和分型准确率、峰高平衡性、精准度和准确度、混合物检测、检材适应性等性能进行验证评估,以期为实践应用提供参考。
1 材料与方法
1.1 实验样本
本研究实验样本包括血卡、口腔拭子、唾液卡、烟蒂、血棉签和布片精斑等样本。131份血卡样本来源于国家科技资源共享服务平台计划项目(YCZYPT[2017]01-3),已通过公安部物证鉴定中心伦理委员会的伦理审查(编号:2017-005);54份口腔拭子样本、1份唾液卡、2份烟蒂、1份血棉签和1份布片精斑取自实验室人员;人类基因组DNA 标准品9948 购自苏州新海生物科技股份有限公司,人类基因组DNA 标准品2800M 购自Promega公司。
1.2 样本采集
54 份口腔拭子样本采集时,实验人员漱口后使用采样拭子在口腔内壁左右刮擦,阴干备用;1份唾液卡样本采集时,取实验人员两颊黏膜擦拭物转移至唾液卡上,阴干备用[21]。
1.3 DNA提取与定量
使 用 QⅠAamp®DNA Mini M48 试 剂 盒(QⅠAGEN公司,德国)提取烟蒂DNA,用于检材适应性研究。将人类基因组DNA 标准品9948(初始浓度10 mg/L)进行梯度稀释,使用QuantifilerTM人类DNA定量试剂盒(Life Technologies公司,美国)进行定量,用于灵敏度验证。
1.4 Quick TargSeq法医DNA快速检测系统检测
Quick TargSeq 法医DNA 快速检测系统的全集成芯片卡盒由DNA提取-扩增芯片和毛细管电泳芯片组成。冻干试剂、电泳缓冲液和电泳凝胶均已预置于芯片卡盒内。全集成检测时,在1.5 ml EP 管中加入200 μl直扩处理液(含80 μl直扩处理液Ⅰ和120 μl 直扩处理液ⅠⅠ,苏州新海生物科技股份有限公司),放入1 根口腔拭子或血卡/唾液卡3 片(φ=2 mm),然后取60 μl 上述混合液(提取的DNA 样本或DNA标准品加去离子水定容至60 μl)加样至芯片样本处理池,全集成芯片卡盒放入快检系统进样仓,点击运行键,仪器自动完成样本裂解、PCR扩增、电泳分离全过程。详细操作步骤参见文献[21]。
1.5 灵敏度研究
利用人类基因组DNA 标准品9948,口腔拭子和血卡三种样本类型进行灵敏度测试。使用去离子水将DNA 标准品9948 进行如下稀释:50、30、16、8、5、2.5、1.5 ng;采集3 名实验室人员口腔拭子,使用取样拭子在测试人员口腔内壁左右刮取1、2、3、4、5、6、7、8、9、10 次,不同次数采集时间隔3 h;选取3份血卡,利用直径2 mm打孔器在待测血卡上采集1、2、3、4、5、6、7、8片。使用全集成芯片卡盒测试,上述每种DNA 含量、取样方式均重复测试3次。
1.6 成功率和分型准确率研究
对115 份血卡和50 份口腔拭子进行全集成检测,统计成功率和分型准确率。以常规PCR-CE平台分型结果作为参考样本分型。成功率是指基因座全部检出的样本占全部测试样本的比率;分型准确率是指分型成功的结果,软件准确分型的等位基因占全部等位基因的比率[23]。
1.7 平衡性研究
选取1.5中全集成检测成功的结果,统计每个基因座的等位基因峰高值,评估同一荧光通道和不同荧光通道之间的平衡性,计算方法参照文献[24-25]。
1.8 精准性和准确性研究
将RTyper Y27 的等位基因分型标准品(allelic ladder)在Quick TargSeq 快检仪上重复电泳10 次,计算各等位基因片段大小的平均值和标准差,以验证体系的精准度(以碱基为单位)。随机选取1.5中全集成检测成功的20 份血卡样本,计算各样本的等位基因片段大小与相应的等位基因分型标准物的差异。选取使用同一批次冻干扩增试剂在同一仪器上检测的6份同一人员口腔拭子样本,计算各样本的等位基因片段大小均值、标准差和变异系数(CV)值[26],以验证体系的批内精密度。选取使用不同批次(3 个批次,每个批次2 份样本)冻干扩增试剂在同一仪器上检测的6份同一人员口腔拭子样本,计算各样本的等位基因片段大小均值、标准差和CV值,以验证体系的批间精密度。
1.9 检材适应性研究
选取口腔拭子、血卡、唾液卡、烟蒂、血棉签和布片精斑(其中烟蒂样本采取先提取DNA 后检测和直接扩增检测两种方式,其余检材采取直接扩增检测方式)等法医常见检材进行全集成检测,验证该体系的检材适应性。
1.10 混合物检测研究
采用DNA标准品9948和2800M,按照19∶1、9∶1、3∶1、1∶1、1∶3、1∶9、1∶19比例进行全集成检测,以验证该体系对混合物的检测性能。
1.11 抗抑制性研究
选取3种常见的PCR抑制剂(腐殖酸、靛蓝和血红蛋白)验证该体系的抗抑制能力。配置不同浓度的抑制剂,使腐殖酸的终浓度为400、300、200、100、50 mg/L,靛蓝的终浓度为100、80、60、40、20 nmol/L,血红蛋白的终浓度为500、400、300、200、100 μmol/L,分别进行全集成检测。
2 结果
2.1 Y-STR基因座选择和微流控芯片扩增体系构建
本研究选取27 个Y-STRs 基因座,其中包含《全国刑侦信息专业应用系统Y-STR DNA数据库建设与管理指南》 规定的20 个核心基因座(GB/T41009-2021),DYS19、DYS385a、DYS385b、DYS389Ⅰ、 DYS389ⅠⅠ、 DYS390、 DYS391、DYS392、 DYS393、 DYS437、 DYS438、DYS439、 DYS448、 DYS456、 DYS458、DYS481、 DYS533、 DYS576、 DYS635、Y-GATA-H4,和该指南推荐的15 个优选基因座中选取7 个单倍型多态性好、个体识别能力强的Y-STR 基因座, DYF387S1a、 DYF387S1b、DYS449、 DYS460、 DYS518、 DYS627、DYS570。上述基因座与进口Y-STR试剂盒兼容。
通过对引物浓度配比、辅料配比、冻干条件等优化,确定了2.5×PCR Mix和5×Primer Mix分别与冻干辅料按照1∶1体积比混合,按照每12 μl点样冻干,采用-50℃ 5 min、-45℃ 240 min、-35℃360 min、-25℃ 240 min、20℃ 360 min 冻干程序获得的冻干小球状态最佳。通过PCR 热循环参数优化确定的最佳PCR 扩增条件为:95℃ 1 min;95℃ 10 s,59℃ 1 min,2℃ 20 s,共28 个循环;60℃ 10 min。综上,最终构建了一套RTyper Y27微流控芯片检测体系,能够获得完整而准确Y-STR分型结果(图1),全集成检测时间约为83 min。

Fig. 1 DNA standard 9948 profile obtained from the RTyper Y27 microfluidic chip rapid detection system
2.2 灵敏度
使用1.5~50 ng DNA标准品9948进行灵敏度测试,统计不同DNA 模板量全集成检测结果的等位基因峰高值和等位基因检出率[21](图2)。结果显示,等位基因峰高值随着DNA模板量增加而增大。当DNA模板量为1.5、2.5、5 ng时,出现不同程度等位基因丢失;当模板量≥8 ng 时,可以获得完整Y-STR 分型结果,等位基因检出率达到100%。因此,本体系对于DNA标准品9948的最低检测限为8 ng。

Fig. 2 Sensitivity study for different input DNA template
使用1~10次擦拭的口腔拭子进行全集成测试,统计不同擦拭次数口腔拭子的等位基因峰高值和等位基因检出率(图3)。结果显示,随着擦拭次数的增加,等位基因峰高值和检出率均逐渐增加。擦拭次数为1~7次时,等位基因峰高值较低,等位基因检出率从63.42%增加到100%,擦拭次数≥7 次时,等位基因检出率均为100%。故口腔拭子的最低擦拭次数为7次。
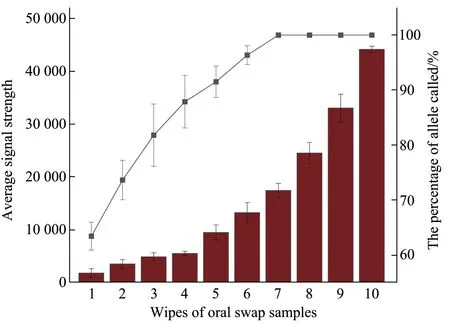
Fig. 3 Sensitivity study for different wipes of buccal swabs
使用1~8片血卡进行灵敏度测试,统计不同血卡片数全集成结果的等位基因峰高值和等位基因检出率(图4)。结果显示,等位基因峰高值随着血卡片数的增加而增加,血卡片数为1 和2 片时,均出现不同程度等位基因丢失,等位基因检出率分别为86.83%和90.94%。血卡片数≥3片时,等位基因检出率可达100%。故本体系对血卡的最低检测片数为3片。
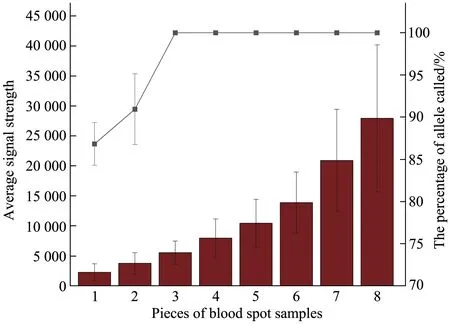
Fig. 4 Sensitivity study for different pieces of dried blood spot samples
2.3 成功率和分型准确率
对115 份血卡和50 份口腔拭子进行全集成检测,统计成功率和分型准确率(表1)。165份样本中6份样本未获得成功分型,151份样本分型成功。其中104份血卡分型成功,成功率达90.43%,分型准确率为99.65%,47 份口腔拭子分型成功,成功率为94.00%,分型准确率为99.92%。利用独立样本t检验对血卡和口腔拭子两种类型样本的分型准确率之间是否存在差异性。结果表明,两者之间未出现显著性差异(P>0.05)(表2)。
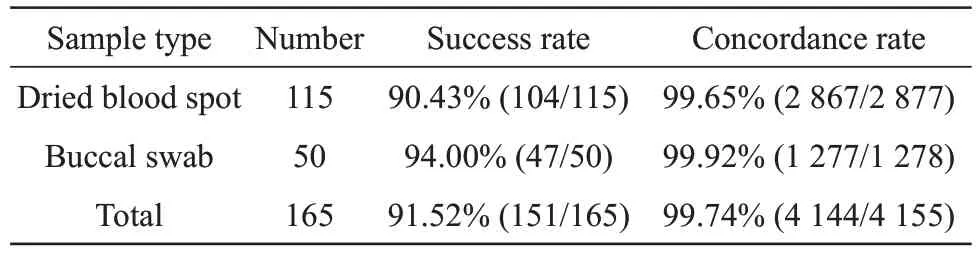
Table 1 The result of success rate and concordance rate

Table 2 The effect of different sample types (blood card /oral swab) on concordance rate
2.4 平衡性
利用2.2中分型成功的70份样本进行荧光通道平衡性分析(表3)。红色荧光通道(ROX 染料标记)峰高比值最高,为91.15%,黄色荧光通道(TAMRA 染料标记)次之,为86.25%,其余两个荧光通道峰高比值分别为74.85%、70.81%,不同荧光通道之间的峰高比值为89.81%。以上结果表明该体系有较好的平衡性。
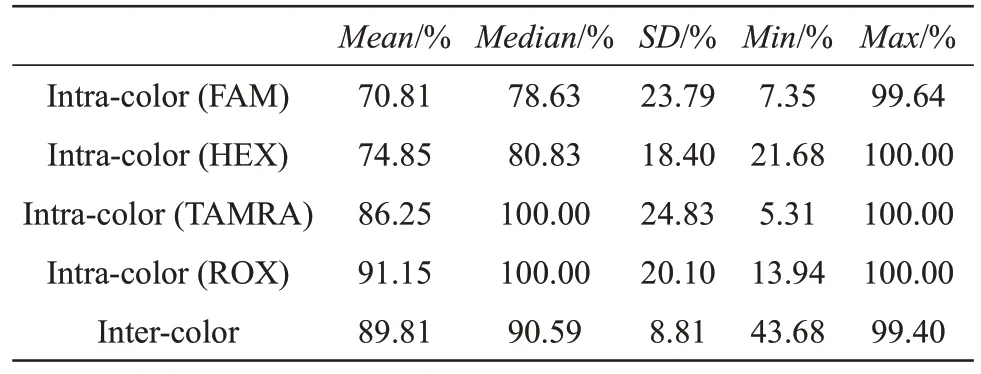
Table 3 Balance within one dye and among different dyes for 151 testing samples
2.5 精准度和准确度
对等位基因分型标准品进行10次全集成检测,统计其各等位基因片段大小的平均值和标准差(图5)。结果表明,各等位基因片段大小的标准差均在0.5 bp 以内。随机选取2.2中分型成功的20 份血卡全集成结果(图6)。计算所有等位基因片段与等位基因标准品对应的片段大小差异均不超过0.5 bp。批内精密度和批间精密度实验结果表明(表4),批内和批间精密度实验中等位基因DYS460的CV值最大,分别为0.48%和0.68%,均小于15%。以上结果表明,该体系有较高的精准度和准确度。
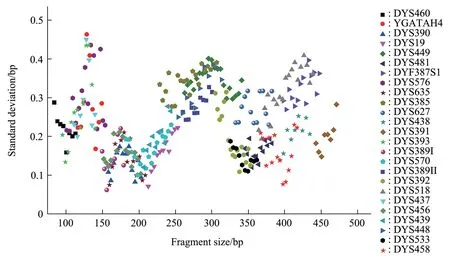
Fig. 5 Standard deviation of sizing precision for each locus in the allelic ladder calculated for 10 runs on Quick TargSeq systems
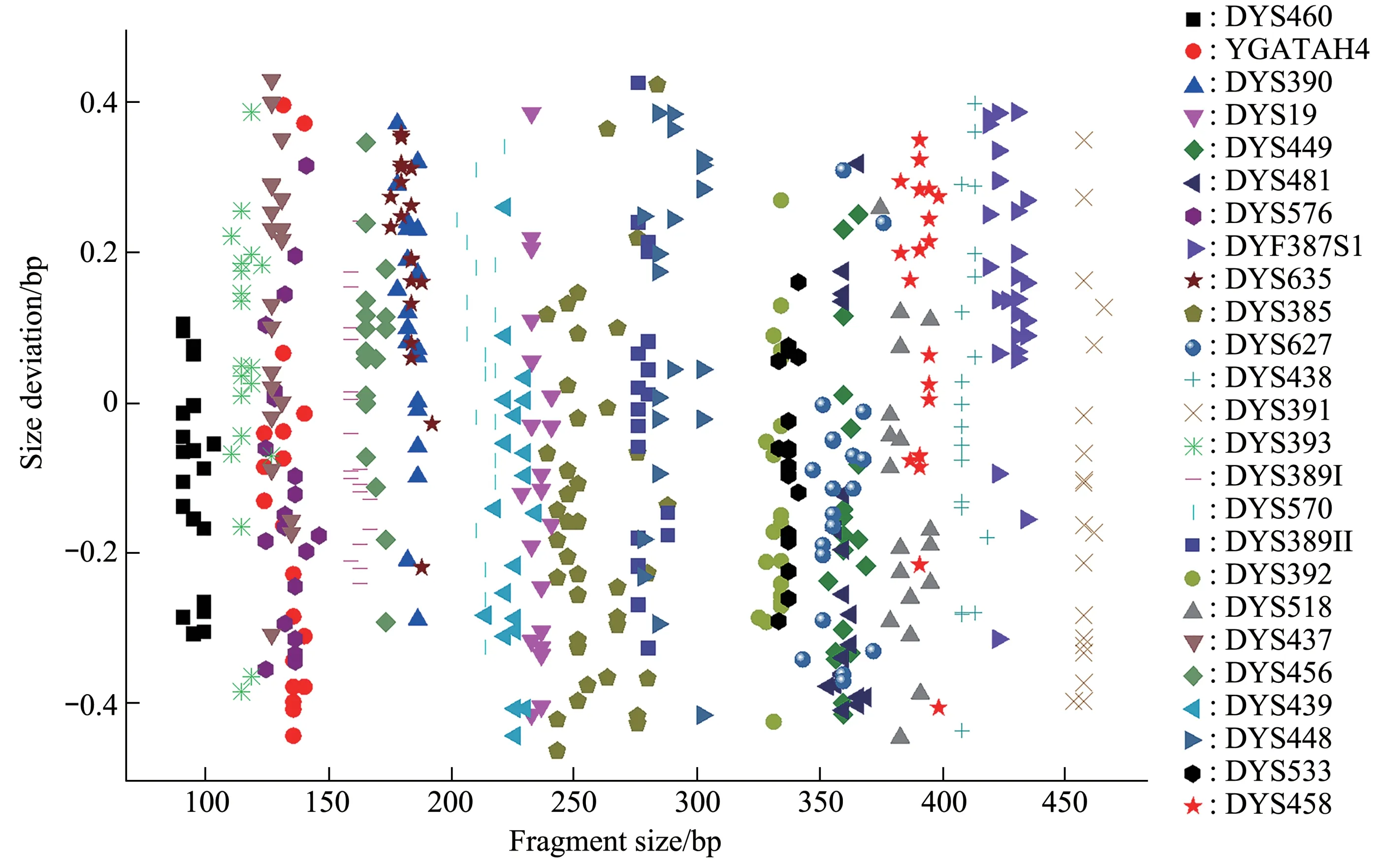
Fig. 6 Size differences between allele and corresponding allele in allelic ladder for 20 testing samples on Quick TargSeq systems
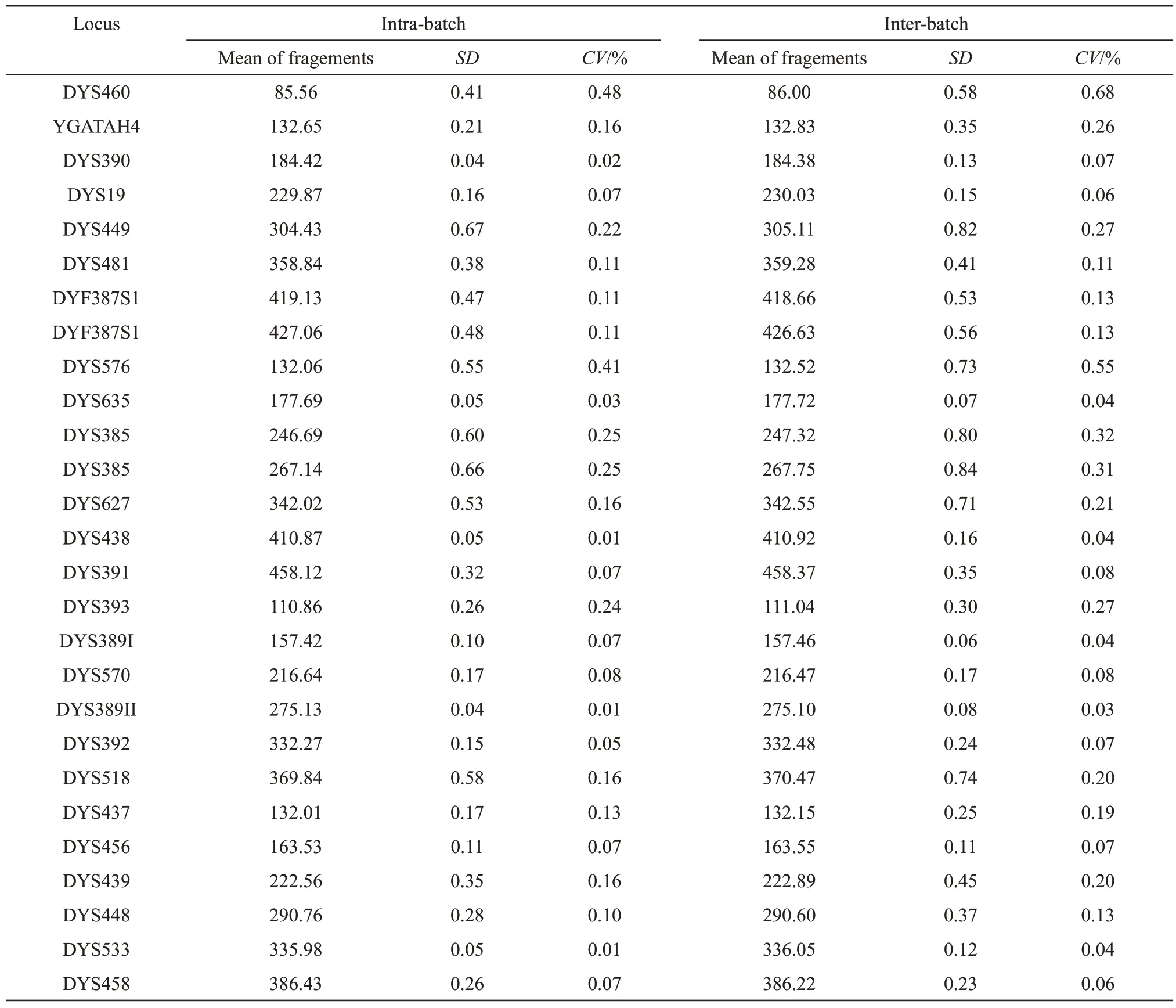
Table 4 The precision of intra and inter batch
2.6 检材适应性
对口腔拭子、血卡、唾液卡、烟蒂(包括使用提取DNA检测和直接样本检测两种方式)、血棉签和布片精斑等法医常见检材进行全集成检测(图7)。结果表明,除直接扩增的烟蒂检材DYS481基因座出现等位基因丢失(图中红框所示),其余检材均获得完整Y-STR分型,说明该体系检材适应性良好。
2.7 混合样本检测性能
将DNA 标准品9948 和2800M 按照19∶1、9∶1、3∶1、1∶1、1∶3、1∶9、1∶19 比例进行全集成检测,统计次要贡献者的等位基因峰高值和等位基因检出率,以验证该体系对混合样本的检测性能(图8)。当9948∶2800M 为19∶1 和1∶19时,出现不同程度等位基因丢失,次要贡献者的等位基因检出率分别为66.67%和67.61%,且等位基因峰值较低,9948∶2800M 为9∶1 和1∶9 时,次要贡献者的等位基因检出率为97.53%和98.76%,而当9948 和2800M 的比例为3∶1、1∶1 和1∶3时,能够检测出所有次要贡献者的等位基因(检出率均为100%)。

Fig. 7 The Y-STR profiles of mock case samples
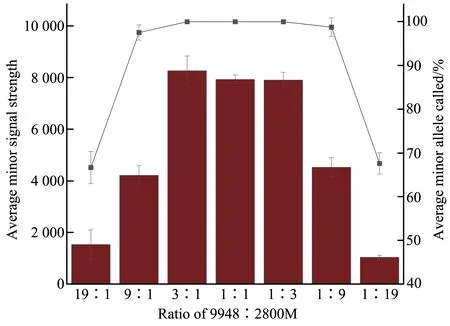
Fig. 8 Mixture study for different ratio of 9948:2800M
2.8 抗抑制性
对3种常见的PCR抑制剂(腐殖酸、靛蓝和血红蛋白)进行全集成检测,以验证该体系的抗抑制性(表5)。结果表明,该反应体系中分别添加浓度为50~400 mg/L 的腐殖酸、20~100 nmol/L 的靛蓝、100 ~500 μmol/L 的血红蛋白时,仍能获得完整分型结果,未出现等位基因丢失。

Table 5 The detection results of samples with different inhibitor concentrations
3 讨论
Y-STR遗传标记在与男性相关的法医学检验中作用独特[27],传统Y-STR 检测流程复杂,耗时耗力,目前尚未见有报道将Y-STR 基因座应用于DNA 快速检验系统,本研究率先构建了Y-STR 微流控芯片检测试剂体系,经过反复优化验证实现了法医DNA 快检仪的集成应用。本研究参考SWGDAM指南,对构建的RTyper Y27微流控芯片检测体系进行了性能验证研究。
灵敏度研究中,DNA 标准品9948 达到8 ng 时能检测出完整Y-STR 分型,对比PowerPlex®Y23、Yfiler®Plus PCR 等Y-STR 试剂盒[25,28]常规PCRCE 检测平台略有不足,但满足大多数现场生物检材检测限的需求[12]。口腔拭子刮擦次数为7 次和血卡片数3 片时(φ=2 mm),等位基因检出率为100%,与Quick TargSeq 快检仪DⅠP 族群推断体系的检测灵敏度相当[21],同时口腔拭子擦拭次数灵敏度与RapidHⅠT®ⅠD 快检仪(擦拭次数8 次时,等位基因检出率为100%)相近[29]。在165 份样本的成功率和分型准确率研究中:成功率达到91.52%,低于ANDETM6C (99.2%[30]) 的成功率、高于RapidHⅠTTM200(85.45%[31])快检仪的首次成功率,与RapidHⅠT®ⅠD(92%[29])相近;分型准确率可达99.74%,与ANDETM6C(99.98%[30])和RapidHⅠTTM200(100%[31])的分型准确率相当,可以实现对血卡和口腔拭子准确分型。准确度和精准度的等位基因片段大小误差均在0.5 bp以内,批内批间精密度CV最大值分别为0.48%和0.68%,均小于15%[32],表明体系能够精确并准确的对样本进行分型。混合样本检测中较小贡献者在1∶3比例下能获得完整等位基因分型,与RapidHⅠT®ⅠD快检仪对混合物检测能力相近[29],与常规PCR-CE 平台使用的DNATyperTMY26(1∶3)[33]、Microreader 40Y ⅠD(1∶3)[34]等Y-STR 试剂盒对混合样本检测能力亦相当。该体系可对常见口腔拭子、血卡、唾液卡、精斑等检材完整分型,但直接处理烟蒂样本出现等位基因丢失,推测原因可能是剪取的烟蒂过滤嘴处含有口腔上皮细胞少[35],DNA 含量低,导致全集成检测结果分型不完整。同时该体系对腐殖酸、靛蓝和血红蛋白等常见PCR抑制剂耐受性较好,与PowerPlex®Y23等试剂盒常规PCR-CE平台的耐受力相当[28,36]。
4 结论
本研究将RTyper Y27 微流控芯片快速检测体系与国产Quick TargSeq 快检仪结合,2 h 左右可获得样本Y-STR 准确分型,一系列验证实验结果表明,该体系重复性、准确性、稳定性良好,能满足现场Y-STR检测要求,可供法医学实践选择使用。

