基于活性和亲和性的泛素探针的发展与合成*
许 玲 魏翠娜 鲁显福** 李宜明
(1)安徽医科大学第一附属医院,合肥 230022;2)合肥工业大学食品与生物工程学院,农产品生物化工教育部工程中心,合肥 230009)
泛素(ubiquitin,Ub)是由76 个氨基酸组成的小型球状蛋白,并在所有真核生物中高度保守。其作为一种重要的翻译后修饰,广泛参与调控人体的许多生理过程,包括蛋白质降解、细胞分裂和细胞内信号传导等[1]。泛素化过程涉及一系列酶级联反应,包括E1s 活化酶(E1s)、E2s 缀合酶(E2s)以及E3s 连接酶(E3s)[2]。E1 酶通过两步反应激活游离的Ub。第一步,E1 酶利用ATP 供能,催化Ub 的C 端酰基腺苷酸化形成E1∶Ub-AMP,其中Ub 与AMP 之间形成活性共价键,E1酶与Ub之间形成非共价复合物。第二步,Ub的C端转移至E1 酶的催化Cys 残基上形成E1-Ub 硫酯复合物。接下来,E2 结合酶作用于E1-Ub 的硫酯键,形成E2-Ub 硫酯复合物。最后在E3 酶的作用下,Ub 从E2 酶的半胱氨酸(Cys)转移到底物蛋白的Lys侧链上形成泛素化修饰。在人体中,大约有600 多个E3 酶,根据它们存在的特征区域与催化转移的机制分成RⅠNG 家族、HECT 家族、RBR家族以及RCR 家族。RⅠNG 家族在E3 酶中占据绝大多数,它们不与Ub 形成共价键,而是直接将E2-Ub 中的Ub 转移到底物蛋白(substrate,Sb);HECT(约30 个成员)与RBR(约12 个成员)家族的E3 酶数量相对较少,都具有一个催化Cys,能够与E2-Ub发生转硫酯反应,形成E3-Ub的硫酯中间体,随后将泛素转移到底物上(图1)[3]。RCR 家族目前仅发现1 个E3 酶MYCBP2,含有2个催化Cys,其中上游Cys 先与E2-Ub 发生转硫酯反应,随后发生分子内转硫酯反应将Ub 传递给下游的Cys 并选择性地对底物蛋白的Ser/Thr 进行泛素化(图1)[4]。
泛素化信号也可以被各种DUBs水解,从而被逆转(图1)[5]。人类基因组编码大约 100 多个DUB,分为7 类:泛素羧基端水解酶家族(UCHs)、卵巢肿瘤蛋白酶家族(OTUs)、泛素特异性蛋白酶家族(USPs)、Machado-Josephin 蛋白酶家族(MJD)、JAB1/MPN/Mov34 蛋白酶家族(JAMM)、含锌指的泛素肽酶1(ZUP1)和新型的MⅠNDY 家族。其中,UCH、USP、OUT、ZUP1、MJD 和MⅠNDY 家族属于Cys 型蛋白酶,JAMM 家族属于锌金属蛋白酶[6]。
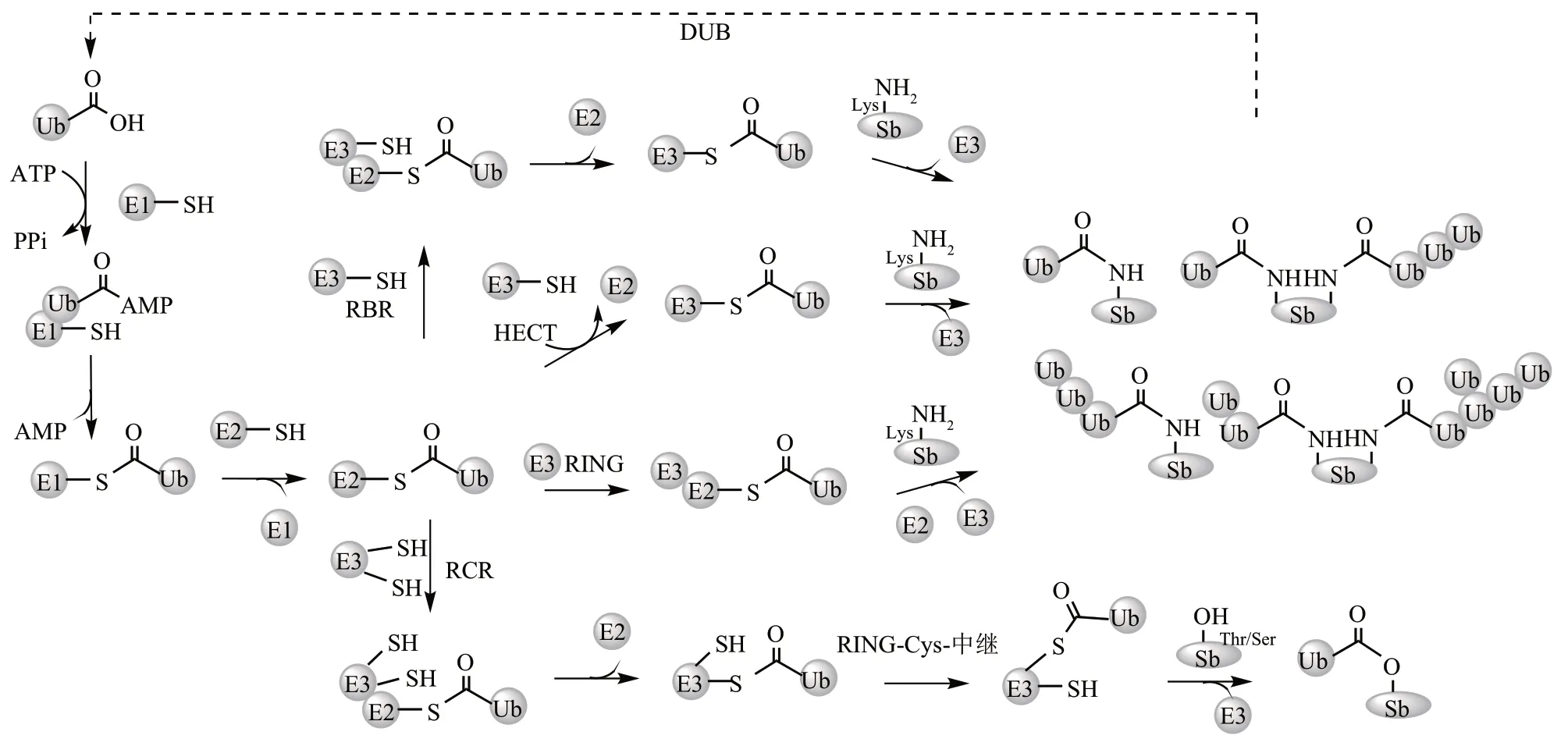
Fig. 1 Ubiquitin conjugation and deconjugation machinery图1 泛素化及去泛素化酶学机制
Ub 既能以单体的形式也能以链的形式添加到底物蛋白上致使Ub信号非常复杂[7]。通常情况下,Ub 分子通过其C 端甘氨酸的羧基和底物中赖氨酸的ε-NH2基团形成异肽键从而连接到底物蛋白上[8]。Ub 自身含有7 个赖氨酸位点(K6、K11、K27、K29、K33、K48、K63),每个赖氨酸以及N端α-NH2基团(M1)均可以被泛素化,从而形成不同长度的同链型或异链型(混合链)的线性链,或含有多个支链的分叉泛素链[7]。这些不同长度和链型的泛素链可以被具有不同UBDs(约20 种)的识别蛋白所结合从而赋予底物蛋白不同的生理结局[9-10]。例如,K48连接的泛素链可以被Rad23a C端的UBA 结构域识别并将其连接的底物运送至26S 蛋白酶体,因此该链型通常作为降解的信号[11]。K63 连接的泛素链则是作为非降解信号,诸如DNA 损伤位点K63 连接的泛素链可以被Rap80 的两个UⅠM 区识别,进而招募BRCA1 等蛋白质修复受损DNA[12]。然而,许多非典型Ub 链类型(如K6、K27、K29、K33、混合链和分叉泛素链)的生理功能仍未得到十足的理解。
为了探究泛素化的相关信号机制,已经开发了多种化学生物学工具[13-15]。其中,泛素探针能以共价交联的方式捕获泛素化过程中的酶或识别蛋白,被广泛研究[16]。本文重点总结了作用于Cys 型DUB和Ub缀合路径中E1s、E2s和E3s的泛素活性探针(activity-based probe,ABP)以及针对识别蛋白的泛素亲和性探针(affinity-based probe,AfBP)的设计以及合成。此外,本文还将介绍新涌现的细胞穿梭型泛素探针的一些进展。
1 泛素活性探针以及亲和性探针的设计
1.1 泛素探针的定义
ABP 和AfBP 能够模仿底物与其作用的酶或结合蛋白进行共价交联。它们都是由3 个部分组成——报告标签、识别单元和活性基团(图2)[17]。报告标签通常为荧光染料或生物素(biotin),主要用于探针的可视化、分离或富集。识别单元是由与其作用的目标对象而决定的,泛素探针的识别单元一般为单泛素(mono-Ub)分子或者是泛素缀合物(Ub-conjugate)(缀合物既可以是Ub也可以是其他底物蛋白)。活性基团能够与目标蛋白产生共价交联,它的选择将影响探针的反应性和选择性。ABP的活性基团用于共价捕获酶的活性位点(主要是活性Cys),如醛基、炔基。而AfBP的活性基团可将非共价相互作用转化为共价键,如光交联基团[18]。近年来,基于Ub的ABP被开发出来主要用于发现和监测Ub 相关过程的E1s、E2s、E3s 和DUBs 酶,基于Ub的AfBP则被用于发现、检测与其作用的识别蛋白。
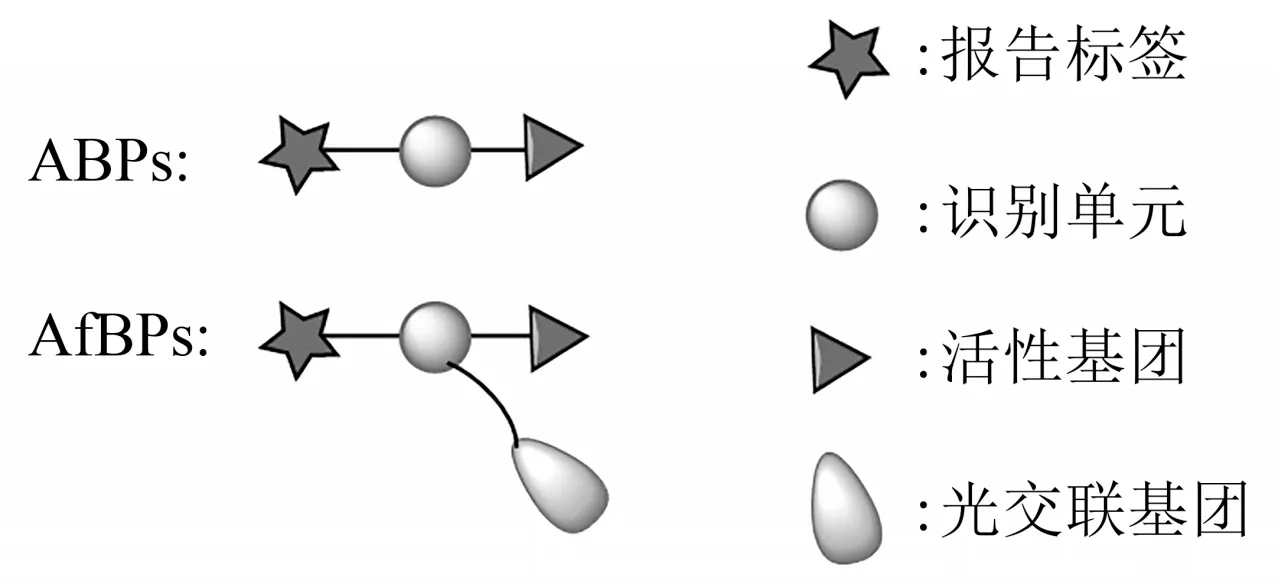
Fig. 2 Structural composition of ABPs and AfBPs图2 ABPs和AfBPs的结构组成
本文根据泛素探针作用对象的不同将其分为DUBs ABP,E1s、E2s、E3s ABP 以及作用于识别蛋白的AfBP。进一步,这些探针又根据识别单元的不同分为DUBs mono-Ub-ABP 和Ub-conjugate-ABP、E1s mono-Ub-ABP、E3s mono-Ub-ABP 和Ub-conjugate-ABP、E1-E2-E3 酶级联反应mono-Ub-ABP(Ub-Dha),以及作用于识别蛋白的Ubconjugate-AfBP。
1.2 DUBs ABP
自1997年第一个针对Cys型DUBs ABP被开发出来[19],目前已经报道了许多不同的设计。这些探针根据识别单元的不同分为mono-Ub-ABP 和Ub-conjugate-ABP。另外,本文根据ABP 与Cys 型DUBs作用的机理又将其分为1,2-亲核加成、1,4-亲核加成和亲核取代反应型探针(图3a)。
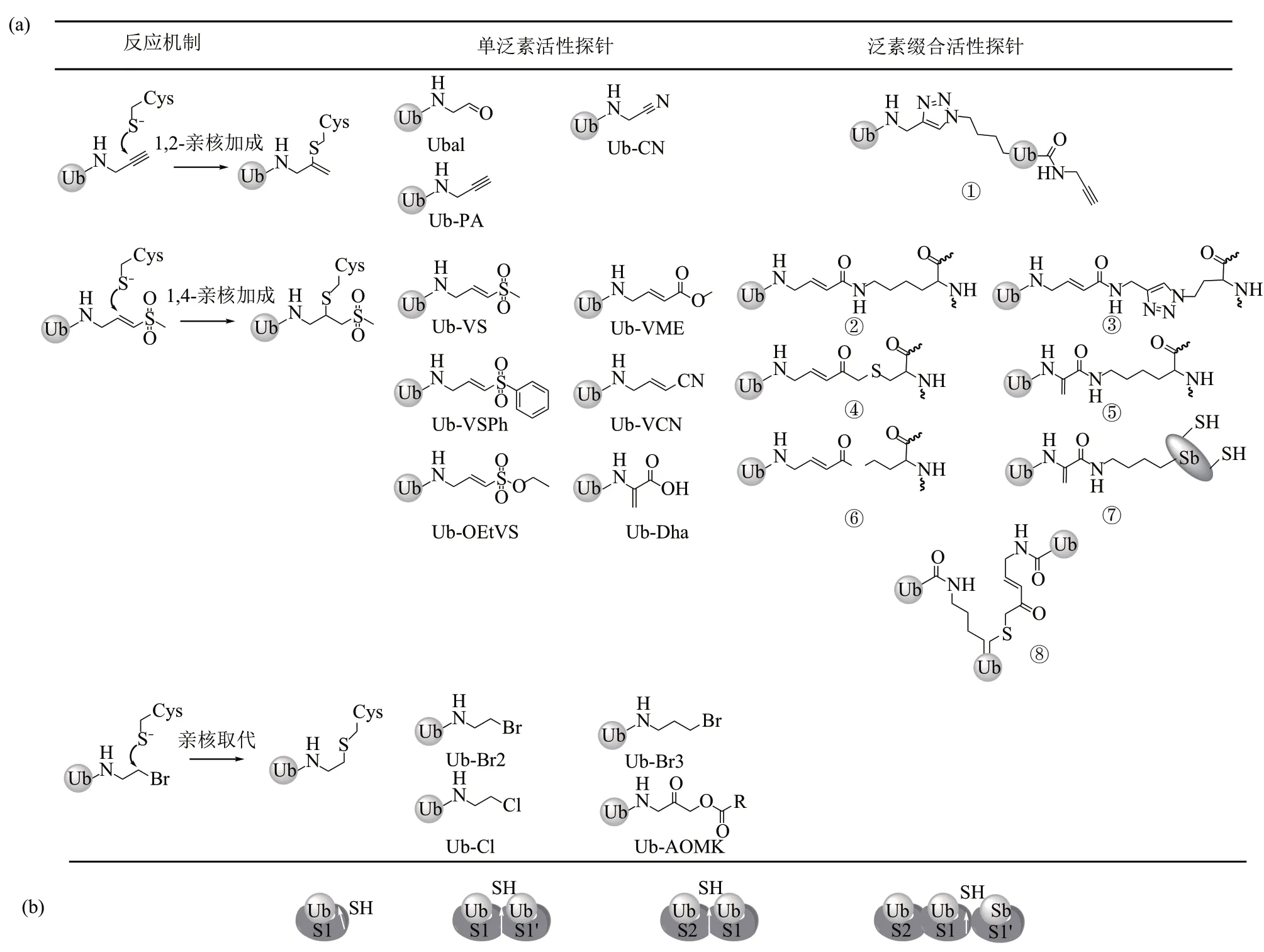
Fig. 3 DUB ABP for mono-Ub and Ub-conjugates and their design principles图3 DUB mono-Ub-ABP及Ub-conjugate-ABP及其设计原理
1.2.1DUBs mono-Ub-ABP
a. 1,2-亲核加成探针
泛素-甲醛(Ubal)和泛素-腈(Ub-CN)是最早开发的一批探针,Ub 末端第76 位Gly 被醛基或腈基亲电基团所取代,可以与DUBs 活性中心的Cys进行1,2-亲核加成反应[19]。这两个探针被用于研究与DUBs 作用的机制,并证实了UCHs 家族的水解酶在催化过程中会与Ub 形成一个共价中间体[20-21]。此外,Johnston 等[22]使用Ubal 首次解析了Ub 与酵母UCH 家族中Yuh1 复合物的结构,阐述了DUBs 特异性水解Ub 的结构基础。然而,Ubal 和Ub-CN 与DUBs 的反应是可逆的,且与DUBs 形成的共价键不兼容SDS/PAGE 的强还原条件。2013年,Ovaa课题组[23]发展了另外一个1,2-亲核加成反应型探针——泛素-炔丙基酰胺(Ubpropargylic acid,Ub-PA/Ub-Prg),该探针能够兼容还原及变性条件,并与DUBs 活性部位的Cys 残基反应生成乙烯基硫醚的结构。目前Ub-PA探针已被得到广泛使用,如被用于解析与多种酶的复合物结构(DUBs 中vOTU[23]、USP30[24]、UCHL5[25]以及HECT型E3酶HUWE1[26])。
b. 1,4-亲核加成探针
2001 年,Borodovsky 等[27]开发了第一个不可逆的DUBs ABP——泛素-乙烯基砜(Ub-vinyl sulfone,Ub-VS),用于标记细胞裂解液中的DUBs,并从哺乳动物的26S 蛋白酶体中发现了一种新的DUB USP14。该探针还被用于监测体外脂肪生成模型中DUBs 活性的变化,发现了USP7 是脂肪生成的一个调控蛋白[28]。科学家陆续又发展了泛素-乙烯基甲酯(Ub-vinyl methyl ester,Ub-VME)、泛素-乙烯基氰(Ub-vinyl cyanide,Ub-VCN)、 泛素- 乙烯基苯砜(Ub-vinyl phenyl sulfone,Ub-VSPh)[29]、泛素-乙烯基乙氧基砜(Ub-vinylethoxysulfone,Ub-OEtVS)[30]、泛素-脱氢丙氨酸(Ub-dehydroalanine,Ub-Dha)[31]等探针。这些探针均能够在体外或细胞裂解液中与不同的DUBs进行不同程度的交联,其中Ub-VME因具有较强的活性而展示出最广泛的反应性[29]。此外,Ub-VME 能够有效地标记NEDD4、 UBE3C、HECTD1 和UBR5 的HECT 结构域从而用于评估HECT E3s 的活性[32]。Ub-VME 也被用于生成与E3s的复合物,如ARⅠH1并解析复合物结构从而阐明ARⅠH1进行泛素化的作用机制[33]。
c. 亲核取代反应的探针
目前还开发了一些与DUBs 的活性位点Cys 进行亲核取代反应的探针,如泛素-氯乙基(Ubchloroethyl, Ub-Cl)、 泛素- 溴乙基 (Ubbromoethyl, Ub-Br2) 和泛素- 溴丙基(Ubbromopropyl,Ub-Br3)[29]。相比于Ub-VS 与Ub-VME,该类探针的反应活性稍差,目前未得到广泛使用,但对于鉴定某些OTU DUBs是有用的[29]。后来,科学家又发展了泛素-酰氧基甲基酮(Ub-acyloxymethyl ketone,Ub-AOMK)探针[30],该探针在裂解液中展现出与Ub-VME 类似的活性,然而其稳定性并不好。
1.2.2DUBs Ub-conjugate-ABP
上述mono-Ub-ABP仅依赖于Ub与DUBs S1口袋的识别作用,然而,还有较多的DUB 偏好于水解Ub-conjugate,作用于远端Ub 的S1、S2 口袋或近端Ub的S1′口袋,从而表现出对泛素链或底物蛋白的特异性识别(图3b)[16]。因此,为了研究这些DUBs 的活性和泛素链选择性,研究人员开发了Ub-conjugate-ABP。
a. 1,2-亲核加成探针
目前,Ub-conjugate-ABP 中能够进行1,2-亲核加成反应的探针是2016 年Ovaa 课题组[34]发展的diUb-PA,该探针被设计用来结合DUBs 中的S1 和S2口袋,并发现了S2口袋决定了OTUD2对K11连接泛素链的选择性(图3a,结构①)。OTUD2自身对diUb 的水解表现出非专一性,然而却对K11 连接的diUb-PA 探针有明显的特异性。此外,OTUD2 水解K11 泛素链连接的底物蛋白比水解K11-diUb 快得多,这都是因为功能性的S2 口袋起了作用[35]。
b. 1,4-亲核加成探针
2012 年,Franke 课题组[36]制备了第一个进行1,4-亲核加成的diUb-ABP,作者使用Ub 异肽键附近13个氨基酸的短肽来模拟近端Ub设计出了K48和K63连接的diUb-ABP(图3a,结构②)。两个探针在体外对部分DUB 产生交联,并能够在细胞裂解液中标记到一些不同的DUBs。然而,考虑到含有短肽的探针不能够完全代表全长diUb-ABP 的反应性和选择性,2013年,Kessler课题组[37]合成了三氮唑连接的具有全长Ub 且8 种不同链类型的diUb-ABP(图3a,结构③)。作者使用这些探针分析了细胞裂解液中DUBs 对识别diUb 分子的选择性。由于三氮唑结构与天然异肽键相差较大,2014年Zhuang课题组[38]制备了与天然异肽键结构更为类似的硫醚键连接的K48和K63连接的diUb-ABP,并发现探针能够在细胞裂解液中对DUBs进行特异性的标记(图3a,结构④)。同年,Brik课题组[39]开发了基于Dha 的K48 和K63 连接的diUb-ABP 并能够在体外特异性的标记DUBs(图3a,结构⑤)。此外,作者还合成了线性的diUb-ABP,并发现已知能够切割该链型的OTULⅠN 和USP2 并不与之交联,而是对此探针进行了水解。作者认为这可能是因为Dha 基团放置在了DUB 切割位点的前面使之不易接近从而发生了水解。同年Ovaa课题组[40]开发了7种链型的含有迈克尔受体结构的diUb-ABP,该探针与天然diUb 在结构上更为接近(图3a,结构⑥)。作者进一步证实了它们具有链特异性。上述探针的制备策略仅适用于合成序列中不含Cys的Ub-conjugate-ABP,还有较多的底物蛋白含有多个Cys。为了解决这个问题,2016 年Chatterjee 课题组[31]使用硒代Cys 策略构建Dha 活性基团制备了含有多个Cys 的Ub-conjugate-ABP,并使用该探针特异性的捕获了TRⅠM-25 相关的DUB USP15(图3a,结构⑦)。总之,这些探针都能够对已知链选择性的DUBs显示出预期的反应性:如没有选择性的USPs 能与大多数探针反应,而链选择性的DUBs 则优先与相应链型的ABP 进行反应。2019年,Zhuang 课题组[41]制备了第一个K11、K48 和K63 连接的triUb-ABPs(图3a,结构⑧)。作者使用这些探针揭示了USP9X 分别以外切和内切的方式水解K48和K63连接的泛素链。
1.3 E1s、E2s、E3s ABP
与DUBs ABPs 相比,E1s、E2s、E3s ABP 相对较少,可能是由于Ub 对 E1s、E2s、E3s 是顺序的酶级联反应而不是与单一的酶反应。而且,E3s中只有HECT 与RBR 家族的E3 酶有一个催化的Cys,最大家族的RⅠNG E3s则不含有催化的Cys。
1.3.1E1s ABP
2010 年,Lu 等[42]对Ub 的C 端进行5'-磺酰腺苷修饰以模拟Ub-AMP 结构制备了泛素-乙烯基磺酰胺探针(Ub-vinylsulfonamide,Ub-AVSN)。该探针能够与E1s 酶进行共价交联,从而研究E1s 催化的腺苷化和硫酯化的机制。然而,该探针的合成步骤繁琐。为了更便捷地生成E1s ABP,2016 年,An 等[43]在Lu 的基础上将乙烯基砜替换为Dha,生成Ub-Probe2-3。该探针不仅制备简单,还能够与E1s 酶活性位点的Cys 形成共价键,从而形成E1-Ub-AMP中间复合物(图4)。
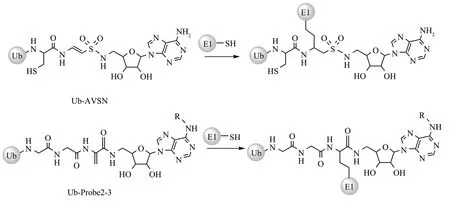
Fig. 4 E1 ABPs react with E1’s active Cys图4 E1 ABPs与E1活性Cys反应
1.3.2E3s ABP
a. E3s mono-Ub-ABP
部分DUBs mono-Ub-ABP 也能够与E3 连接酶进行共价交联,用于HECT/RBR家族E3s酶的蛋白质组学筛查和结构机制研究(图5)。其中,最具有典型代表性的是Ub-VS 探针,它利用乙烯基砜基作为反应弹头来与E3s 的活性Cys 进行交联[44]。后来,Ploegh 课题组[30]还开发了一系列具有不同亲电基团的E3s mono-Ub-ABP,包括Ub-β-内酯(Ub-β-lactone,Ub-Lac)、泛素-乙烯基乙氧基砜(Ub-vinylethoxysulfone,Ub-OEtVS)和泛素-2,6-三氟甲基苄氧基甲基酮(Ub-2,6-trifluoromethylbenzyloxymethylketone,Ub-TF3BOK),被用于E3酶活性研究。
b. E3s Ub-conjugate-ABP(又称E2-Ub-ABP)
由于E3s 催化的泛素化需要E2s 酶的参与,mono-Ub-ABP不能够用于研究E3s酶的一些催化过程,如转硫酯化,因此E2-Ub-ABP 被开发出来(图5)。2016 年,Virdee 课题组[45]报道了E2-Ub-AVS探针。为了在长度上尽可能与E2-Ub中间体保持一致,作者截短了Ub C 端氨基酸的数量。利用此探针,作者监测了Parkin的活性。进一步,该探针也被用于细胞裂解液中E3s 酶的转硫酯活性筛查,并且发现神经元相关的E3 连接酶MYCBP2 能够对非赖氨酸位点的Ser和Thr(尤其是Thr)进行泛素化,这暗示了非赖氨酸泛素化可能也在高等真核生物的细胞调节中发挥作用[46]。2019 年,本课题组[47]开发了另一种E2-Ub-Dha 探针,该探针制备简单,而且在结构上与天然E2-Ub的结构也更为类似。使用该探针,我们不仅在体外而且在细胞裂解液中标记到多个HECT E3s。2021 年,Liu 课题组[48]报道了另外一种E2-Ub 探针,称为E2-Dap-Ub-Dha。该探针的泛素C端与连接E2s酶Cys之间的α碳的原子数目与天然E2-Ub完全相同,可以更好地模仿天然中间产物。作者利用该探针研究了UbcH7与Nedd4、Parkin蛋白之间的转硫酯作用。
由于RⅠNG 型E3s 酶直接催化Ub 从E2s 转移到底物上,并不会形成E3-Ub这个中间产物,因此上述发展的E2-Ub-ABP不能够用于研究RⅠNG型E3s。为解决这个问题,2020 年Virdee 课题组[49]发展了一种嵌入光交联的对苯甲酰-L-苯丙氨酸(pbenzoyl-L-phenylalanine,Bpa)的E2-Ub-Bpa探针,用于捕获RⅠNG 型E3s。为了获得最佳的光交联位点,他们根据E3-E2-Ub 复合物的晶体结构筛选了Ub 中与E3s 酶作用相临近的一些氨基酸,并通过体外活性测试进行了优化。使用该探针作者证实了RⅠNG E3 酶c-Cbl 的活性依赖于c-Src 激酶对其Y371位点的磷酸化作用。
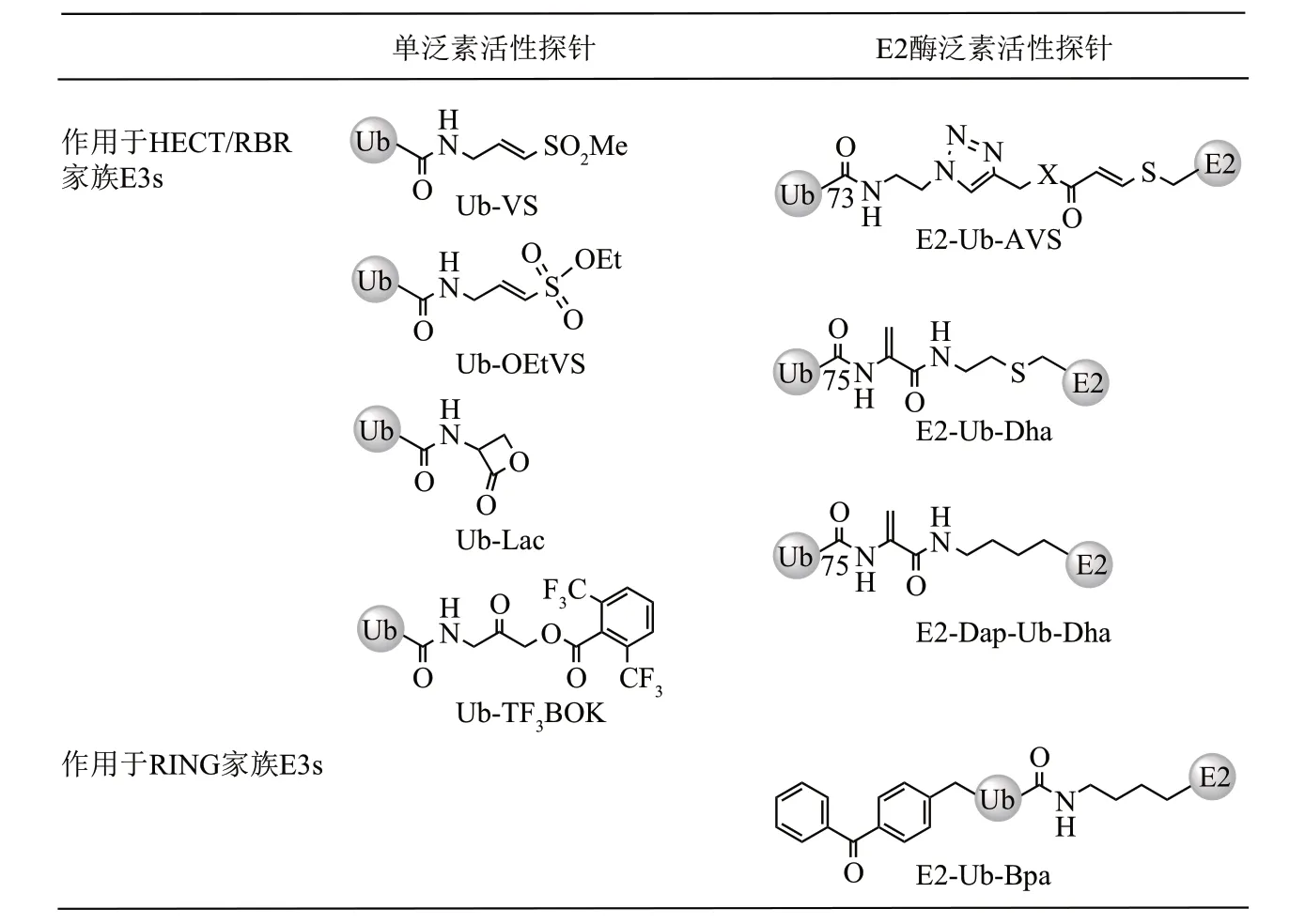
Fig. 5 Mono-Ub-ABP and E2-Ub-ABP for E3图5 E3 ABPs(包括mono-Ub-ABP以及E2-Ub-ABP)
1.3.3E1-E2-E3酶级联mono-Ub-ABP(Ub-Dha)
由于泛素化修饰是由E1s、E2s、E3s酶级联反应进行的。有些底物可由特异性的E1-E2-E3 对修饰,而另有一些底物可由多对E2-E3 酶修饰。因此,为了监测整个酶级联反应的过程,发展了Ub-Dha 探针(图6)[50]。Ub-Dha 能够像mono-Ub 一样被E1s酶激活,并顺序传递给E2s和E3s酶。同时,该探针还能在每次传递过程中与E1s、E2s和E3s酶发生共价交联反应,从而对其进行标记,而且该探针不会被添加到底物蛋白上。作者使用该探针在HeLa 细胞和MelJuSo 黑色素瘤细胞中进行了蛋白质组学筛查,发现Ub-Dha 能够在ATP 的存在下标记E1酶UBE1和UBA6、E2酶UBE2S和UBE2K和E3 酶UBE3A 和HECTD1 等,并且发现TRⅠP12 E3酶只能在MelJuSo细胞系中检测到,说明不同细胞中的E3s 酶的表达水平是不同的。Ub-Dha 探针可以与酶交联而不影响其构象,使其成为研究泛素化酶级联反应的实用工具。
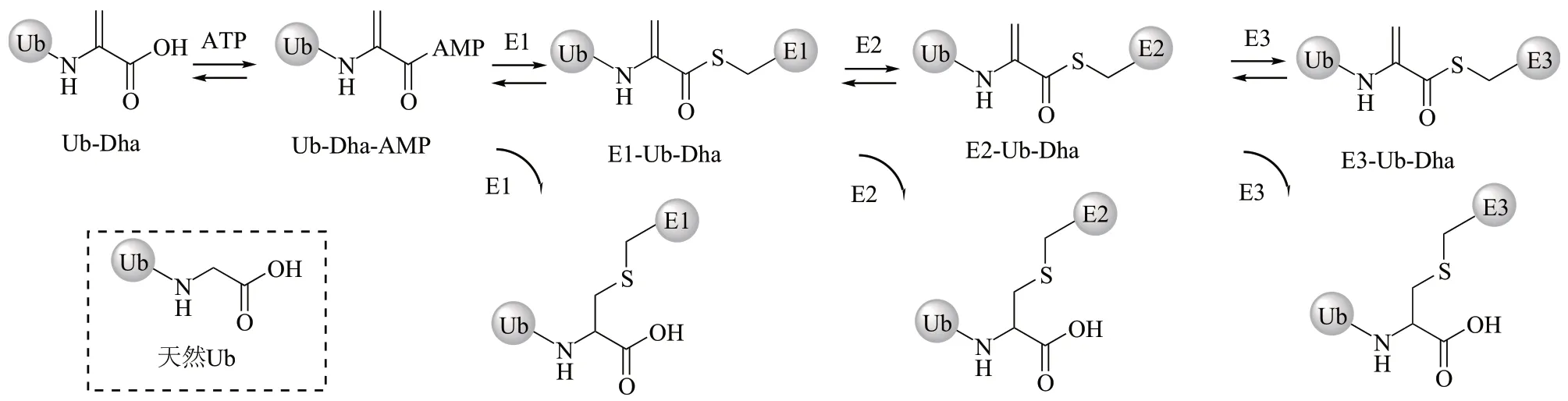
Fig. 6 “Cascading” ABP Ub-Dha,which can sequentially label E1,E2,and some E3 enzymes图6 Ub-Dha酶级联反应传递路线图
1.4 作用于泛素识别蛋白的AfBP
泛素化修饰能够被识别蛋白结合从而调控众多细胞过程。鉴定细胞内的泛素识别蛋白,尤其是可以选择性作用于Ub-conjugate的识别蛋白,对于理解泛素化修饰的功能及调节机制具有重要的意义。然而,由于Ub-conjugate与识别蛋白的结合力较弱且为非共价键,基于Ub的ABP并不适用于鉴定泛素识别蛋白。于是,带有光交联基团的Ubconjugate-AfBP被开发出来。在光照下,光交联官能团会产生高活性的反应中间物,并在空间上选择性地捕获非共价相互作用的蛋白质[51]。
目前常用的光交联活性基团包括二苯甲酮、芳基叠氮化物和双吖丙啶。二苯甲酮被相对较长的波长(350~365 nm)激活,对蛋白质的损伤较小(图7a)。激活后转化成为一个活性的双自由基,并且对甲硫氨酸有很高的亲和力和选择性。2019年,Cropp 课题组[52]在mono-Ub 以及K48-/K63-diUb 的多个位点引入了二苯甲酮光交联基团,并通过体外实验进一步确定了最佳交联位点T9 与Q49(图7a,结构①)。作者发现,K48 和K63 diUb-AfBP 不仅可以与已知识别蛋白的小型UBD形成共价交联,并且能够捕获Rpn1 上更大的UBD。

Fig. 7 Reaction mechanism of photocrosslinking groups with Ub-conjugate-AfBP图7 光交联基团的反应机理及Ub-conjugate-AfBP
芳基叠氮化物被光照射激活后(254~400 nm)失去N2并产生一种叫做亚硝酸盐的反应中间物,它可以与相邻的C—H 或杂原子—H 键反应,形成一个新的共价产物(图7b)。缺点是生理条件下会被部分还原,导致交联效率低。2017 年,Tian 课题组[53]制备了A46C 位点嵌入芳基叠氮基团的K48 和K63 连接的 diUb-AfBP,并能够与K48 链型和K63链型特异性结合的UBD UBA2和tUⅠM 进行体外交联实验,然而探针却不具有选择性(图7b,结构②)。
三氟甲苯(芳)基双吖丙啶或烷基双吖丙啶都可以在350 nm 的光照下通过失去N2而产生一个卡宾中间体。这个中间体非常活跃,可以迅速的与邻近的C—H 或杂原子—H 键反应形成共价复合物。Tian 课题组[53]制备了A46C 位点嵌入烷基双吖丙啶基团的K48 和K63 diUb-AfBP,并且该探针也能够与相应的UBD UBA2和tUⅠM进行特异性的共价交联。作者还将这两个探针用于HEK293裂解液交联,并鉴定出多个能与K48-/K63-diUb 结合的蛋白质(图7c,结构③)。同年,Glickman 课题组[54]将含有双吖丙啶的亮氨酸衍生物嵌入到泛素链中,制备出泛素-光抓捕剂(UbPT),并用此探针鉴定出蛋白酶体中第3 个识别泛素链的蛋白Rpn1(图7c,结构④)。含有双吖丙啶的泛素也被用于缀合底物蛋白以研究与识别蛋白的作用机制。2016年,Muir 课题组[55]制备了UbL71 嵌入双吖丙啶的Ub-H2B-AfBP,并组装核小体(图7c,结构⑤)。作者用此探针发现了Ub与H2A 的N端之间发生了相互作用,进而激活了hDot1L活性。
2 泛素探针的合成
泛素探针中的识别单元部分需要通过蛋白质化学合成与修饰技术获取。这部分将首先阐述识别单元中mono-Ub和Ub-conjugate的合成策略,然后再介绍探针中活性基团的引入。
2.1 识别单元(mono-Ub 和Ub-conjugate) 的合成
mono-Ub 和Ub-conjugate 含有一个共同的Ub模块,Ub-conjugate 还包含一个缀合物模块,这些单体模块均可通过化学全合成或半合成的策略获得。为进一步生成Ub-conjugate,还需在Ub模块和缀合物模块之间构建异肽键。因此,这部分将首先介绍单体模块的合成策略,然后再介绍异肽键的构建策略。
2.1.1单体模块蛋白的合成策略
a. 化学全合成
Ub 模块以及缀合物模块可通过化学全合成的策略获取。固相多肽合成(solid phase peptide synthesis,SPPS)技术的发展使人们能够获得不同的多肽片段[56]。然而,随着肽链长度的增加,链间的聚集会导致脱保护和氨基酸偶联效率的降低,所以SPPS通常只限于制备大约50个氨基酸组成的多肽(图8a)[57]。为了克服这个局限,自然化学连接(native chemical ligation,NCL) 被开发出来(图8a)[58]。该反应是基于C 端为硫酯的多肽与N端为Cys的多肽发生高度特异性的化学反应,并生成一个天然的肽键。然而,由于硫酯对哌啶不稳定,不能直接采用 Fmoc 法固相合成,Liu 课题组[59]开发出基于酰肼的NCL连接反应,将多肽C端的酰肼基团作为硫酯的前体替代物(图8a),该策略在多肽连接领域已得到广泛的应用[60-70]。
采用化学全合成制备Ub模块需先通过SPPS合成两条小于50个氨基酸的肽段,并突变A46C用于NCL 连接,脱硫后就可形成天然的Ub 模块[71]。Ub模块也可通过SPPS一次性获取,但需添加伪脯氨酸等结构分子以提高合成效率[72]。化学全合成可以不受遗传密码翻译机制的限制,在任意位点添加修饰氨基酸,而且化学全合成是一个高通量的方法,可以在短时间内制备大量的多肽。然而,由于涉及到多步保护、脱保护、连接和纯化操作,该方法在用于获取较大单体模块时的产率很低。
b. 化学半合成
1998 年,Muir 课题组[73]发展了内含肽(Ⅰntein)融合目标蛋白表达的策略获取较大的多肽片段,其C端在外源硫醇的作用下还可生成硫酯基团以进一步用于表达蛋白连接(expressed protein ligation,EPL)(图8b)。通过此方法Muir 组制备了泛素硫酯单体模块[74]。2013年,Macmillan课题组[75]发现,C 端为Gly-Cys 序列的多肽在缺乏Ⅰntein的情况下也可通过分子内N→S酰基转移过程生成末端为硫酯的结构,若在反应时添加肼分子可进一步生成多肽酰肼,利用此策略作者制备了泛素酰肼。生物酶法也可用于快速获取单体模块。例如,Liu 课题组[76]利用泛素水解酶YUH1 水解Ub(1~77D),并在反应中加入肼分子获得Ub(1~76)酰肼。此外,利用E1s 对Ub 的活化作用也可快速制备泛素硫酯或酰肼[77]。利用工程化的转肽酶进行连接可获得更大的单体模块。譬如Sortase 介导的蛋白质半合成策略,使用这个方法需要在连接位点构建特异性的氨基酸序列(LPXTG),另外还需构建一个寡聚甘氨酸用于连接[78-80]。只是使用该方法会不可避免地引入多个突变氨基酸(图8b)。化学半合成结合了SPPS 和重组蛋白表达系统的能力,对于大型蛋白质的获取更为方便快捷,只是在用于蛋白质功能或结构研究之前,还需进行重折叠或复性,这对于获取某些难以复性的蛋白质来说是困难的。
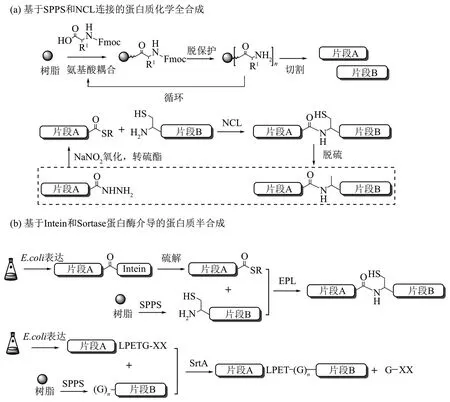
Fig. 8 Strategies for the synthesis of Ub-conjugate module图8 单体模块蛋白的合成策略
2.1.2异肽键的构建
目前构建异肽键的策略可分为天然和非天然异肽键的构建。
a. 天然异肽键的构建策略
(1)辅基连接策略
Miur课题组[81]在赖氨酸侧链上引入了光敏性的甘氨酸辅基,该辅基可与多肽硫酯末端进行NCL反应,并在连接完成后通过UV紫外线照射即可脱除,从而制备天然的异肽键(图9a)。然而,光敏甘氨酸辅基分子不仅合成繁琐,而且在用于NCL 的连接效率也较差,从而限制了该策略的应用。之后,Liu 课题组[67,82]发展了一种相对合成步骤较少的酸敏性的甘氨酸辅基,并兼容酰肼NCL,连接完成后仅需通过TFA 的切割试剂即可脱除(图9b)。2014 年,Chatterjee 课题组[83]发展了另外一种用于NCL连接的2-氨基氧乙硫醇辅基,该辅基相对前两者来说制备简单,然而需要在含有Zn 的强酸性盐酸胍溶液中进行脱除(图9c)。此外,由于在Cys连接处的是二级胺,导致反应效率不高。辅基连接策略构建天然异肽键是化学合成方法中的重要选择,相应的辅基小分子尤其是酸敏性辅基已经商业化,可在化学合成中直接使用。
(2)巯基赖氨酸策略
Liu 课题组和Brik 课题组分别报道了用γ 巯基赖氨酸[84-85]和δ 巯基赖氨酸[86-88]构建异肽键的方法(图10)。将γ 或δ 巯基赖氨酸通过SPPS 嵌入到所需的位点,然后与多肽硫酯片段进行NCL反应,最后再进行脱硫即可形成天然的异肽键。其中,Liu 课题组设计的γ 巯基赖氨酸不仅可以介导侧链ⅠCL形成异肽键也可以介导主链的NCL反应。巯基赖氨酸比光敏和酸敏甘氨酸辅基介导的NCL 连接效率高得多。然而,由于该类型的非天然氨基酸的合成较为复杂,即使Ovaa课题组[89]优化了γ巯基赖氨酸的合成,目前也未得到广泛应用。
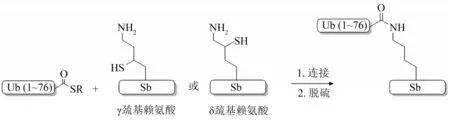
Fig. 10 Thiolysine-mediated ligation strategy for the construction of native isopeptide bonds图10 巯基赖氨酸策略构建天然异肽键
(3)ⅠsoUb(isopeptide-linked 76-mer Ub)策略
Liu 课题组[90]发展了一种异肽键连接的泛素ⅠsoUb 异构体作为构建单元合成天然的泛素链(图11)。这个ⅠsoUb 异构体由泛素的两个多肽片段组成,共76 个氨基酸。该异构体的特点是直接通过SPPS 构建异肽键,且该片段C 端是酰肼基团,N端是Cys,使多肽的两端都可进行NCL。使用此方法,作者合成了迄今为止使用化学全合成策略获取的最大蛋白质K11/K48-分叉六泛素(456 个氨基酸)。该策略构建天然异肽键时无需预先合成连接小分子单元,且NCL 发生在肽主链上,大大提高了连接效率并且降低了水解副产物的生成。该策略的不足是需要在SPPS 中添加伪脯氨酸和2,4-二甲氧基苄基修饰的甘氨酸,致使合成的成本较高,而且反应是在高温的专业仪器中进行,对于部分实验室难以达到。
(4)非天然氨基酸(巯基赖氨酸)嵌入的策略
Chin课题组[91]报道了使用非天然氨基酸嵌入技术将δ巯基赖氨酸衍生物嵌入到重组蛋白质用于制备泛素化蛋白(图12)。作者首先定向进化了tRNA 合成酶生成特定的吡咯赖氨酰-tRNA 合成酶(PylRS)/tRNACUA对,然后将δ 硫代赖氨酸衍生物定点嵌入到重组蛋白质中。嵌入巯基赖氨酸的蛋白质可以直接与泛素硫酯进行连接,脱硫后就可形成具有天然异肽键的产物。应用该策略极大地简化了蛋白质合成的步骤,但受嵌入位点的影响,非天然氨基酸在不同蛋白质中嵌入效率不同,可能并非适用于所有蛋白质。此外,在需嵌入两个以上位点时,效率极低,进一步限制了其应用。
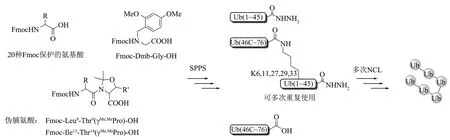
Fig. 11 IsoUb-mediated chemical synthesis strategy for the construction of native isopeptide bonds图11 IsoUb策略构建天然异肽键
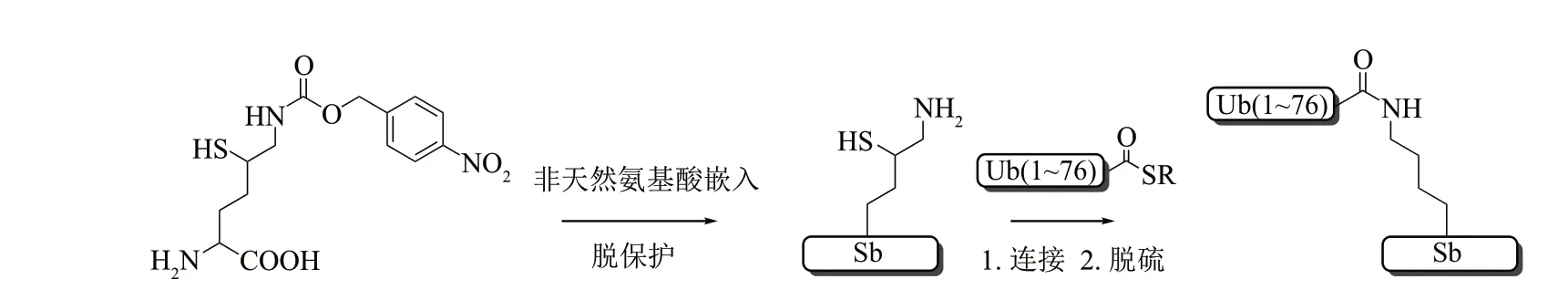
Fig. 12 Genetically incorporated unnatural amino acids strategy for the construction of native isopeptide bonds图12 非天然氨基酸嵌入技术构建天然异肽键
(5)GOPAL氨基酸正交保护策略
Chin课题组[92]开发了基因编码的正交保护和激 活 连 接 (genetically encoded orthogonal protection and activated ligation,GOPAL)策略构建异肽键并合成多聚泛素链(图13)。在该策略中, 作者使用PylRS/tRNACUA对将侧链Boc(butoxycarbonyl) 保护的非天然氨基酸H-Lys(Boc)-OH嵌入到泛素的特定位点中,然后用Boc的正交保护基团Cbz(carbobenzyloxy)掩蔽蛋白质上剩余的游离氨基。进一步脱去Boc基团暴露出嵌入的赖氨酸的侧链氨基,最后在银离子介导下与侧链氨基被Cbz 保护的泛素硫酯进行缩合和连接,最终再脱除所有的Cbz 基团从而获得天然连接的diUb。Fushman 课题组[93]改变Cbz 这一正交保护基团而使用了Alloc(allyloxycarbonyl)这一保护基团,该保护基可以在钌等金属催化剂下进行脱除(图13b)。Liu课题组[94]则使用了突变的甲硫氨酸氨酰基-tRNA 合成酶和tRNA 对将叠氮正亮氨酸H-Anl-OH(azidonorleucine,Anl)嵌入泛素特定位点中并使用Boc这一正交保护的策略,获得了具有天然异肽键的diUb 和泛素化组蛋白 H2A(图13a)。 本课题组[95]将H-Lys (Proc) -OH(propargyloxycarbonyl,Proc) 定点嵌入到Ub1-75Cys,之后利用N→S 迁移策略将其C 端转化为酰肼基团,然后使用Boc掩蔽该蛋白质剩余游离的氨基,脱除Proc 保护基后将甘氨酸辅基构建到Ub1-75NHNH2的异肽键连接的位点。最终再脱除所有的Boc 保护基后得到一种可二次NCL 连接的泛素单元。运用该策略,我们不仅制备了单一链型的K48 和K6 连接的triUb,还制备了由K48 和K6组成的混合链型的triUb(图13a)。氨基酸正交保护策略结合了生物表达以及非天然氨基酸嵌入技术,可在短时间大量获取反应原料。缺点是需同时进行多个Cbz 与Alloc 保护基的脱除,不仅条件苛刻且效率极低,即使替换成条件较温和的Boc保护基,效率也较差。此外,银、钌、钯等重金属的使用不可避免导致金属残余。
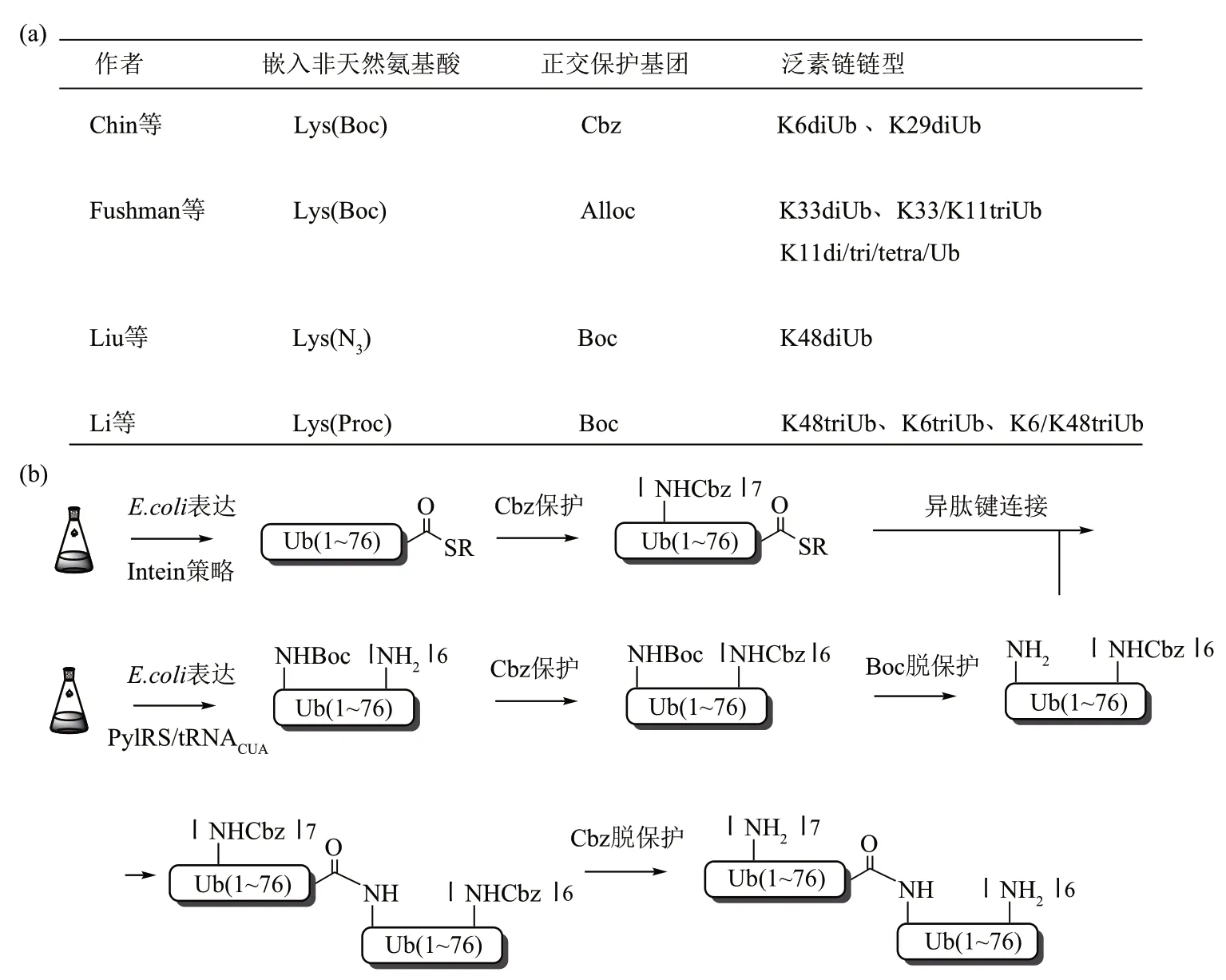
Fig. 13 GOPAL approach strategy for the construction of native isopeptide bonds图13 GOPAL氨基酸正交保护策略构建天然异肽键
b. 非天然异肽键的构建策略
相比于获取天然异肽键连接的Ub-conjugate,运用某些化学策略更易于实现非天然异肽键连接的Ub-conjugate的制备(图14)。
(1)基于Cys 策略:二硫键连接和Thiol-ene反应
Miur 课题组[96]与Zhuang 课题组[97]分别报道了使用二硫键连接策略制备Ub-conjugate (图15a)。他们首先表达出Ub-Ⅰntein 后使用巯基乙胺试剂进行氨解获得泛素-巯基乙胺蛋白,同时将缀合物异肽键连接位点的Lys 突变为Cys。然后两组分别使用了2,2'-二硫双(5-硝基吡啶)(2,2'-dithiobis(5-nitropyridine),DTNP))[96]和5,5'-二硫双(2-硝基苯甲酸)(5,5'-dithio-bis-2-nitrobenzoic acid,DTNB)[97]作为活化试剂制备了二硫键连接的泛素化的组蛋白H2B和泛素化的PCNA。该方法操作简单,能较快地获得目标产物,而且二硫键具有较强的稳定性,可以在多种条件下保持不变性。缺点是连接形成的类异肽键比天然异肽键长,而且二硫键具有一定的可逆性,在还原条件下会导致二硫键的断裂。
Strieter 课题组[98-99]运用Thiol-ene 化学反应制备了多种类型的Ub-conjugate(图15b)。他们获得Ub 硫酯后与烯丙基胺分子进行反应将烯丙基引入泛素的C 端,同时将缀合物异肽键连接位点的Lys突变为Cys。在光引发剂的存在下,烯丙基与巯基反应生成硫醚键。该方法操作简单,能较快地获得目标产物。然而,硫醇-烯反应的效率很低,产率仅30%左右。
(2)1,3-二氯/溴丙酮交联策略
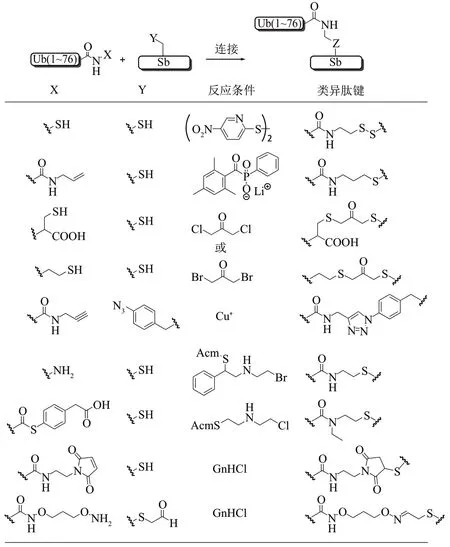
Fig. 14 Biorthogonal ligation strategy for the construction of non-native isopeptide bonds图14 生物正交连接策略构建非天然异肽键

Fig. 15 Cysteine-based methods for the construction of non-native isopeptide bonds图15 基于Cys策略生成非天然异肽键
Wilkinson 课题组[100]与Wolberger 课题组[101]利用1,3-二氯/溴丙酮交联的策略制备了Ubconjugate(图16a)。大肠杆菌表达Ub76Cys,同时将缀合物蛋白异肽键连接位点的Lys 突变为Cys。在含有上述两种蛋白质的溶液中添加1,3-二氯/溴丙酮进行反应即可连接形成Ub-conjugate。然而,使用该策略会使反应混合物中生成至少4种不需要的副产物,并需多次分离纯化,从而导致产物总产率低于10%。Pratt课题组[102]改进该策略,将泛素硫酯氨解生成的泛素-巯基乙胺替代Ub76Cys 与缀合物蛋白反应可以生成更多的目标产物,并且使用1,3-二溴丙酮能大幅提升产物的产率,并生成较纯的目标产物(图16b)。2020 年,本课题组[103]继续优化了该反应,开发出一锅连接策略制备泛素化的组蛋白(图16c)。首先,我们探索了Ub76Cys与1,3-二溴丙酮反应的最佳条件,发现这一反应在酸性(pH=4.5~5.0)硼酸盐缓冲溶液中达到90%的反应效率。之后,并未分离这一中间产物,而是使用冰乙醚除去多余的1,3-二溴丙酮,然后调节溶液pH至6.5~7.0,添加组蛋白H2B以启动原位偶联生成二硫代丙酮连接的泛素化的H2B,产率高达85%。经改进后的策略不仅操作简单,而且一锅反应大大提高了产物的产率。总之,1,3-二氯/溴丙酮交联策略是一种高选择性、高效率的反应,且该方法反应条件相对温和,可以在非变性的条件下进行反应,是获取Ub-conjugate的一种较好选择。
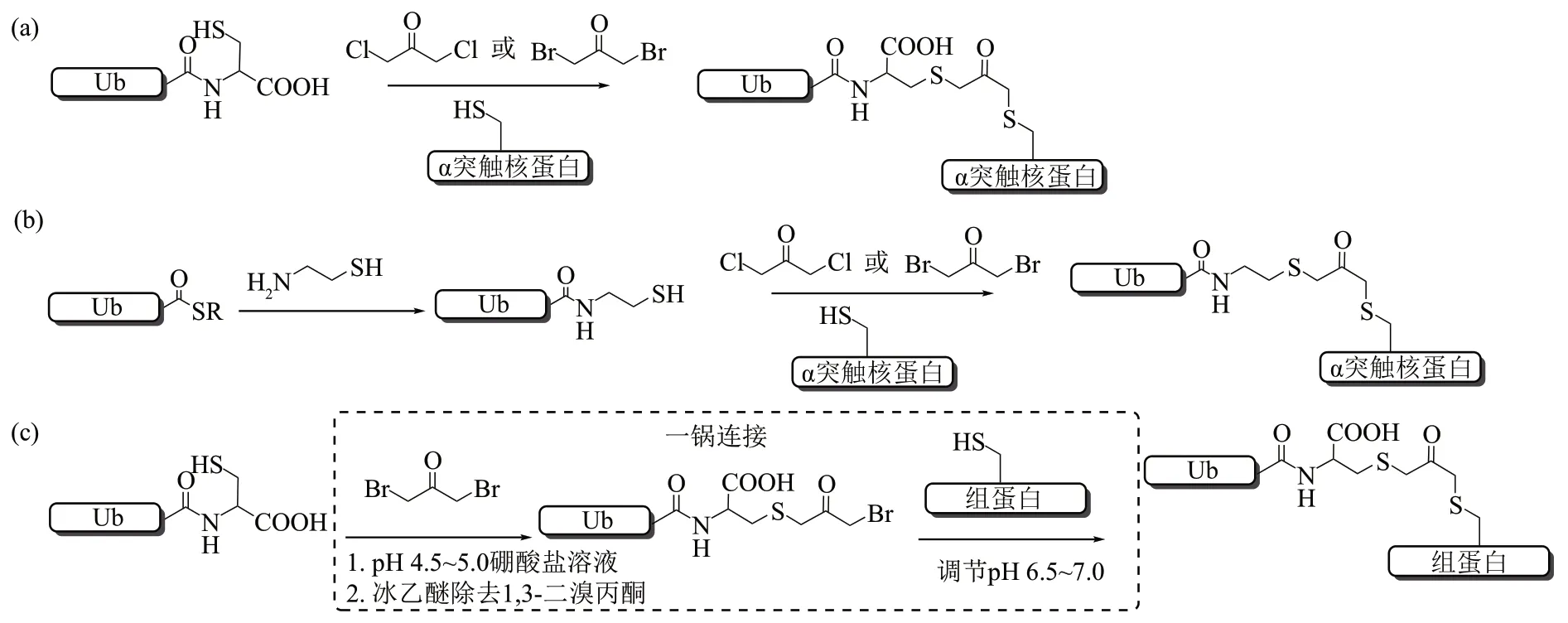
Fig. 16 1,3-Dichloroacetone/1,3-dibromoacetone crosslinking methods for the construction of non-native isopeptide bonds图16 1,3-二氯/溴丙酮交联策略生成非天然异肽键
(3) 叠氮- 炔环加成反应(azide-alkyne cycloaddition reaction,click reaction)
通过点击化学(click chemisty)也可快速实现Ub-conjugate 的制备。Rubini 课题组[104]利用非天然氨基酸嵌入技术将侧链带有炔烃的吡咯赖氨酸类似物嵌入到缀合物蛋白的特定位点,并将叠氮高丙氨酸(azidohomoalanine,Aha)嵌入到泛素C端第76位(图17a)。Mootz课题组[105]则将带有叠氮基团的酪氨酸类似物通过非天然氨基酸嵌入技术将其嵌入到缀合物蛋白的特定位点,同时将炔烃官能团通过Ⅰntein 策略引入到泛素C 端(图17b)。然后,含有炔烃和叠氮这两个正交基团的泛素在铜的催化下发生点击化学反应形成三唑键连接的diUb,并能够抵制DUB的水解。叠氮-炔环加成反应条件相对温和,而且反应具有特异性和高效性,缺点是生成的三氮唑结构与天然异肽键相差较大。
(4)氨乙基化-NCL耦合策略
2019 年,本课题组和Liu 课题组[76]共同开发了Cys-氨乙基化辅助化学泛素化(cysteineaminoethylation-assisted chemical ubiquitination,CAACU)策略合成泛素化的组蛋白(图18a)。该策略是通过Cys-氨乙基化反应将β-氨基卤代物辅基(连接完成后可脱除)装载至组蛋白的特定位点,随后经辅基介导的NCL连接制备泛素化的组蛋白。泛素化组蛋白可以很容易地重组到核糖体中,并被相关作用蛋白选择性地识别。该策略还进一步被用于合成通过传统方法较难获取的K27 连接的三泛素[106]。该策略连接形成的硫醚键与天然异肽键相比,在结构上仅有一个原子的替换,而且化学性质稳定,也可以被DUBs识别和水解,只是在应用时需提前化学合成连接所需的辅基小分子。2020年,Liu 课题组[77]又发展了E1 酶催化的化学酶法策略制备了异肽键-N-乙基化的泛素链(图18b)。该策略也是通过Cys-氨乙基化反应将双功能的氨乙基卤代物分子装载至Ub的特定位点,随后脱去Acm基团后通过NCL反应与Ub硫酯连接,最后进行脱硫产生N-乙基异肽键连接的diUb。此外,当氨乙基化的Ub 分子的C 端同时存在硫酯官能团时,该分子自身可以发生多次聚合形成多聚泛素链,而且该策略还可被用于分叉泛素链和泛素化H2A/cyclin B1的合成[107]。相较于CAACU策略,该策略只需通过简单的化学反应就可获得辅基连接分子,并且制备的泛素化缀合物能够抵制DUB 的水解,还可用于蛋白质组学探查。然而,氨乙基化-NCL 耦合策略都要求缀合物蛋白仅含有一个Cys,而且反应是在变形条件下发生的,需要对形成的Ubconjugate进一步折叠复性。

Fig. 17 Click reaction for the construction of non-native isopeptide bonds图17 点击化学生成非天然异肽键
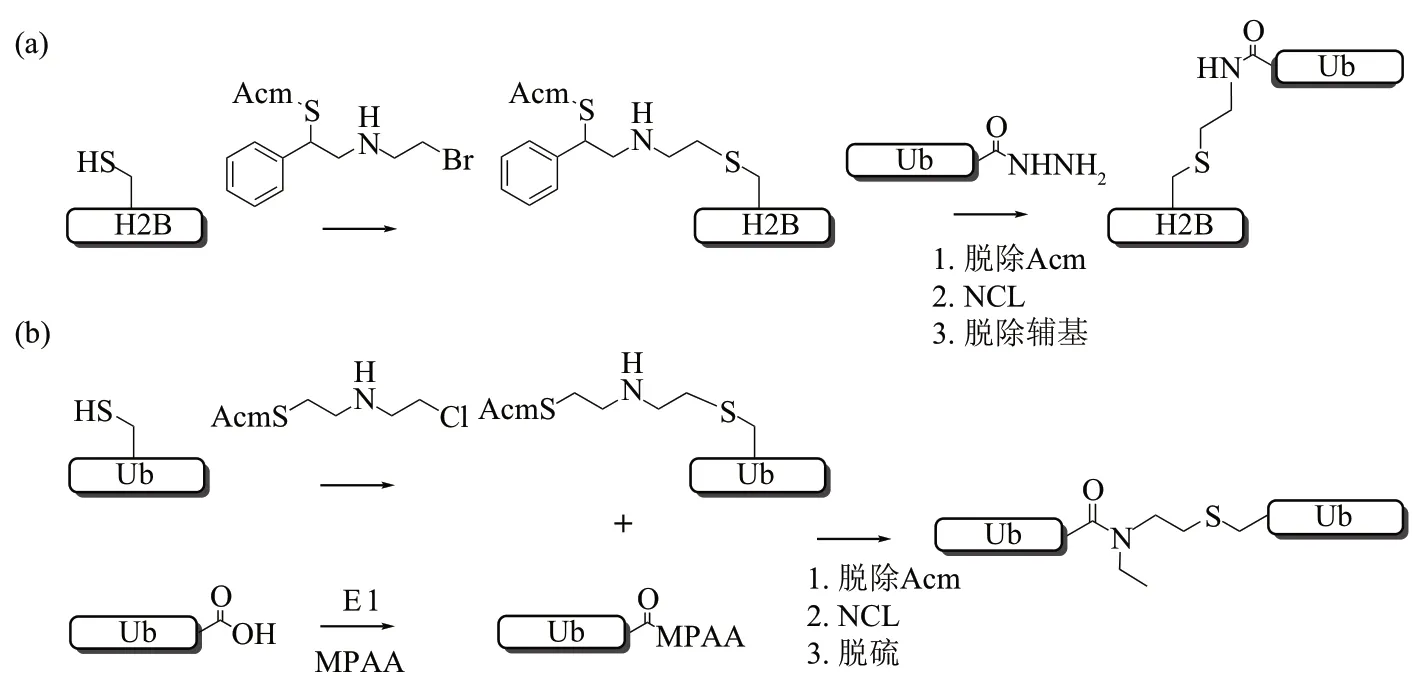
Fig. 18 Aminoethylation-NCL coupling method for the construction of non-native isopeptide bonds图18 氨乙基化-NCL耦合策略生成非天然异肽键
(5)马来酰亚胺与巯基耦合的策略
Brik课题组[108]发展了马来酰亚胺与巯基耦合的策略制备Ub-conjugate(图19)。泛素酰肼经NaNO2氧化后添加N-(2-氨基乙基)马来酰亚胺进行氨解生成末端含有马来酰亚胺基团的泛素蛋白。该蛋白质分子与含巯基的缀合物进行反应即可生成Ub-conjugate。该策略操作简单、条件温和、反应快速高效,5 min 即可达到67%的产率,但是形成的化学键与天然异肽键差异较大。
(6)肟键形成策略

Fig. 19 Maleimide-Cys coupling method for the construction of non-native isopeptide bonds图19 马来酰亚胺与巯基耦合的策略生成非天然异肽键
Brik 课题组[109]发展了由醛-氧胺反应形成肟键的策略制备Ub-conjugate(图20)。泛素硫酯与1,2-双(2-氨基乙氧基)乙烷反应生成C端含有氧胺基团的泛素,同时将连接位点Lys 突变为Cys 的缀合物与氯乙醛反应形成含有醛基的缀合物。然后将两种蛋白质在酸性条件下反应形成肟键连接的Ubconjugate。醛-氧胺反应快速高效,而且肟键能够抵制DUBs 的水解和蛋白酶体的降解。通过该策略,作者合成了mono-/di-/tri-/tetra-Ub-α 球蛋白(α-globin)和分叉di-(di-Ub)-α-globin,并且将这些产物与26S蛋白酶体进行孵育,作者发现,相较于mono-/di-/tri-Ub-α-globin,tetra-Ub-α-globin 能够提供一个很好的水解信号,此外,分叉di-(di-Ub)-α-globin并不能够比tetra-Ub-α-globin对底物进行更有效的降解。这可能是由于tetraUb 封闭的紧凑构象的特点导致其对蛋白酶体上的DUBs的水解有抵抗力从而提供了较长的驻留时间,致使26S蛋白酶体对其有更好的降解。

Fig. 20 Oxime-formation method for the construction of non-native isopeptide bonds图20 肟键形成策略生成非天然异肽键
2.2 引入活性基团制备泛素探针
2.2.1 硫酯氨解法制备mono-Ub-ABP
将mono-Ub C端的硫酯进行氨解可以制备多种mono-Ub-ABP, 如Ub-VS、 Ub-VME、 Ub-VSPh、Ub-VCN、UbBr3、UbBr2、UbCl[29]以及Ub-PA[110]等(图21)。这些mono-Ub-ABP 都可以选择性地与含有活性Cys 的泛素蛋白酶发生反应。其中Ub-Dha的制备无需进行氨解反应,而是大肠杆菌表达出Ub76Cys后,使用2,5-二溴己二酰胺将76位Cys的巯基脱除从而轻松获取[50]。
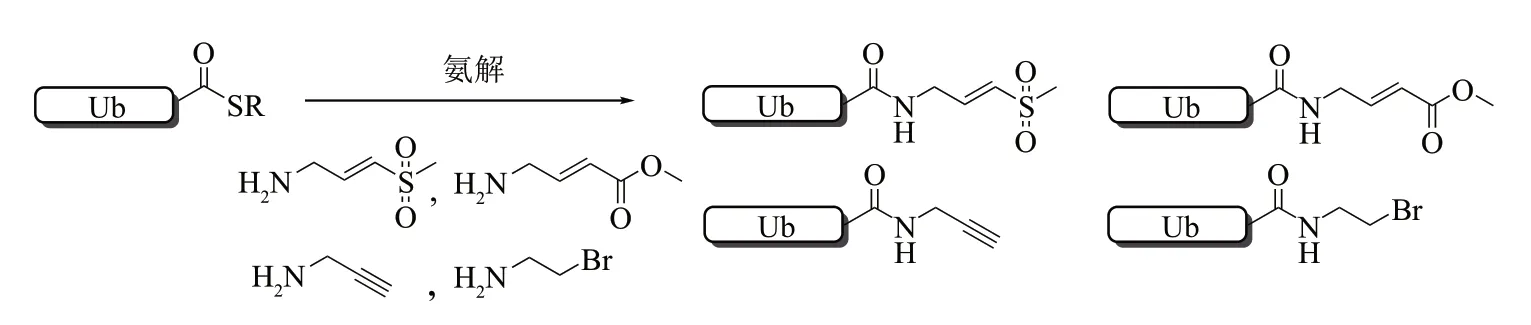
Fig. 21 Preparation of mono-Ub-ABP by thioester aminolysis图21 硫酯氨解法制备mono-Ub-ABP
2.2.2 引入化学活性基团制备Ub-conjugate探针
a. 化学活性基团的引入策略及合成Ubconjugate-ABP
Ub-conjugate-ABP引入的化学反应活性基团大致可以分为3 类。(1)迈克尔受体结构(图22a)。Franke课题组[36]通过SPPS氨基酸耦合策略将含有迈克尔受体结构的甘氨酸乙烯甲酸引入到全保护的多肽序列中,然后将获得的多肽片段对泛素硫酯分子进行氨解制备了第一个diUb-ABP(图22a,Ⅰ)。Kessler课题组[37]直接将带有迈克尔受体结构的分子对泛素末端进行氨解将活性基团添加到泛素分子中,然后与含叠氮的泛素受体进行点击化学反应合成了8 种不同连接类型的diUb-ABP,并应用于DUB 特异性的分析(图22a,ⅠⅠ)。Zhuang 课题组[38]同样通过氨解反应在泛素C 端引入含有迈克尔受体的连接linker,然后与连接位点Lys 突变为Cys 的Ub 发生亲核取代反应制备diUb-ABP(图22a,ⅠⅠⅠ)。Ovaa课题组[40]通过NCL获得diUb后,用2,5-二溴己二酰胺脱硫获得迈克尔受体结构合成了与天然diUb在结构上更为接近diUb-ABP,并证明它们对DUB 具有链选择性(图22a,ⅠV)。Zhuang课题组[41]通过氨解反应在泛素C端引入含有迈克尔受体的分子后,利用位点特异性的E1、E2 酶和亲核取代反应制备了triUb-ABPs,并用来研究DUB 对泛素链进行内、外切水解的特性(图22a,V)。(2)α,β-不饱和氨基酸-Dha(图22b)。Brik 课题组[39]通过利用NCL 随后Dha 形成的方法,开发了基于Dha 的diUb-ABP(图22b,VⅠ)。进一步,为了探索HECT E3 酶的活性,本课题组制备了E2-Ub-Dha的活性探针,该探针能够通过半合成的方法快速获得,而且获取的探针与E3 酶具有很好的交联活性[47]。Chatterjee 课题组[31]利用硒代Cys 的策略制备了含有Dha 的Ub-conjugate-ABP,这使得缀合物中即使含有多个Cys也能够选择性地生成Dha基团(图22b,VⅠⅠ)。(3)PA活性基团(图22c)。Ovaa课题组[34]通过使用点击化学和氨解反应制备了近端泛素C端带有炔基的非水解diUb-ABP,并应用该探针确定了一些DUB对泛素链型特异性的偏好是由S2 口袋介导的(图22c,VⅠⅠⅠ)。
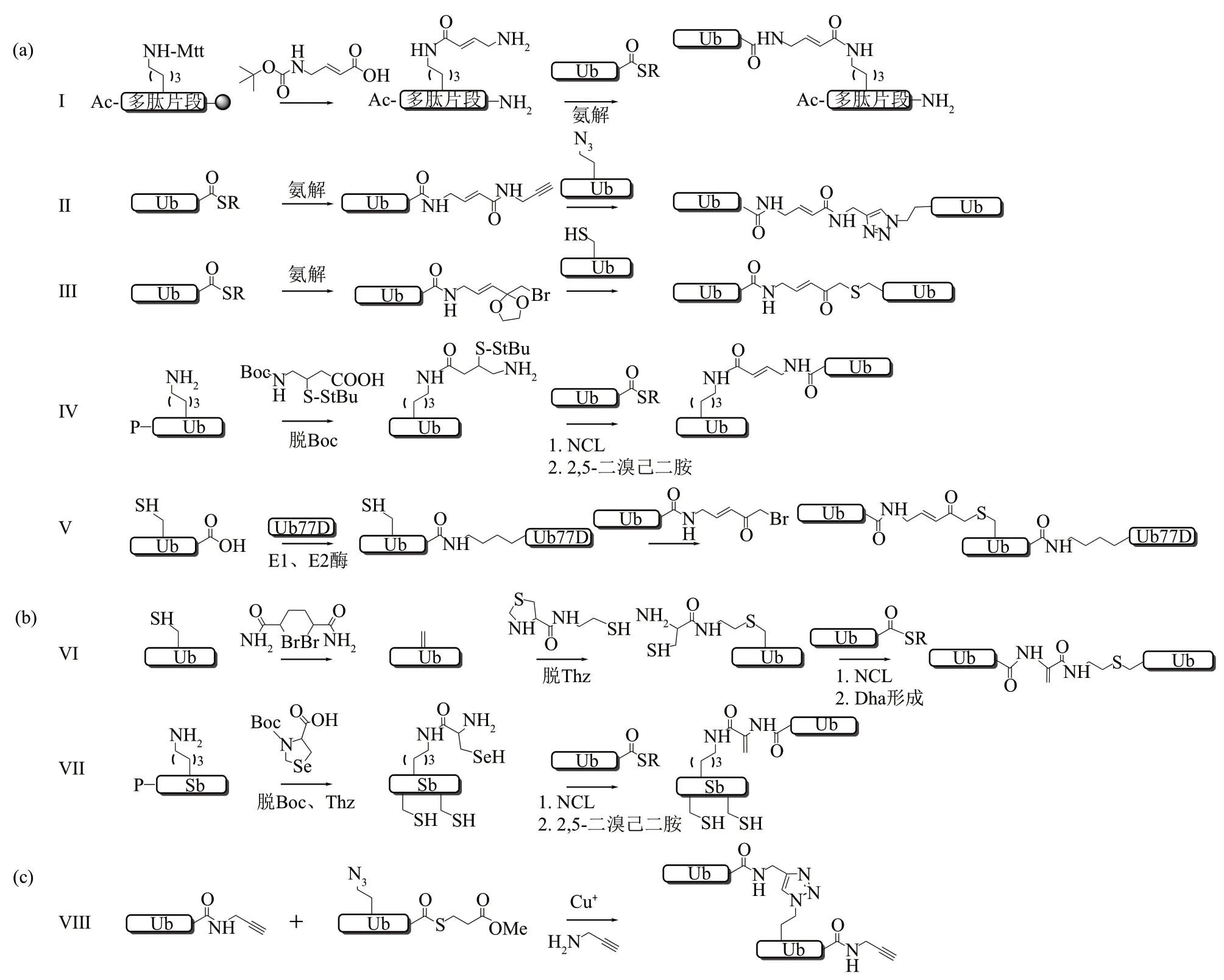
Fig. 22 Preparation of Ub-conjugates ABP图22 Ub-conjugate-ABP的合成
b. 光交联基团的引入策略及合成Ub-conjugate-AfBP
Ub-conjugate-AfBP 引入的光交联反应基团也分为3类。(1)二苯甲酮结构。为了探索多聚泛素链与含UBD 蛋白的识别机制,Cropp 课题组[52]通过使用非天然氨基酸嵌入策略引入二苯甲酮,然后用酶法制备了K48-和K63-diUb-AfBP。为了达到最佳交联效果,作者在Ub 的多个位点引入二苯甲酮基团,然后进行了体外交联验证,作者发现该探针能够交联到大型蛋白Rpn1(图23a)。在对多聚SUMO链进行识别机制的探索时,本课题组也尝试将二苯甲酮通过SPPS构建到di-SUMO的特定位点制备光交联探针[111]。探针不仅在体外能够与RNF4、RNF111 和SENP2 有很好的交联,而且在对HeLa 细胞裂解液进行蛋白质组学研究时发现,di-SUMO 探针能够捕获到一些与单SUMO 作用不同的蛋白质。如40S 核糖体蛋白S3,它对di-SUMO 的亲和力明显高于单SUMO。Zhuang 课题组[112]通过非天然氨基酸嵌入在PCNA的多个位点引入二苯甲酮,然后通过亲核取代反应制备了泛素化的PCNA光交联探针。光交联实验研究发现了多个PCNA 与DNA 聚合酶Polη 作用的位点。二苯甲酮分子的优点是可以根据需要在特定时间进行激发,并且交联效率较芳基叠氮基团强但仍取决于其嵌入位点。(2)芳基叠氮结构(图23b)。Tian 课题组[53]通过亲核取代反应引入芳基叠氮,制备了K48-和K63-diUb-AfBP。然而,作者在体外发现探针并不具有交联特异性,这可能是与基团的引入位点有关。(3)双吖丙啶结构(图23c)。Tian 课题组[53]同样通过亲核取代反应引入烷基双吖丙啶,合成了K48-和K63-diUb-AfBP。经体外实验验证,作者发现探针具有很好的交联特异性。之后,作者将探针进一步用于293F 细胞裂解液的交联,不仅捕获到一些已知作用蛋白,还发现一些与K48-和K63-diUb潜在作用的蛋白。Glickman课题组[54]通过SPPS 将含有双吖丙啶的光亮氨酸嵌入到Ub 中,然后通过泛素酶法制备多聚的泛素AfBP。通过体外的交联验证,作者鉴定了Rpn1 为蛋白酶体第3个与泛素作用的蛋白质。Muir课题组[55]也是通过SPPS将双吖丙啶定点嵌入到Ub中,然而通过二硫键连接的策略制备了H2B-Ub-AfBP,并组装成核小体。通过体外实验,作者发现H2B-Ub 能够与H2A 蛋白进行交联,并进一步确定了H2A 的N 端与Ub 的相互作用激活了hDot1L 的活性并导致hDot1L 在核小体表面的重新定位。双吖丙啶相较于二苯甲酮和芳基叠氮位阻更小,使得研究对象更易保持原有生物活性。此外,双吖丙啶的光稳定性更高,并且使用长波长紫外光(330~370 nm)即可活化。激活后的卡宾具有高化学活性,更利于捕捉目标蛋白。总之,光交联探针可以捕捉到弱的或短暂的蛋白质-蛋白质相互作用,并为探索未知结合蛋白提供了机遇。

Fig. 23 Preparation of Ub-conjugate-AfBP图23 Ub-conjugate-AfBP的合成
3 细胞穿梭型Ub ABP
上述发展的泛素探针通常局限于体外纯净体系和细胞裂解液的环境中。由于细胞裂解会导致原有的细胞环境发生改变——蛋白质稀释、正常组织被破坏以及部分含酶的蛋白质复合物解离致酶失活,这使得科学家们无法对真实的细胞环境中泛素系统酶活有更全面的认知[113]。近年来,随着穿膜技术的发展,更多的细胞穿梭肽(cell pencentrating petide,CPP)被开发出来,并进一步应用于制备细胞穿梭型Ub ABP,这使得原位研究泛素酶活性成为可能。目前,细胞穿梭型Ub ABP大致可分为原位穿膜和时间分辨穿膜Ub ABP[114]。其中,TAT和多聚精氨酸(主要为R10)由于其较好的穿梭活性而被得到广泛使用,尤其是环化后的cTAT 和cR10,刚性结构增加,穿膜效果更强[115-116]。
3.1 原位穿膜Ub ABP
为进一步拓展对DUB 在生理相关环境中生物学功能的认识,Zhuang 课题组[117]将Ub 与CPP 融合构建了穿膜Ub ABP。作者首先通过氨解反应获取Ub-PA,然后二硫键连接cR10 制备了HA-cR10-Ub-PA(图24a)。体外验证其交联活性后,作者又按照类似的合成策略制备了C端带有荧光分子罗丹明(tetraethyl-rhodamine,TER) 的HA-cR10-Ub-MAL-TER。荧光活细胞成像显示,探针能够有效地穿透HeLa 细胞膜。接下来,作者将HA-cR10-Ub-PA分别进行细胞裂解液交联和细胞穿膜的交联实验,蛋白质组学分析后发现,该探针在HeLa 细胞内捕获的DUB 的数量(27 个)比在细胞裂解液中的DUBs(10个)多,这在一定程度上说明了穿膜探针的优势。为了探究S65 位磷酸化对Ub 在细胞中定位和缀合机制的影响,Brik课题组[118]通过SPPS 合成了S65 位磷酸化的Ub,然后二硫键连接cR10制备了磷酸化的CPP-Ub。他们成功地将该泛素递送入活细胞,还发现游离的磷酸化Ub 并非是Parkin 缀合形成多聚Ub 链中的优选底物。为了进一步提高Ub ABP 对细胞的穿透能力,Brik 课题组设计将4-((4-(二甲基氨基)苯基)偶氮)苯甲酸(4-((4-(dimethylamino)phenyl)azo)benzoic acid,DABCYL)与cR10融合,并对Ub和SUMO-2进行穿膜,发现相较于单独的cR10,DABCYL 融合的cR10 可以使Ub 和SUMO-2 穿膜能力提升3倍[119-120]。细胞穿膜Ub ABP 使研究完整细胞内DUB 的活性成为可能,这大大提升了对生理条件下DUB功能和调节机制的理解。
3.2 时间分辨穿膜Ub ABP
原位穿膜Ub ABP 无法对DUBs 的活性进行实时监测,于是可控激活的时间分辨穿膜Ub ABP探针得到进一步发展。Brik 课题组[121]通过NCL 与缩醛反应制备了带有细胞穿梭肽cR10 的噻唑烷(thiazolidine,Thz) 保护的Ubv2.3 醛ABP (图24b)。该探针在穿透细胞膜进入细胞后,不会与细胞内的DUBs发生反应。当在特定时间下使用细胞兼容的Pd试剂使Thz高效断裂后,该探针暴露出C端的醛基,发挥探针的功能作用。作者发现,突变型Ubv2.3探针比天然Ub探针更能对USP2a产生抑制作用,导致MDM2 蛋白的水平下降。然而,醛与DUB 的反应是可逆的,难以对细胞内DUBs 的活性进行大规模筛查。Zhuang 课题组[122]利用氨解和二硫键连接反应开发了一种带有细胞穿梭肽cR10的四氮唑光笼HA-cR10-Ub-UM探针,四氮唑弹头在光激活下可转化为腈亚胺结构,从而被用于研究细胞周期不同阶段(G1/S 期和G2/M 期)的DUBs蛋白组学分析(图24c)。虽然上述发展的两种探针都能够实现Ub ABP 在细胞内的可控激活,然而它们的设计策略均是对Ub ABP活性基团的直接掩蔽,这使得上述方法并不能广泛应用于其他类型Ub ABP的制备,并且针对每一个反应探头都需要发展出对应的掩蔽策略,这是非常耗时且困难的。近期,本课题组[123]通过SPPS 和氨解反应发展了一种通用的方法——在Ub 的Gly75 的酰胺骨架上引入了一个光控的基团以产生位阻效应,暂时阻碍Ub ABP与DUB活性中心的结合从而制备了活性掩蔽的cR10-Ub-PA 探针(图24d)。当受到365 nm 紫外光照射后,掩蔽基团被脱除,从而生成天然的Ub-PA探针并恢复与DUBs交联活性。运用该探针对HeLa 细胞中的DUBs 进行交联发现,分布在细胞质(包括细胞膜、溶酶体、线粒体、内质网、高尔基体)和细胞核中的29 个DUBs 被捕获,并且相较于上述两种探针,Ub-PA能够捕获更多的DUBs。此外,我们还将该策略进一步用于合成cR10-K48/K63-diUb-Dha 探针,并实现了活细胞内K48 diUb特异性DUB OTUB1的功能研究。
CPP 作为一种药物/蛋白质递送技术发展的重要工具,具有生物相容性高、细胞毒性小、入胞转运后可降解的优点[124]。然而,其仍受到多方面因素的影响,例如蛋白质构象、表面电荷分布、疏水性等内在属性以及CPP的选择、连接linker等外在属性。2022年,Brik课题组[125]通过化学方法制备了由两种CPPs (cR10 和DABCYL 修饰的cR10(cR10D))、两种连接linker(二硫键和马来酰亚胺)以及两种Ub 构型(Lys48 和Lys63)组合的8种CPP-diUb 缀合物,以探测这些不同属性对蛋白质细胞递送效果的影响。作者发现,相同cR10D下,二硫键连接的Lys48-diUb 比Lys63-diUb 穿膜效率更高。然而,二硫键替换为马来酰亚胺连接时,两种diUb 的递送效果相似。此外,采用cR10时,二硫键连接的两种diUb 的递送效果也相似。这说明了CPP、linker 以及蛋白质的组合不同可能导致细胞递送效果不同。CPP技术更适用于小型蛋白质的递送,更大蛋白质的递送效果较差或不能穿膜。Hackenberger 课题组[126]以及Vallis 课题组[127]在细胞穿膜时添加富含巯基反应性精氨酸的肽或者添加三环的TAT 提升了蛋白质的细胞摄取,使得150 ku免疫球蛋白G(ⅠgG)抗体传递到活细胞中。然而,由于CPP介导的蛋白质递送缺乏细胞特异性和细胞器靶向性[128],目前的应用仍受到一定的限制。
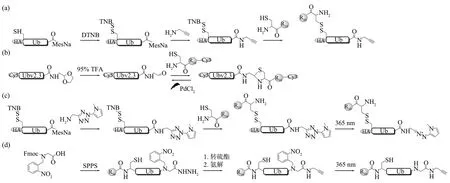
Fig. 24 Preparation of cell-permeable Ub ABP图24 细胞穿梭型Ub ABP及其合成策略
4 总结与展望
本文回顾了近年来泛素探针的发展,包括作用于DUBs、E1s、E2s 和E3s 酶的泛素活性探针以及针对识别蛋白的泛素亲和性探针。还重点介绍了泛素及其缀合物的合成策略以及不同类别化学活性基团引入的策略。此外,总结了近年来涌现的一些细胞穿梭型泛素探针,这种类别的探针提供了一种在真实细胞环境中研究泛素化的方法,可以深入了解泛素化的动态变化、底物特异性和调控机制,然而其目前仍面临一些潜在挑战。譬如,目前开发的都是针对DUB 的泛素穿膜探针,作用于其他泛素酶的穿膜探针尚未开发出来。另外,特异性作用于某一目标蛋白的泛素穿膜探针亟待发展,这有助于对泛素化过程进行准确监测和研究,或将进一步帮助鉴定与泛素化异常相关的疾病。此外,确保泛素穿膜探针在细胞环境中的稳定性以避免被降解或失活也是一个重要的考虑因素,从而保证对监测结果的准确性。预计未来关于时间和空间分辨类的泛素探针将会得到进一步的发展,并有可能推动新型药物的发现。

