调脾安肠方对裸鼠结肠癌肝转移灶miR-34a-5p、Notch1/NF-κB表达的影响
王玉坤 孙适然 张津铖 程志强
结直肠癌(colorectal cancer,CRC)是全球特别是亚洲地区消化系统高发肿瘤之一[1]。肝脏为CRC最常侵犯的脏器[2],结肠癌肝转移(colorectal cancer liver metastasis,CLM)是导致CRC高死亡率的重要因素,临床疗效尚不理想。微小RNA(microRNA,miRNA)被视为癌症治疗的新兴候选者。研究发现异位表达的MicroRNA-34a(miR-34a)能通过抑制CRC细胞增殖、迁移等途径干预CLM的进程[3]。目前对miR-34a及其下游靶基因在CLM上的基础研究较少。
Notch1是肿瘤坏死因子超家族的成员,在结肠癌、乳腺癌等肿瘤组织中高表达;核转录因子-κB(nuclear factor-kappa B,NF-κB)是Notch1的下游靶点,Notch1/NF-κB信号轴与CRC恶性潜能及CLM进展程度密切相关。笔者通过文献[4]及TargetScan分析证实miR-34a与Notch1的3’UTR高度同源配对,miR-34a能通过介导Notch1信号通路抑制乳腺癌细胞生长。那么,Notch1是否也是miR-34a在CLM中的潜在靶基因,亟待探索。
CLM中医归属“积聚”“传舍”等范畴。文献及前期研究发现CLM患者的中医证型以脾气亏虚为主,临证治宜健脾益气[5-9]。中日友好医院院内制剂调脾安肠方以益气健脾为总法,兼具化湿解毒、疏肝养血之功,临床疗效确切,但作用机制尚不明晰。本研究拟通过构建脾脏注射结肠癌HCT-116细胞法构建裸鼠CLM模型,观察使用调脾安肠方前后裸鼠肝病理组织中miR-34a-5p、Notch1/NF-κB信号轴的表达变化,探讨调脾安肠方防治CLM的可能分子机制。
1 材料与方法
1.1 实验动物及实验环境
SPF级雄性Balb-c裸鼠30只,5~6周龄,体质量(20±5)g,购自斯贝福(北京)生物技术有限公司(动物合格证号:NO.110324221100912737)。动物于中日友好临床研究所无特殊病菌的SPF级环境饲养[许可证号:SYXK(京)2010-0011],室温(20±2)℃,相对湿度为(65±5)%,自然光暗周期,正常饮食。动物实验遵照《中华人民共和国实验动物管理条例》,并通过中日友好医院伦理委员会审查批准(zryhyy61-21-03-54)。
1.2 实验药物
调脾安肠方药物组成:黄芪15 g、党参10 g、茯苓10 g、生薏米10 g、炒山药10 g、莲子肉10 g、砂仁6 g、佛手10 g、香橼10 g、马齿苋10 g、炒白扁豆10 g、炒山楂10 g、枸杞子10 g、黄精10 g、沙棘6 g、炒鸡内金10 g、炙甘草6 g、大枣5 g。中药饮片购自中日友好医院,水煎,浓缩至含生药2 g/mL(按成人和小鼠等效剂量换算,约为成人临床用量的8倍[10])。
1.3 主要实验试剂
HCT-116-LUC-tdT细胞株来源于国家生物医学实验细胞资源库。伊红染色液(批号:MD911477,北京百奥思科),蛋白定量(protein quantification kit,BCA)试剂盒(批号:MD913053,北京百奥思科),聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜(批号:ISEQ00010,美国Millipore公司),蛋白质中分子量marker(批号:26617,美国THERMO公司)。目的一抗:兔抗鼠Notch1抗体和兔抗鼠NF-kB p65抗体(批号分别是ab52627、ab16502,英国Abcam公司),内参β-actin抗体(批号:AF7018,美国Affinity公司)。RNA提取试剂盒(TRIZOL,批号:10296028,美国ABI-invitrogen公司),UltraPure Agarose(批号:16500100,美国ABI-invitrogen公司),SuperScript III RT 逆转录kit(批号:11752050,美国ABI-invitrogen公司),Sybr qpcr mix(批号:11752050,美国ABI-invitrogen公司)。
1.4 主要实验仪器
光学显微镜(德国Leica公司,型号:DM3000),高速冷冻离心机(美国THERMO公司,型号:LEGEND MICRO 21R),电热恒温水浴槽(上海一恒恒温设备厂,型号:HWS-24),蛋白垂直电泳仪(北京百晶生物技术有限公司,型号:BG-subMIDI),分光光度计(美国THERMO公司,型号:Nanodrop lite),低温高速离心机(美国SCILOGBX公司,型号:D3024R),荧光定量PCR仪(美国ABI公司,型号:StepOne Software),全自动化学发光图像分析系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100)。
1.5 实验方法
30只裸鼠适应性饲养1周后,采用随机数表法分为空白组、模型组、中药组,每组10只。除空白组外,其余各组裸鼠用脾脏原位注射HCT-116-LUC-tdT细胞法建立CLM模型[11]。采用0.3%戊巴比妥钠溶液0.1 mL/10 g腹腔注射麻醉裸鼠,约3~5分钟麻醉成功后,将实验动物固定在小动物手术台上。碘酒腹部术前消毒,打开裸鼠腹腔,找到柳叶状脾脏,牵引出体外,用微量注射器吸取含悬好的HCT-116-LUC-tdT单细胞液0.2 mL(细胞数约为1×107个/mL)轻缓地注射进脾脏内,拔针后用酒精棉签按压针口,同时轻压脾脏使癌细胞经脾静脉进入肝脏。检查无出血后,把脾轻缓地移回腹腔内,关闭腹腔,在缝合处抹碘酒消毒,放到保温毯上等待苏醒。接种后正常饲养2周。
2周后将模型组与中药组裸鼠予异氟烷吸入麻醉后,腹腔注射50 μL荧光素钾盐(50 mg/mL),固定裸鼠,将活体成像仪调整参数到荧光素酶通道,曝光时间1分钟,观察肝转移模型。活体成像结果证实肝转移瘤模型成模后,中药组予调脾安肠方(2 g/mL)灌胃给药0.2 mL,每日一次;空白组及模型组予等体积0.9%生理盐水0.2 mL灌胃,每日一次,共2周。(因疫情检测时间延迟,空白组检测5只;模型组:成模5只,检测3只;中药组:成模9只,检测5只。)
1.6 标本采集
末次灌胃后禁食不禁水24小时,采用脱颈法处死裸鼠,打开腹腔,剪下脾脏,放入10 mL离心管中,固定液固定。取出肝脏,将最大叶剪下放入10 mL离心管,采用4%多聚甲醛固定,用于病理切片制备,剩余肝组织放入1.5 mL冻存管,经液氮桶速冻后-80℃冰箱保存,以备后续分子生物学检测。
1.7 检测指标
1.7.1 苏木素—伊红(hematoxylin-eosin,HE)染色观察肝脏病理组织形态 肝脏组织固定后,经脱钙和80%、90%、95%、100%浓度乙醇梯度脱水后进行石蜡包埋、切片,二甲苯脱蜡,100%、95%、90%、80%、70%浓度乙醇梯度顺序脱水,蒸馏水洗;苏木素染色3~8分钟,伊红染色1~3分钟,随后梯度脱水透明、干燥、封片;于100、400倍显微镜下观察肝脏组织形态变化,并采集图片。
1.7.2 蛋白免疫印迹法(Western Blot)检测肝脏病理组织Notch1、NF-κB p65蛋白表达 取肝病理组织0.1 g,液氮匀浆后加入裂解液(PMSF+RIPA)后匀浆、4℃,12 000r/min离心15分钟后取上清,使用BCA蛋白定量试剂盒测定蛋白浓度,蛋白上样Buffer将蛋白定量为5 mg/mL;采用SDS-PAGE凝胶电泳分离总蛋白(80 V);通过转移电泳方式转移蛋白至PVDF膜上(65 V,2小时);摇床上常温使用封闭液(TBST+脱脂奶粉)封闭1小时,洗膜(3次,每次10分钟);孵育一抗(1∶1 000),4℃冰箱过夜,同上洗膜;孵育二抗(1∶5 000),室温摇床1小时,同上洗膜;ECL试剂盒中两种发光液等比混合,均匀铺在PVDF膜表面,室温作用4分钟。弃去膜上液体,放入化学发光成像系统,采集数据。
1.7.3 实时荧光定量PCR检测肝脏病理组织中miR-34a-5p及Notch1、NF-κB p65的mRNA表达 称取肝组织100 mg加液氮研磨,用1mL trizol室温裂解5分钟,4℃下,12 000 r/min离心(离心半径7 cm)10分钟,吸取上清液,加入700 μL异丙醇,充分震荡混匀,室温孵育3分钟,4℃下,12 000r/min离心(离心半径7 cm)10分钟;弃去上清液,加75%乙醇洗涤沉淀一次,室温晾干;加入50 μL DEPC水溶解RNA沉淀;洗脱RNA并测纯度、浓度跑胶鉴定。取1 μg RNA进行逆转录,制备cDNA模板。依照试剂盒说明书进行实时荧光定量PCR检测,miR-34a-5p以u6基因(u6)为内部参照基因;Notch1、NF-κB p65 mRNA以β-actin为内部参照基因。引物序列见表1,采用两步法进行PCR扩增。测定并分析miR-34a-5p及Notch1、NF-κB p65 mRNA相对表达量。

表1 实时荧光定量PCR引物序列
1.7 统计学处理

2 结果
2.1 肝脏组织病理形态学情况
各组裸鼠肝组织经HE染色后100倍光镜下观察,与空白组比较,模型组裸鼠肝脏组织中可见大面积嗜碱性瘤灶,其内细胞排列紊乱,肿瘤细胞呈浸润性生长,与正常肝组织分界不清;与模型组比较,中药组裸鼠肝脏组织中瘤灶面积明晰缩小,呈膨胀性生长,与正常肝组织分界较清。400倍光镜下,空白组裸鼠肝脏病理组织中肝细胞形态规则,细胞核、细胞质着色均一,核分裂像罕见;与空白组比较,模型组裸鼠肝脏组织瘤灶内肿瘤细胞排列紊乱,细胞核及细胞质着色不均一,可见大量病理性核分裂象;与模型组比较,中药组裸鼠肝脏瘤灶内肿瘤细胞可见少量病理性核分裂象。见图1。

注:红色圆圈所示为结肠癌肝转移灶中肿瘤细胞病理性核分裂象。
2.2 肝脏组织Notch1、NF-κB p65蛋白表达情况
与空白组比较,模型组裸鼠肝脏组织中Notch1、NF-κB p65蛋白表达显著上调(P<0.05)。与模型组比较,中药组裸鼠肝脏病理组织中Notch1蛋白表达显著降低(P<0.05);NF-κB p65蛋白表达降低,但组间差异无统计学意义(P>0.05)。见图2,表2。

注:A 空白组;B 模型组;C 中药组。
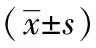
表2 各组裸鼠CLM模型肝脏组织中Notch1、NF-κB p65蛋白表达情况
2.3 肝脏组织miR-34a-5p及Notch1、NF-κB p65的mRNA表达情况
与空白组比较,模型组裸鼠肝脏组织中miR-34a-5p表达显著下调(P<0.01);Notch1、NF-κB p65的mRNA表达显著上调(均P<0.01)。与模型组比较,中药组裸鼠肝脏组织中miR-34a-5p表达升高,但组间差异无统计学意义(P>0.05);Notch1、NF-κB p65的mRNA表达显著降低(P<0.05,P<0.01)。见表3。
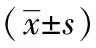
表3 各组裸鼠CLM模型肝脏组织中miR-34a-5p及Notch1、NF-κB p65 mRNA表达情况
2.4 肝脏组织miR-34a-5p和Notch1 mRNA表达水平的相关性情况
如图3所示,应用调脾安肠方后裸鼠肝脏病理组织中miR-34a-5p表达上调、Notch1 mRNA表达下调,二者表达水平呈负相关(r2=0.8845,P<0.05)。

图3 miR-34a-5p和Notch1 mRNA表达水平的相关性情况
2.5 肝脏组织Notch1和NF-κB p65的mRNA表达水平相关性情况
如图4所示,应用调脾安肠方后裸鼠肝脏组织中Notch1 mRNA表达下调,NF-κB p65 mRNA表达显著下调,二者表达水平呈正相关(r2=0.9291,P<0.01)。

图4 Notch1和NF-κB p65的mRNA表达水平相关性情况
3 讨论
CLM在历代古籍中并无明确病名记载,据其中医证候特点,可纳入中医“黄疸”“积聚”“鼓胀”“传舍”等病证范畴。诚如张景岳所云“凡脾胃不足及虚弱失调之人多有积聚之病……正气不行则邪滞得以居之”,CRC患者以脾气亏虚为病理基础,脾虚则运化失司,痰湿、瘀血、热毒搏结,日久而成有形癌肿。患者由于疾病的进展或手术、药物治疗后,中焦正气常常会进一步受损,一方面,机体化生精微乏源,肝木枯竭,癌毒易于侵袭此至虚之处;另一方面,湿邪久滞化热,湿热胶着,壅遏气机,加之肝血本虚,导致随血液入侵的癌毒因肝内血流速度缓慢而易于稽留,形成传舍。据此,脾虚是CLM发病的重要病机,亦是该病持续进展的关键病机。
调脾安肠方以益气要药党参、黄芪为君;茯苓、炒山药、生薏米、莲子、炒白扁豆、砂仁健脾化湿,共为臣药,固守中州,助君药健后天之本;佛手、香橼疏肝醒脾,行气化痰;焦山楂、鸡内金消导助运,调畅气机;马齿苋解肝经热毒,清利湿热;枸杞、黄精、沙棘滋肝阴、养肝血,诸药为佐;甘草、大枣健脾和中、调和药物为使。全方用药平和,攻伐有道,健脾益气和中以复中焦正气,行气化湿兼益肝养血以调理肝脏的病理状态,符合“肝病实脾,肝脾同调”之道。CLM的临床预后差,未经治疗者的中位生存期仅有6.9个月[12]。目前手术是CLM西医首选治疗手段,但其获益人群有限。因此,探索CLM发生发展过程中的分子机制,并以此为钥匙解开中医学确切疗效的奥秘,将对挽救和延长患者生命具有深远意义。
本研究采用脾脏原位注射HCT-116-LUC-tdT结肠癌细胞法复制裸鼠CLM模型,结果显示与空白组比较,模型组裸鼠肝脏组织中可见大面积嗜碱性瘤灶,肿瘤细胞呈浸润性生长,病理性核分裂象多见;与模型组比较,调脾安肠方中药组裸鼠镜下瘤灶面积明显缩小,肿瘤细胞呈膨胀性生长,病理性核分裂象较之减少。这提示调脾安肠方能抑制CRC细胞分裂,降低其侵袭、迁移能力,防止其进一步向外周浸润,从而延缓裸鼠结肠癌肝转移进程。此结果与前期文献结论相契合,即健脾益气治法在CRC患者肝转移防治方面发挥积极作用[13-14],健脾中药能够从多层面实现抑制结肠癌细胞增殖、迁移,促进凋亡[15-16]。
miRNA是一类高度保守的内源性单链非编码RNA,可通过与靶基因的信使RNA(messenger RNA,mRNA)3'-UTR发生结合,进而在诸多肿瘤中作为原癌基因或肿瘤抑制因子异常表达,并介导下游广泛靶基因的调控参与疾病的发生、发展[17],被视为近年来肿瘤研究的热点机制之一。miR-34a定位于染色体1q36.22,是首个被证实由抑癌基因p53直接调控的miRNA,在正常组织中高表达,在众多肿瘤中受到抑制[18]。临床试验发现miR-34a-5p在CRC组织中的表达显著低于癌旁组织,且随患者TNM分期和疾病进展呈下降趋势[19]。进一步的离体实验证实miR-34a在CRC细胞中的表达缺失引起结肠癌干细胞/祖细胞增多,导致癌细胞侵袭性发展[20];上调miR-34a表达能够使细胞周期阻滞在G0/G1和S期之间,从而抑制CRC细胞增殖[21]。本研究结果表明,与空白组裸鼠相比,模型组肝脏病理组织中miR-34a-5p表达显著降低,应用调脾安肠方后中药组裸鼠miR-34a-5p表达较模型组改善,但组间差异无统计学意义,考虑样本量较少导致。
Notch蛋白是一种跨膜蛋白,作为细胞膜表面受体在细胞间信号传导过程中发挥不可小觑的作用[22]。研究表明Notch信号通路为肿瘤细胞中最活跃的通路之一,其介导的相关因子的失调,是肿瘤生长和转移的重要驱动因素[23]。四个受体中Notch1被报道与CRC最为相关,其能通过决定肠道干细胞的分化方向影响肠道粘膜屏障,进而参与CRC的发生和发展[24]。临床研究发现,从正常结肠粘膜组织到原发性和转移性结肠癌患者的病理组织,Notch1的表达呈进行性增加[25]。此结论与细胞层面的结果吻合,即Notch1信号通路在人原发性CRC细胞系中被异常激活,令后者的增殖、侵袭与迁移能力增强,促进远处转移的发生[26]。
NF-κB为促炎、诱导免疫反应的经典信号,是Notch1的下游靶点。活化的NF-κB过度表达,通过结合启动子和增强子中不连续的DNA序列,调控基因表达,增强炎症粘附性,加速肿瘤细胞分化、增殖、血管生成,抑制凋亡[27-29],因而作为关键炎症介质参与CRC的起始、进展和转移。研究数据表明,Notch1和NF-κB在CRC患者病理组织中异常表达,并与患者组织分化程度、淋巴结转移及Dukes分期相关[30]。Notch1/NF-κB信号通路的异常激活促进CRC细胞的增殖、迁移和血管生成,活化水平与CRC进展程度相关,调控其转录与表达能够促进CRC细胞的凋亡影响CLM的发生[31-32]。
本研究结果显示,与空白组比较,模型组裸鼠肝脏组织中Notch1、NF-κB p65蛋白及mRNA表达均显著上调;中药组裸鼠Notch1、NF-κB p65蛋白及mRNA表达呈不同程度降低。进一步相关性分析发现,中药组裸鼠肝脏病理组织中Notch1 mRNA与miR-34a-5p表达水平呈负相关,与NF-κB p65 mRNA表达水平呈正相关。
综上所述,本研究提示Notch1为miR-34a-5p直接靶基因,调脾安肠方可以基于miR-34a-5p,靶向负性调节Notch1/NF-κB通路表达,抑制裸鼠CLM过程。研究不足之处在于未能解释调脾安肠方具体以何种方式上调CRC细胞表达miR-34a-5p,需大样本实验进一步探索。

