益气化瘀解毒方对急性呼吸窘迫综合征大鼠肺损伤及中性粒细胞粘附分子的作用研究
邹乔 李雁 陈瑜 孔煜荣 陈一凡 刘通 曾燕鹏 沈冠彤
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是由肺内/肺外原因冲击所导致的急性低氧性呼吸功能不全或衰竭,临床表现为顽固性低氧血症和呼吸窘迫等,病死率超过40%[1]。临床治疗以肺保护通气和保守液体管理为主,至今仍无特异性治疗策略[2]。尽管其发病机制尚不明确,但大多数研究认为以中性粒细胞为主的促炎细胞大量活化,跨内皮迁移至肺间质、肺泡腔内,释放过量炎性介质,介导肺泡—毛细血管通透性破坏,是ARDS的关键环节[3]。其中,中性粒细胞粘附是跨内皮迁移的必要条件,也是诱导ARDS炎症早期反应的重要节点[4]。
Rap1b是小G蛋白Ras家族的重要成员,是调节中性粒细胞粘附的重要蛋白,主要通过激活整合素变构介导中性粒细胞粘附过程[5-6]。益气化瘀解毒方是国家级名老中医、首都国医名师杜怀棠教授总结多年诊疗ARDS经验所得的临床效方。前期研究表明益气化瘀解毒方可显著改善脂多糖(lipopolysaccharide, LPS)诱导的ARDS模型大鼠肺组织损伤,并调节炎症通路蛋白及炎症因子[7-9]。本研究拟观察益气化瘀解毒方对ARDS大鼠中性粒细胞粘附的影响,以期进一步探讨益气化瘀解毒方在ARDS肺损伤以及炎症过程中的保护作用与机制。
1 材料与方法
1.1 实验动物
36只健康SPF级雄性SD大鼠,6~7周龄,体质量(180±10)g,购自北京华阜康生物科技股份有限公司,实验动物许可证号:SCXK(京)2019-0008。动物饲养于北京中医药大学东直门医院实验动物中心屏障实验室,每笼6只,普通饮食,温度22~24℃,湿度50%~70%。动物适应性喂养7天后进行实验。本次动物实验经由北京中医药大学东直门医院实验动物福利与伦理委员会审批通过(审批编号:19-54)。
1.2 药物、试剂与仪器
益气化瘀解毒方(黄芪30 g、三七10 g、赤芍15 g、炒枳实12 g、金银花15 g、黄芩10 g、桑白皮15 g、葶苈子15 g)、益气化瘀解毒方拆方“益气清热方”(黄芪30 g、黄芩10 g、金银花15 g)、拆方“益气化瘀方”(黄芪30 g、三七10 g、赤芍15 g)及拆方“益气逐饮方”(黄芪30 g、葶苈子15 g、桑白皮15 g、炒枳实12 g),由中国中医科学院药物研究所提供并制成中药浸膏,批号:20191030。
大肠杆菌脂多糖LPS(Sigma,L6511);Rap1b rabbit polyclonal antibody(Proteintech,10840-1-AP);大鼠Rap1b、淋巴细胞功能相关抗原1(leukocyte function-associated antigen-1,LFA-1)、巨噬细胞表面抗原-1(macrophage surface antigen-1,MAC-1) ELISA试剂盒(MB-7121A/ MB-7115A/ MB-7119A,江苏酶标生物科技有限公司);BH2光学显微镜(OLYMPUS);高速离心机(Thermo); Varioskan Flash光谱扫描多功能读数仪(Thermo Scientific)。
1.3 动物分组及给药
将大鼠随机分为对照组、模型组、益气清热组、益气化瘀组、益气逐饮组、中药全方组,每组6只。结合既往实验研究确定的最佳给药剂量,按12.2 g/(kg·d)(给药剂量为生药剂量)用蒸馏水将中药浸膏配制为中药溶液,益气清热组、益气化瘀组、益气逐饮组、中药组给予对应中药浸膏灌胃,连续灌胃7天;对照组及模型组给予等剂量蒸馏水灌胃,每日1次,连续灌胃7天。
1.4 ARDS大鼠模型制备
结合既往实验研究确定的最佳造模时间及剂量,在第7天灌胃6小时后,模型组和各中药给药组给予尾静脉注射LPS(2 mg/kg)制备ARDS模型,对照组给予等量0.9%氯化钠溶液进行尾静脉注射。六组均于注射16小时后以3%戊巴比妥钠(0.1 mL/100 g)腹腔注射麻醉,进行取材。
1.5 样本取材
分别收集各组肺组织,步骤如下:大鼠开胸,生理盐水灌注后取肺组织,右下肺用10%多聚甲醛溶液固定用于组织病理学检测,右上肺置于无RNA酶EP管,冻于-80℃冰箱保存,左肺则用于收集肺泡灌洗液。分别收集各组肺泡灌洗液,步骤如下:开胸结扎右肺门后,用PBS反复清洗左肺3次,回收所有冲洗液,然后将冲洗液离心(4℃,3 000r/min)10分钟,取上清液置于-80℃冰箱中保存。
1.6 组织病理学形态检测
取保存于10%多聚甲醛溶液中的右下肺组织,脱水后进行石蜡包埋。采用苏木精—伊红(hematoxylin-eosin,HE)染色观察肺组织病理学形态变化。
1.7 ELISA法检测肺泡灌洗液和肺匀浆中Rap1b、LFA-1、MAC-1蛋白表达水平
采用ELISA法检测肺泡灌洗液中Rap1b、LFA-1及MAC-1含量,严格按照ELISA试剂盒中说明书操作。将冻存的肺组织室温解冻,加入冰盐水进行漂洗后用滤纸吸干,称重;按重量(g)∶体积(mL)为1∶9的比例加入匀浆介质,在冰浴条件下快速将肺组织块剪碎,手动匀浆6~8次,制备10%的肺组织匀浆。然后将肺组织匀浆离心(4℃,2 500r/min)10分钟,取上清液,严格按照ELISA试剂盒中说明书操作。
1.8 Western blotting法检测肺匀浆中Rap1b表达水平
研磨剪碎的肺组织,4℃、10 000 r/min离心15分钟,取上清液,BCA法检测总蛋白浓度并配平,加入蛋白上样缓冲液,100℃沸水浴5分钟。制备分离胶和浓缩胶,进行蛋白上样、电泳、转模分离目标蛋白,5%的脱脂奶粉封闭摇床1小时。加入一抗稀释液(1∶2 000),使其充分浸泡,4℃孵育过夜,TBST洗膜3次,每次10分钟,加入相应稀释二抗(1∶10 000),于24℃恒温摇床孵育1小时,TBST洗膜3次,每次10分钟,ECL法显影成像并分析。
1.9 统计学方法

2 结果
2.1 肺组织病理学情况
HE染色显示,对照组大鼠的肺组织病理可见肺泡结构清晰完整,肺泡腔及肺间质无充血水肿,未见炎性细胞浸润;模型组大鼠肺泡及肺间质水肿明显,肺泡壁增厚,部分肺泡塌陷,伴随有大量炎性细胞浸润;各拆方组较模型组肺组织损伤程度有所减轻,肺泡腔塌陷改善,出血、渗出减少;中药全方组较模型组大鼠肺组织损伤程度明显减轻,肺泡及肺间质水肿改善,肺泡结构较完整,塌陷较少,炎性细胞浸润及出血点减少。见图1。

注:A 对照组;B 模型组;C 益气清热组;D 益气化瘀组;E 益气逐饮组;F 中药全方组。
2.2 肺泡灌洗液和肺匀浆中Rap1b、LFA-1、MAC-1蛋白表达水平
2.2.1 各组大鼠肺泡灌洗液中性粒细胞粘附调节蛋白Rap1b表达水平比较 与对照组相比,模型组大鼠的肺泡灌洗液中Rap1b表达水平显著升高(P<0.01);与模型组相比,益气清热组、益气化瘀组、益气逐饮组和中药全方组大鼠的肺泡灌洗液中Rap1b表达水平均显著降低(P<0.01)。见表1。

表1 各组大鼠肺泡灌洗液中Rap1b表达水平比较
2.2.2 各组大鼠肺泡灌洗液中性粒细胞粘附分子LFA-1及MAC-1表达水平比较 与对照组相比,模型组大鼠的肺泡灌洗液中,LFA-1表达水平显著升高(P<0.05);与模型组相比,各拆方组及中药全方组大鼠的肺泡灌洗液中LFA-1表达水平有所降低,而中药全方组降低最为明显,但差异均无统计学差异(P>0.05)。与对照组相比,模型组大鼠的肺泡灌洗液中MAC-1表达水平显著升高(P<0.05);与模型组相比,益气清热组和中药全方组大鼠的肺泡灌洗液中MAC-1表达水平显著降低(P<0.05)。见表2。

表2 各组大鼠肺泡灌洗液中LFA-1及MAC-1表达水平比较
2.2.3 各组大鼠肺匀浆中性粒细胞粘附调节蛋白Rap1b表达水平比较 与对照组相比,模型组大鼠的肺匀浆中Rap1b表达水平显著升高(P<0.05);与模型组相比,各拆方组及中药全方组Rap1b表达水平均有不同程度下降,但仅益气逐饮组具差异有统计学意义(P<0.05)。见表3。

表3 各组大鼠肺匀浆中Rap1b表达水平比较
2.2.4 各组大鼠肺匀浆中性粒细胞粘附分子LFA-1及MAC-1表达水平比较 与对照组相比,模型组大鼠的肺匀浆中LFA-1表达水平显著升高(P<0.01);与模型组相比,各拆方组及中药全方组大鼠的肺匀浆中LFA-1表达水平均显著降低(P<0.05)。与对照组相比,模型组大鼠的肺匀浆中MAC-1表达水平升高,但无统计学差异(P>0.05);与模型组相比,各拆方组及中药全方组大鼠的肺匀浆中MAC-1表达水平均有所降低,但无统计学差异(P>0.05)。见表4。

表4 各组大鼠肺匀浆中LFA-1及MAC-1表达水平比较
2.3 WB法检测肺匀浆中Rap1b表达水平
与对照组相比,模型组大鼠的肺匀浆中Rap1b表达水平有所升高,但无统计学差异(P>0.05);与模型组相比,益气化瘀组大鼠的肺匀浆中Rap1b表达水平显著降低(P<0.05),其他拆方组及中药全方组Rap1b表达水平均有所降低,但无统计学差异(P>0.05)。见表5及图2。
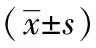
表5 各组大鼠肺匀浆中性粒细胞粘附调节蛋白Rap1b表达水平比较

注:A 对照组;B 模型组;C 益气清热组;D 益气化瘀组;E 益气逐饮组;D 中药全方组。
3 讨论
ARDS的核心病理机制是失控的炎症级联反应导致肺毛细血管内皮细胞、肺泡上皮细胞的屏障功能被破坏,其病情严重程度与中性粒细胞迁移到肺泡及肺毛细血管内的数量呈正相关[10]。中性粒细胞粘附是中性粒细胞跨内皮迁移至肺泡腔的始动环节,抑制该环节可有效截断其后续的跨内皮迁移过程,进而延缓炎症反应进展[11]。
Rap1属于小鸟嘌呤核苷酸结合蛋白(小G蛋白)Ras超家族成员之一,具有调节细胞极性、粘附运动等生物学功能[12]。Rap1b是中性粒细胞Rap1的主要亚型,可调节细胞粘附的动态变化[13],是抑制炎性刺激下中性粒细胞肺内募集活化、跨内皮迁移的关键蛋白[14]。整合素是一类细胞粘附分子,介导细胞和细胞之间及细胞和细胞外基质之间的相互识别和粘附[15],是重要的细胞“黏合剂”。而中性粒细胞主要表达LFA-1和MAC-1两种整合素[16],均可与内膜上的细胞间粘附分子1(intercellular cell adhesion molecule-1,ICAM-1)结合,介导中性粒细胞与内皮粘附[17]。本实验发现模型组大鼠肺泡灌洗液、肺匀浆中Rap1b、LFA-1及MAC-1蛋白表达水平较对照组均有明显上调,提示ARDS发病与中性粒细胞粘附活动增强关系密切。
杜怀棠教授认为ARDS的关键病机在于肺气虚衰、毒瘀互阻、肺气壅闭而致衰败,针对病机予以“益气扶正,解毒化瘀,涤痰逐饮”治法[18]。益气化瘀解毒方遵其要义,扶正祛邪,标本兼顾:君用黄芪补益正气,御邪防变;臣用金银花、黄芩清热解毒,祛邪外出;再用桑白皮、葶苈子、枳实泻肺涤痰,逐饮降气;佐用三七、赤芍活血化瘀,通利血脉。全方祛邪而不伤正,用药精妙,功专力宏,尽显杜怀棠教授持中守正之组方特点。本实验以“益气”之法为基础,与“清热”“化瘀”“逐饮”三者进行不同组合,将益气化瘀解毒汤拆分为益气清热方、益气化瘀方、益气逐饮方,探究中药全方及各拆方对ARDS模型大鼠的影响。
本实验发现,经益气化瘀解毒方及拆方干预后,大鼠病理观察显示肺组织炎症、充血水肿等肺损伤表现较模型组均有不同程度减轻,而中药全方组改善最为明显,提示益气化瘀解毒方可有效改善ARDS的肺损伤,抑制肺部炎症。研究结果表明,中药全方组及各拆方组肺泡灌洗液中Rap1b蛋白表达水平、益气逐饮组肺匀浆中Rap1b表达水平较模型组显著降低;同时,中药全方组及拆方组肺匀浆中的LFA-1均明显下调,益气清热组和中药全方组肺泡灌洗液中的MAC-1下调较其他拆方组更为显著。上述实验结果提示益气化瘀解毒方及拆方对粘附调节蛋白Rap1b及粘附因子LFA-1和MAC-1表达水平有下调作用,且益气化瘀解毒方及拆方可能通过下调粘附调节蛋白Rap1b及粘附因子LFA-1和MAC-1表达水平,降低肺内中性粒细胞粘附活性,阻断其跨内皮迁移,从而抑制ARDS的炎症级联反应。而且,中性粒细胞跨内皮迁移与血栓形成和水肿液渗出关系密切,LFA-1和MAC-1均可通过配/受体直接结合的方式促进中性粒细胞与血小板的相互作用,导致血栓形成[19];而减少肺毛细血管内皮上的整合素释放,可以降低肺血管通透性,抑制水肿液渗出,减轻LPS引起的肺损伤[20]。总言之,本实验中药各方改善LPS引起的肺损伤的作用体现在可抑制中性粒细胞粘附、减少肺泡腔内的炎性渗出及炎性细胞因子聚集,即解毒清热[21];抑制肺微血管渗出、水肿及微血栓形成[22],即逐饮化瘀,均直接作用于肺损伤的关键环节,与“清热”“化瘀”“逐饮”之法相契合。
但在本实验中发现,中药全方组及拆方组肺匀浆中的MAC-1蛋白和肺泡灌洗液中的LFA-1蛋白较模型组未见显著下调,与肺泡灌洗液有较大区别,这可能与LFA-1、MAC-1存在部分功能差异有关[23]。部分研究认为LFA-1主要作用于粘附过程,而MAC-1作用于后续的迁移过程[24],故而蛋白活性有所差异,可能导致LFA-1在毛细血管内皮上活性较高,MAC-1在肺泡腔内活性较高。
综上,益气化瘀解毒方及拆方对ARDS具有较好的治疗作用,可能是通过抑制Rap1b、LFA-1和MAC-1蛋白表达,降低中性粒细胞粘附活性,截断中性粒细胞跨内皮迁移过程,进而抑制ARDS失控的炎症级联反应,这也体现了“治病必求于本”的中医学理念。

