新疆维吾尔自治区阿拉尔市某规模化养殖场猪乳源金黄色葡萄球菌的分离鉴定及其毒力、耐药性分析
陈俊凯,于月通,杨 彬,王泽坤,李 静,陀海欣,徐俊飞,齐 萌
(塔里木大学动物科学与技术学院/新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室,新疆 阿拉尔 843300)
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的人兽共患革兰阳性菌, 可引起人和动物的胃肠道疾病、创伤和血液感染,造成化脓灶、腹膜炎和菌血症等病症[1-2]。 治疗由金黄色葡萄球菌引起的感染性疾病通常采用抗菌药物疗法,不科学、不合理甚至滥用抗菌药物导致金黄色葡萄球菌的耐药性不断增强,呈现多重耐药性。 此外,生物被膜的形成使得细菌对抗菌药物和宿主免疫系统的防御更具有耐受性,有助于菌株在环境或者宿主中持续存在[3]。 金黄色葡萄球菌对不同宿主表现出不同致病性。 金黄色葡萄球菌是奶牛乳腺炎的主要致病菌之一。 由金黄色葡萄球菌引起的奶牛乳腺感染持续时间长,不仅导致奶牛淘汰率上升,还可能对牛奶品质产生负面影响,引发食物中毒, 从而对食品卫生安全和人类健康构成潜在威胁[4]。 猪感染金黄色葡萄球菌后,常表现出流涕、气喘、皮肤发炎等症状,其在猪和人类之间传播所造成的公共卫生安全问题已引起人们的关注[5]。 目前,我国猪乳源金黄色葡萄球菌的相关报道较少。 本研究对从新疆维吾尔自治区阿拉尔市某规模化养殖场分离到的猪乳源金黄色葡萄球菌进行生物被膜形成能力检测,并对其致病性及耐药性进行分析, 以期为猪乳源金黄色葡萄球菌的病原生物学研究提供基础数据。
1 材料与方法
1.1 试验材料
1.1.1 样本来源
2022 年10 月, 在新疆维吾尔自治区阿拉尔市某规模化养猪场选取外观健康的哺乳母猪,使用碘酊和75%酒精对其乳房进行消毒后, 用一次性塑料手套挤出乳液,收集至50 mL 的无菌离心管内。 共收集6 份新鲜猪乳样本,标记信息后置4 ℃冷藏箱,送至实验室,4 ℃冰箱保存。
金黄色葡萄球菌标准菌株ATCC 25923 和具有强生物被膜形成能力的表皮葡萄球菌ATCC 35984,由新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室保存。
1.1.2 主要试剂及仪器
胰蛋白胨大豆液体 (TSB) 培养基、Mueller-Hinton(MH)肉汤培养基、甘露醇高盐琼脂(MSA)培养基,奥博星生物技术(北京)有限责任公司产品;PCR 扩增引物、DL 2 000 DNA Marker、2×Easy Taq PCR Super Mix(+dye)、细菌基因组DNA 提取试剂盒,全式金生物技术(北京)有限公司产品;药敏片均购自温州市泰康生物科技有限公司; 革兰染色试剂,实验室自行配制;PCR 仪、凝胶成像系统、电泳仪购自Bio-Rad 公司。
1.2 试验方法
1.2.1 乳样处理
取2 mL 乳样在12 000 r/min 转速下离心2 min后,吸取10 μL 下层乳液,加入5 mL TSB 培养基中,于37 ℃恒温振荡摇床中过夜培养增菌。
1.2.2 细菌分离及形态学鉴定
将富集好的菌液划线接种到MSA 培养基上,于37 ℃恒温培养箱培养24 h 后, 观察菌落形态,挑取单一菌落划线接种于MSA 培养基上进行纯化培养, 纯化完成后挑选形态良好的单菌落进行革兰染色,用普通光学显微镜观察染色特征,初步鉴定细菌种类。
1.2.3 细菌生化鉴定
经形态学观察后,参考吴自豪等[6]报道的方法对疑似金黄色葡萄球菌的菌株进行触酶试验、凝固酶试验和甘露醇发酵试验。以金黄色葡萄球菌ATCC 25923 为阳性对照,灭菌双蒸水为空白对照。
1.2.4 细菌基因组DNA 提取和16S rDNA 序列PCR 扩增
对经表型鉴定初步判定为金黄色葡萄球菌的分离菌株,按照细菌基因组DNA 提取试剂盒说明书进行基因组DNA 提取。 参照刘肖利等[7]报道的引物序列, 设计合成细菌16S rDNA 通用引物,以分离菌株的基因组DNA 为模板进行PCR 扩增,引物由苏州金唯智生物科技有限公司合成。 PCR扩增反应体系为25 μL:2×EasyTaq PCR Super Mix(+dye)12.5 μL, 上、 下游引物各0.5 μL,ddH2O 10.5 μL,DNA 模板1 μL,阴性对照为ddH2O。 PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,34 个循环;72 ℃最后延伸10 min。 将阳性产物送至苏州金维智生物科技有限公司进行测序, 对测序结果进行BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对分析后鉴定分离细菌的种类。
1.2.5 金黄色葡萄球菌生物被膜形成能力检测
分别以表皮葡萄球菌ATCC 35984 和双蒸水为阳性对照和空白对照,参考Ren 等[8]报道的方法对金黄色葡萄球菌进行生物被膜形成能力检测与判定。 生物被膜形成能力分为4 个等级:强(+++;OD570nm值>0.39)、中等(++;0.39>OD570nm值>0.26)、弱(+;0.26>OD570nm值>0.13)和阴性(-;OD570nm值<0.13)。
1.2.6 金黄色葡萄球菌药物敏感性试验
采用K-B 纸片扩散法检测10 类12 种抗菌药物对分离菌株的敏感性, 包括β-内酰胺类:青霉素、头孢西丁;氯霉素类:氯霉素;大环内酯类:红霉素、替米考星;利福霉素类:利福平;四环素类:四环素;氟喹诺酮类:环丙沙星;林可酰胺类:克林霉素;酰胺醇类:氟苯尼考;氨基糖苷类:庆大霉素;磺胺类:磺胺甲噁唑。 以金黄色葡萄球菌标准菌株ATCC 25923 为质控菌株。根据美国临床和实验室标准协会指南(CLSI,2021)发布的相关标准进行药物敏感性试验操作和结果判定。
1.2.7 金黄色葡萄球菌耐药基因检测
参照文献[9-10]报道的引物序列,设计5 种耐药基因引物,采用PCR 法检测金黄色葡萄球菌分离株的耐药基因携带情况,引物由苏州金唯智生物科技有限公司合成。 检测的耐药基因包括庆大霉素耐药基因ant(4)、红霉素耐药基因ermA、头孢西丁耐药基因mecA、 利奈唑胺耐药基因optrA和克林霉素耐药基因ermS。耐药基因PCR 扩增反应体系同“1.2.4”项下;PCR 扩增程序均为:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s,30 个循环;72 ℃最后延伸10 min。 PCR 扩增结束后, 采用1%琼脂糖凝胶电泳检测扩增产物,使用凝胶成像仪拍照。
1.2.8 金黄色葡萄球菌毒力基因检测
参照文献[11-14]报道的引物序列,设计20种毒力基因引物,采用PCR 法检测金黄色葡萄球菌分离株的毒力基因携带情况, 引物由苏州金唯智生物科技有限公司合成。 毒力基因包括编码葡萄 球 菌 肠 毒 素 的 基 因sea、seb、sec、sed、see、seg、seh、sei 和sej,毒性休克综合征毒素基因tsst-1,剥脱毒素基因eta 和etb,Panton-Valentine 杀白细胞素基因lukF,溶血素基因hla 和hlb,纤连蛋白结合蛋白基因fnbA 和fnbB, 凝聚因子基因clfA 和clfB, 以及胶原蛋白黏附素基因cna。 毒力基因PCR 扩增反应体系及程序同“1.2.8”项下。 PCR 扩增结束后, 采用1%琼脂糖凝胶电泳检测扩增产物,使用凝胶成像仪拍照。
2 结果与分析
2.1 分离菌株的形态学观察和生化鉴定结果
在6 份猪乳样本中, 有2 份样本经细菌分离培养后在MSA 培养基中出现圆形、 大小一致、浅黄色或者米黄色的菌落(见图1);分别挑取2 份样本获得的单个菌落进行革兰染色镜检, 镜下观察到了革兰阳性球菌,呈单个、短链或葡萄串状排列(见图2)。 生化试验结果显示,2 株分离菌的触酶试验、凝固酶试验和甘露醇发酵试验均为阳性。结合形态学和生化鉴定结果,2 株分离菌初步鉴定为金黄色葡萄球菌。

图1 分离菌株在MSA 培养基上的菌落形态
图2 分离菌株的革兰染色镜检结果(1 000×)
2.2 分离菌株的16S rDNA 序列PCR 扩增、测序及比对
基于细菌16S rDNA 序列,对2 株疑似金黄色葡萄球菌基因组DNA 样本进行PCR 扩增。 经序列比对分析发现,2 株分离菌的16S rDNA 序列均与埃及人源金黄色葡萄球菌 (GenBank 登录号:OP809639) 分离株的16S rDNA 序列同源性为100%。 结合形态学观察结果、 生化鉴定结果和16S rDNA 序列分析结果,将分离到的2 株细菌判定为金黄色葡萄球菌, 分离率为33.33%(2/6),分别命名为No.1 菌株和No.2 菌株(见图3)。

图3 分离菌株的16S rDNA 序列PCR 扩增结果
2.3 猪乳源金黄色葡萄球菌分离株的药物敏感性试验
药物敏感性试验结果显示,在12 种抗菌药物中, 分离到的2 株金黄色葡萄球菌均对利福平敏感,均对青霉素、头孢西丁、四环素、红霉素、替米考星、克林霉素和磺胺甲噁唑耐药,对庆大霉素、氟苯尼考、氯霉素和环丙沙星的耐药率为50%(见表1)。 2 株分离菌均对3 类以上抗菌药物表现出耐药性,因此,为多重耐药菌。
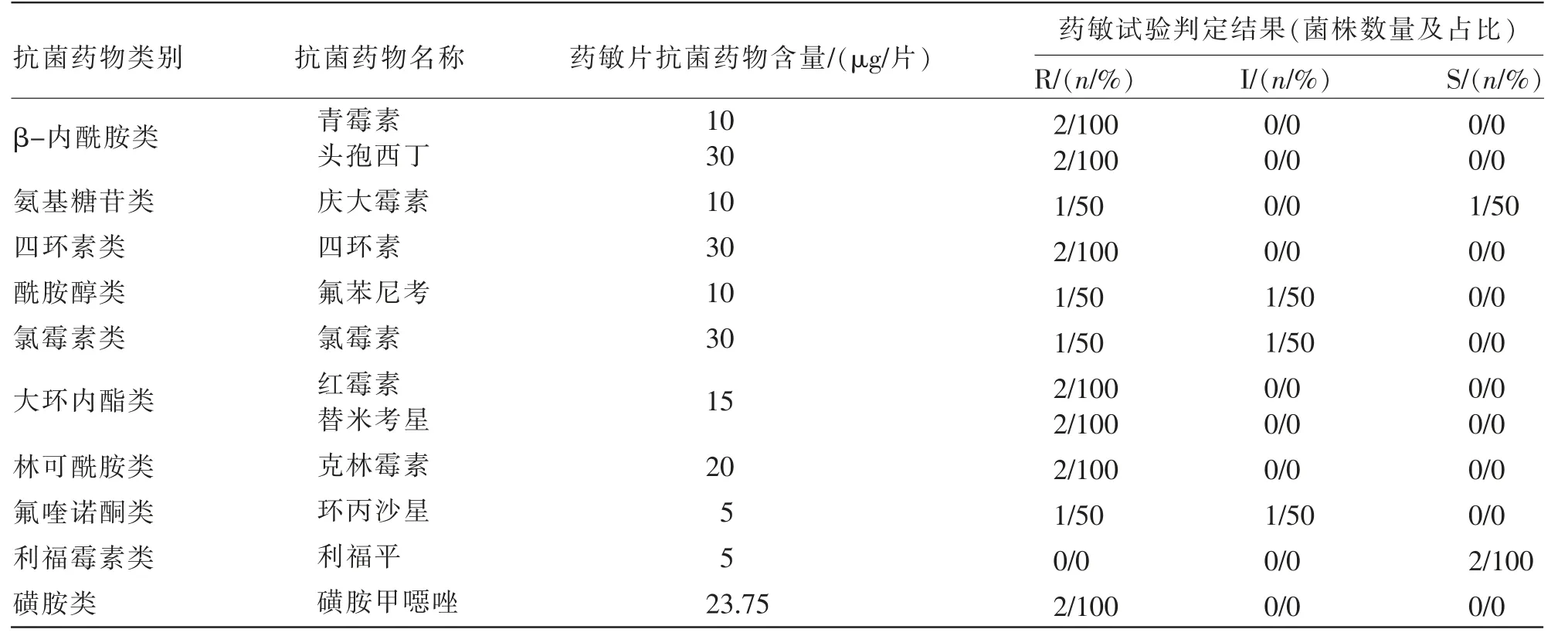
表1 2 株猪乳源金黄色葡萄球菌分离株的药物敏感性试验结果
2.4 猪乳源金黄色葡萄球菌分离株的生物被膜形成能力测定
根据结晶紫半定量测定结果,2 株分离菌的OD570nm值>0.800,由“1.2.5”项下生物被膜形成能力的判定标准可知,2 株金黄色葡萄球菌均有形成生物被膜的能力。
2.5 猪乳源金黄色葡萄球菌分离株的耐药基因检测
在检测的5 种耐药基因中,2 株金黄色葡萄球菌分离株均携带ant(4)基因和mecA 基因(见图4),未检测出ermA、ermS、optrA 基因。

图4 猪乳源金黄色葡萄球菌部分耐药基因的PCR 扩增结果
2.6 猪乳源金黄色葡萄球菌分离株的毒力基因检测
在检测的20 种毒力基因中,2 株金黄色葡萄球菌分离株均携带seg、sei、hlb、fnbA、clfA 基因;No.1菌株还携带hla 基因, 而No.2 菌株不携带hla 基因(见图5);2 株菌均未检测出sea、seb、sec、sed、see、seh、sej、tsst-1、eta、etb、lukF、fnbB、clfB、cna 基因。

图5 猪乳源金黄色葡萄球菌部分毒力基因的PCR 扩增结果
3 讨论
金黄色葡萄球菌主要引起猪的乳腺炎、 关节炎和创口感染, 近年来有关猪源金黄色葡萄球菌分离鉴定和耐药情况的报道不断增多。 在印度,Zehra 等[15]分离得到27 株猪肉源金黄色葡萄球菌,分离率为20.61%(27/131),对8 种药物呈现耐药,表现出多重耐药性。 在我国,蒋松宏等[16]自重庆市某养殖场的106 份猪鼻拭子样本中分离得到7 株耐大观霉素金黄色葡萄球菌,分离率为6.60%(7/106),对4 种药物呈现耐药,携带7 种耐药基因,表现出多重耐药性。 Zhang 等[17]自厦门市分离得到130 株猪肉源金黄色葡萄球菌, 发现123 株携带1 个或多个葡萄球菌肠毒素基因,78 株携带毒力基因seb, 未发现毒力基因sed、sej、seo、sep、ser 和seu。 在波兰,Banaszkiewicz 等[18]分离得到121 株野猪源金黄色葡萄球菌,发现16 个分离株携带1 个或多个葡萄球菌肠毒素基因, 分别有2株、2 株、4 株和11 株携带毒力基因seb、sec、see和seh。 在希腊,Pexara 等[19]在屠宰猪扁桃体中分离得到26 株金黄色葡萄球菌, 发现21 株携带葡萄球菌肠毒素基因sea、seb、seg、seh、sei、sej 和中毒性休克综合征毒素-1 基因(tst)。 该试验所获2株猪乳源金黄色葡萄球菌均携带seg、sei、hlb、fnbA 与clfA 基因,其中1 株还携带hla 基因。 上述研究结果表明, 不同国家和地区以及猪源不同部位/组织中都能分离到的金黄色葡萄球菌,但菌株携带的毒力基因存在较大差异, 这与宿主生存环境、用药情况和地理分布等因素密切相关。
研究发现, 金黄色葡萄球菌多重耐药情况越来越严重。 Xu 等[20]自湖北省分离得到230 株猪源金黄色葡萄球菌, 对其中127 株分离菌进行药敏试验,发现对复方新诺明、四环素、红霉素、克林霉素、氯霉素、环丙沙星、庆大霉素和苯唑西林的耐药率分别为100.00%(127/127)、98.43%(125/127)、91.34%(116/127)、91.34%(116/127)、74.80%(95/127)、62.99%(80/127)、34.65%(44/127)和16.54%(21/127)。Zhang 等[21]自湖南省分离得到163 株猪源金黄色葡萄球菌,发现对链霉素、庆大霉素、红霉素、青霉素、克林霉素、克林霉素、四环素、氨苄西林、头孢噻肟、环丙沙星和复方新诺明耐药率均大于63.19%(103/163);163 株金黄色葡萄球菌均携带耐药基因gyrA、aac(6)/aph(2)、tetk;还携带耐药基因blaZ(96.93%,158/16)、tetM(93.87%,153/163)、LinE(88.96%,145/163)、ermA(82.82%,135/168)、sull (72.39%,118/163)、MsrA (17.18%,28/163)和mecA(4.29%,7/163);Zheng 等[22]自我国东部地区分离得到63 株猪源耐甲氧西林金黄色葡萄球菌,对克林霉素、氯霉素、红霉素、庆大霉素以及利奈唑胺的耐药率分别为95.24%(60/63)、76.19% (48/63)、49.21% (31/63)、3.17% (2/63) 和1.59%(1/63)。
本研究中2 株猪乳源金黄色葡萄球菌对青霉素、头孢西丁、四环素、红霉素、替米考星、克林霉素以及磺胺甲噁唑耐药率均为100%,均携带耐药基因blaZ、ant(4)和mecA,具有多重耐药性,与上述报道结果相一致,提示在临床生产中,在对患病动物进行药物治疗时,应合理用药,避免致病菌产生更多的耐药性。
4 结论
阿拉尔市某规模化养殖场猪乳源金黄色葡萄球菌生物被膜形成能力强, 携带多种毒力基因和耐药基因,表现为多重耐药性。

