新疆维吾尔自治区塔额垦区牛源大肠杆菌耐药性、CTX-M 基因携带情况与毒力基因检测
赵 耀,邢国锋,苏帆帆,高 攀,彭 健,吴自豪,吴 静
[1.塔里木大学动物科学与技术学院/新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室,新疆 阿拉尔 843300;2.新疆生产建设兵团第九师农业科学研究所(畜牧科学研究所),新疆 额敏 834601;3.塔里木大学生命科学与技术学院,新疆 阿拉尔 843300]
大肠杆菌是人和动物正常肠道菌群的成员之一。 通常,寄居于肠道的大肠杆菌不具有致病性,但当致病性大肠杆菌侵入或大肠杆菌寄生部位发生改变时,可引起宿主腹泻、胃肠道感染、尿路感染和乳腺炎等多种疾病[1]。 在奶牛生产上,致病性大肠杆菌可随母牛乳汁进入犊牛胃肠道, 引起犊牛腹泻,造成经济损失。
目前, 抗菌药物疗法仍是临床上治疗细菌感染性疾病的主要方法,但细菌耐药性产生与扩散、病原菌在人畜间的水平传播以及新型抗菌药物研发难度大等问题, 使得抗菌药物的应用受到巨大限制。 大肠杆菌产生的超广谱β-内酰胺酶(extended-spectrum beta-lactamases,ESBLs)可水解含β-内酰胺环的抗菌药物,是介导大肠杆菌对β-内酰胺类抗菌药物特别是头孢菌素类抗菌药物、单酰胺酶类抗菌药物以及青霉素耐药的主要机制,具有广泛的水解酶活性[2]。 产ESBLs 的临床菌株不仅对β-内酰胺类药物耐药,而且还对氨基糖苷类药物、氟喹诺酮类药物、多西环素、氟苯尼考等耐药,表现出多重耐药特性[3]。 ESBLs 编码基因包括TEM、SHV、CTX-M、OXA 和KPC 基因,均可编码产生丝氨酸β-内酰胺酶[4]。在过去的十几年中,CTX-M 取代TEM 和SHV 成为流行最为广泛的ESBLs 编码基因之一, 成为介导革兰阴性菌多重耐药的主要因素[5]。 研究表明,大肠杆菌中携带的CTX-M 基因分为5 个亚型(CTX-M-1G、CTX-M-2G、CTX-M-8G、CTX-M-9G 和CTX-M-25G)[6],较为常见的是CTX-M-1G 和CTX-M-9G。 前人研究发现,CTX-M 型ESBLs 耐药基因可以通过质粒、整合子、转座子等可移动遗传元件,在质粒与染色体间,或从一个质粒到另一个质粒,或从一种细菌到另一种细菌进行转移, 具有复杂的遗传传播背景[7-9],可在人畜间进行水平传播,给世界各地的公共卫生安全和动物食品生产安全造成严重威胁和重大经济损失。
目前已在新疆维吾尔自治区的牛、羊、骆驼、马、猪、禽和宠物源大肠杆菌中检测到CTX-M 型ESBLs 耐药基因,包括CTX-M-1G 和CTX-M-9G等亚型。 但关于塔额垦区牛腹泻样本中大肠杆菌携带CTX-M 型耐药基因的流行情况报道较少。塔额垦区作为新疆维吾尔自治区重要的牛养殖地区之一,携带CTX-M 型耐药基因的大肠杆菌在牛养殖中的潜在危害不容忽视。因此,本研究从新疆维吾尔自治区塔额垦区的牛腹泻粪便中分离大肠杆菌,对其进行分子分型、药敏试验、CTX-M 型ESBLs 鉴定、耐药基因检测、毒力基因检测和生物被膜形成能力检测,以期为CTX-M 型大肠杆菌引起的牛感染性疾病的临床防治提供基础试验数据。
1 材料与方法
1.1 试验材料
1.1.1 样品采集与菌株
从新疆维吾尔自治区塔额垦区某牛场采集16 份(约50 g/份)新鲜牛腹泻粪样,置无菌管中于4 ℃保存,低温运送至实验室进行处理。
大肠杆菌ATCC 25922 和表皮葡萄球菌ATCC 35984 均由新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室保存。
1.1.2 主要试剂和仪器
PCR 引物、Taq PCR Master Mix(2×)试剂盒,购自生工生物工程(上海)股份有限公司;药敏纸片,购自温州市泰康生物科技有限公司;胰蛋白胨大豆琼脂/液体培养基(tryptic soy agar,TSA;tryptic soy broth,TSB)、 水解酪蛋白胨琼脂/液体培养基(Mueller-Hinton agar,MHA;Mueller-Hinton broth,MHB)、麦康凯琼脂培养基(MacConkey agar)、伊红美兰琼脂培养基(eosin-methylene blue agar),购自青岛海博生物科技有限公司;EasyPureRBacteria Genomic DNA Kit, 购自北京全式金生物科技有限公司。 PCR 试验所用引物合成及测序工作由生工生物工程(上海)股份有限公司完成。
PCR 仪、 凝胶成像系统、 电泳仪, 购自Bio-Rad 公司;超净工作台,购自上海博讯医疗生物仪器股份有限公司;移液器,购自Eppendorf 公司;高速冷冻离心机,购自Thermo Scientific 公司;电子天平,购自奥豪斯仪器(上海)有限公司;恒温培养振荡器,购自上海智城分析仪器制造有限公司;光学显微镜,购自Zeiss 公司;全波长酶标仪,购自Gene Company Limited 公司。
1.2 试验方法
1.2.1 大肠杆菌的分离鉴定
用接种环挑取样品至TSB 中过夜培养, 划线接种于麦康凯琼脂培养基上,然后挑取圆形、光滑的玫红色菌落划线接种于伊红美兰琼脂培养基上, 将呈黑色金属光泽的菌落划线接种在TSA 上进行纯化。纯化后的菌株进行革兰染色镜检,将镜下观察呈短直杆状的粉红色菌株作为疑似大肠杆菌菌株。 利用PCR 方法对疑似菌株进行大肠杆菌特 异 性 基 因phoA 扩 增 检 测 (phoA F:GTGACAAAAGCCCGGACACCATAAATGCC;phoA R:TACACTGTCATTACGTTGCGGATTTGGCGT)[10]。将phoA 基因扩增阳性的菌株进行16S rDNA 扩增(27 F:CCAGGCAAAGAGTTTATGTTGA;1 492 R:GCTATTTCCCTGCCGATA AGAGA)[11],对PCR 阳性产物进行测序。 16S rDNA 的PCR 扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸40 s,30 个循环;72 ℃最后延伸5 min。将分离菌株的16S rDNA 序列在NCBI 网站上(https://www.ncbi.nlm.nih.gov/) 与 已 知 序 列 进 行BLAST 比对,确定菌株种属。
1.2.2 分子分型(系统发育群和脂多糖核心型)
参照Clermont 等[12]报道的方法和判断标准,对chuA、yiaA 和TspE4.C2 基因进行三重PCR 检测,根据PCR 检测结果判定大肠杆菌的系统发育群。 PCR 反应程序为:95 ℃预变性4 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃最后延伸10 min。
根据Amor 等[13]发表的文献中大肠杆菌脂多糖 (LPS) 核心型PCR 检测方法, 检测大肠杆菌LPS 核心型。PCR 反应程序为:94 ℃预变性4 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸130 s,35个循环;72 ℃最后延伸10 min。
1.2.3 药物敏感性试验以及耐药基因检测
参考美国临床和实验室标准协会指南(CLSI,2021) 操作要求和判断标准, 以大肠杆菌ATCC 25922 作为质量控制菌株, 使用K-B 纸片法对牛源大肠杆菌进行药物敏感性检测。 使用以下药物进行药敏试验,包括β-内酰胺类:青霉素G (P,10 μg/片)、 头孢噻吩 (FUR,30 μg/片)、 美罗培南(MRP,10 μg/片);氟喹诺酮类:诺氟沙星(NOR,10 μg/片)、恩诺沙星(ENR,5 μg/片);利福霉素类:利福平(RD,5 μg/片);四环素类:替加环素(TGC,15 μg/片);氨基糖苷类:链霉素(S,10 μg/片)、阿米卡星(AK,30 μg/片);氯霉素类:氟苯尼考(FFC,30 μg/片);多肽类:多黏菌素(PB,100 IU/片);磺胺类:复方新诺明(SXT,25 μg/片)共8 类12 种药物。参考文献[14]中多重耐药菌的判断标准,将对3 类及以上抗菌药物同时耐药的菌株作为多重耐药(multiple drug resistance,MDR)菌株。
参考文献[10]中报道的大肠杆菌耐药基因引物序列和扩增程序,使用PCR 技术对β-内酰胺类(TEM、CTX-M、SHV、OXA-1)、 氨基糖 苷类[ant(6′)、aac (6′)-Ib、aph (3′)、rmtA)]、 四 环素 类(tetB、tetM、tetA)、氯霉素类(cmlA、dfrIA、floR)、磺胺类(sul1、sul2)、氟喹诺酮类(parC、gyrA、gyrB、qnrA)、多重耐药泵相关类(marA、oqxA、oqxB)、多肽类(mcr-1)共8 大类24 种耐药基因进行检测。
1.2.4 产ESBLs 大肠杆菌鉴定
根据美国临床和实验室标准协会指南(CLSI,2021) 标准操作要求和判断标准, 使用头孢噻肟(CTX)与头孢噻肟/克拉维酸(TCL)双纸片法对牛源大肠杆菌进行产ESBLs 表型试验。判断标准为:若待检菌株头孢噻肟抑菌圈≤27 mm, 并在加入克拉维酸后抑菌圈减小5 mm 及以上时,则判定其产ESBLs。
参考文献[15]中报道的方法对产ESBLs 的大肠杆菌进行CTX-M 基因扩增检测,PCR 反应程序:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃最后延伸10 min。 参考文献[16]对检测出CTX-M 基因的牛源大肠杆菌进行CTX-M 基因亚型鉴定(CTX-M-1G、CTX-M-2G 和CTX-M-9G 亚型, 引物序列见表1)。 PCR 反应程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃/55 ℃/60 ℃退 火30 s,72 ℃延 伸1 min,30 个循环;72 ℃最后延伸10 min。

表1 CTX-M 基因亚型引物信息
1.2.5 毒力基因检测
参考文献[17-20]中报道的大肠杆菌毒力基因引物序列和PCR 反应条件,对大肠杆菌进行耶尔菌素(irp2)、沙门菌素(iroN)、有氧肌动蛋白(iucD)、curli 菌毛(csgA)、Ⅰ型菌毛(fimH)、P 菌毛(papG)、辅助性黏附素(aatA)、Ⅳ型菌毛(facG)、热修饰蛋白(ompA)、血清抗性蛋白(issⅠ)、超氧化物酶歧化酶(sodA)、血清抗性基因(bor)、荚膜多糖转运蛋白(kspM)、表面膜蛋白(yijP)、脑血管内皮细胞侵袭素 (ibeB)、 脑膜炎相关温度敏感菌毛(mat)、沉默溶血素(sheA)、溶血素(hlyA)、热敏性肠毒素(toxA)、耐热性肠毒素(estA)、志贺菌毒素(sxt1 和sxt2)、空泡化自转运蛋白(vat)、大肠杆菌素(cavC)共24 种毒力基因进行检测。
1.2.6 生物被膜形成能力检测
采用结晶紫染色法半定量检测生物被膜,将活化后的待检菌株接于TSB 液体培养基中过夜培养,然后转接至新鲜TSB 中培养至菌液呈云雾状,用无菌TSB 液体培养基将菌液进行1∶200 稀释,取200 μL 稀释后的菌液加入96 孔板。 以表皮葡萄球菌ATCC 35984 为阳性对照, 无菌TSB 液体培养基为空白对照。 放至恒温培养箱中37 ℃培养36 h 后用无菌水洗去未黏附细菌。56 ℃烘干后,每孔加入200 μL 1%结晶紫染色5 min。 染色完成后用PBS 溶液冲洗掉多余染液, 再次烘干后使用丙醇和乙醇(体积比为2∶8)混合溶液进行溶解,并测定OD570nm值。根据OD570nm值的不同将生物被膜表型分为4 组:OD570nm≤1ODC, 无成膜能力 (-);1ODC
2 结果与分析
2.1 大肠杆菌的分离鉴定结果
经选择性分离培养、 革兰染色镜检及分子生物学鉴定 (PCR 产物目的条带大小为1 500 bp),本研究从新疆维吾尔自治区塔额垦区的16 份牛腹泻粪便样品中分离出16 株大肠杆菌,分离率为100%。
2.2 分子分型结果
系统发育群分群结果显示,16 株大肠杆菌中有14 株(87.50%)属于B1 群,1 株(6.25%)属于A群,1 株(6.25%)属于D 群。 LPS 核心型分析表明,15 株菌(93.75%)属于R1 型,1 株(6.25%)菌属于R3 型。
2.3 药物敏感性试验以及耐药基因检测
2.3.1 药物敏感性试验结果
根据美国临床和实验室标准协会指南(CLSI,2021)的判断标准,对16 株牛源大肠杆菌药物敏感性试验结果进行判断,12 种抗菌药物的药敏试验结果见图1。 16 株大肠杆菌对不同抗菌药物的耐药率如下:青霉素(P)为100%、氟苯尼考(FFC)为50.00%、多黏菌素(PB)为0、阿米卡星(AK)为37.50%、替加环素(TGC)为0、恩诺沙星(NOR)为31.25%、复方新诺明(SXT)为68.75%、链霉素(S)为43.75%、诺氟沙星(ENR)为18.75%、头孢噻吩(FUR)为50.00%、利福平(RD)为68.75%、美罗培南 (MRP) 为0。 16 株牛源大肠杆菌中有12 株(75.00%)为多重耐药菌株。
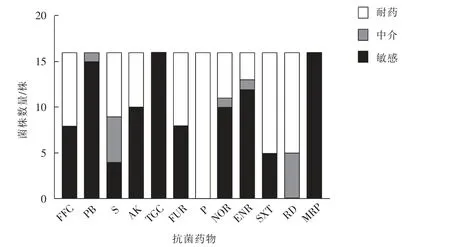
图1 牛源大肠杆菌药物敏感性试验结果
2.3.2 耐药基因检测结果
对选取的β-内酰胺类、氨基糖苷类、四环素类、氯霉素类、磺胺类、氟喹诺酮类、多重耐药泵相关类、 多肽类共8 大类24 种耐药基因进行检测,共检出17 种耐药基因,检出结果见图2。 16 株牛源大肠杆菌中,TEM、CTX-M、ant (6′)、sul1、sul2、parC、gyrA 和marA 8 种基因检出率为100%,aac(6′)-Ib、floR 和gyrB 3 种基因检出率为93.75%,tetB 基因检出率为68.75%,cmlA、oqxA 和oqxB 3种基因检出率为25.00%,tetM 基因检出率为18.75%,dfrIA 基因检出率为12.50%。

图2 牛源大肠杆菌耐药基因检出情况
2.4 产ESBLs 大肠杆菌鉴定结果
根据美国临床和实验室标准协会指南(CLSI,2021) 判断标准,CTX 与TCL 双纸片法筛选结果显示,16 株牛源大肠杆菌中有11 株产ESBLs,占比68.75%。 16 株大肠杆菌中14 株 (87.50%)为CTX-M-1G 基因亚型 (见图3),1 株 (6.25%)为CTX-M-2G 基因亚型,1 株(6.25%)未检出所属基因亚型。
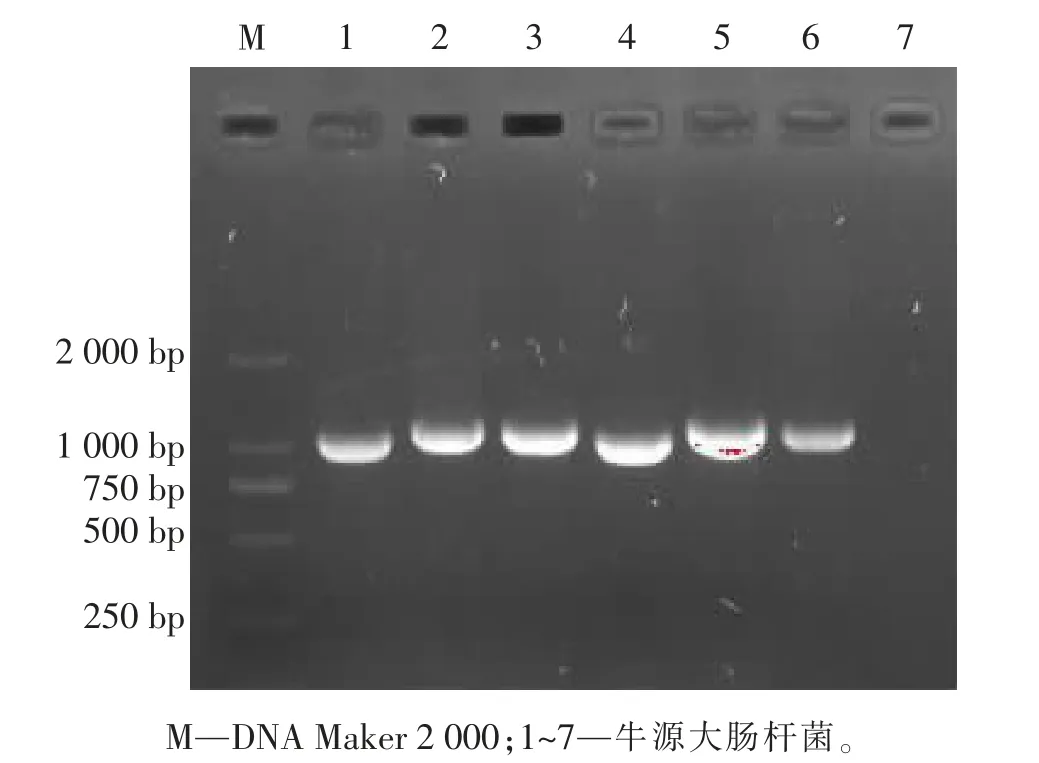
图3 CTX-M-1G 基因亚型电泳图
2.5 毒力基因检测结果
从24 种毒力基因中检测出12 种毒力基因(见图4),其中,iroN、ompA、yijP、mat 和sheA 5 种基因检出率为100%。 其他毒力基因检出率较低,irp2、iucD、csgA、fimH、issⅠ、sodA、ibeB 基因检出率 分 别 为 18.75% 、31.25% 、25.00% 、56.25% 、18.75%、87.50%、37.50%。
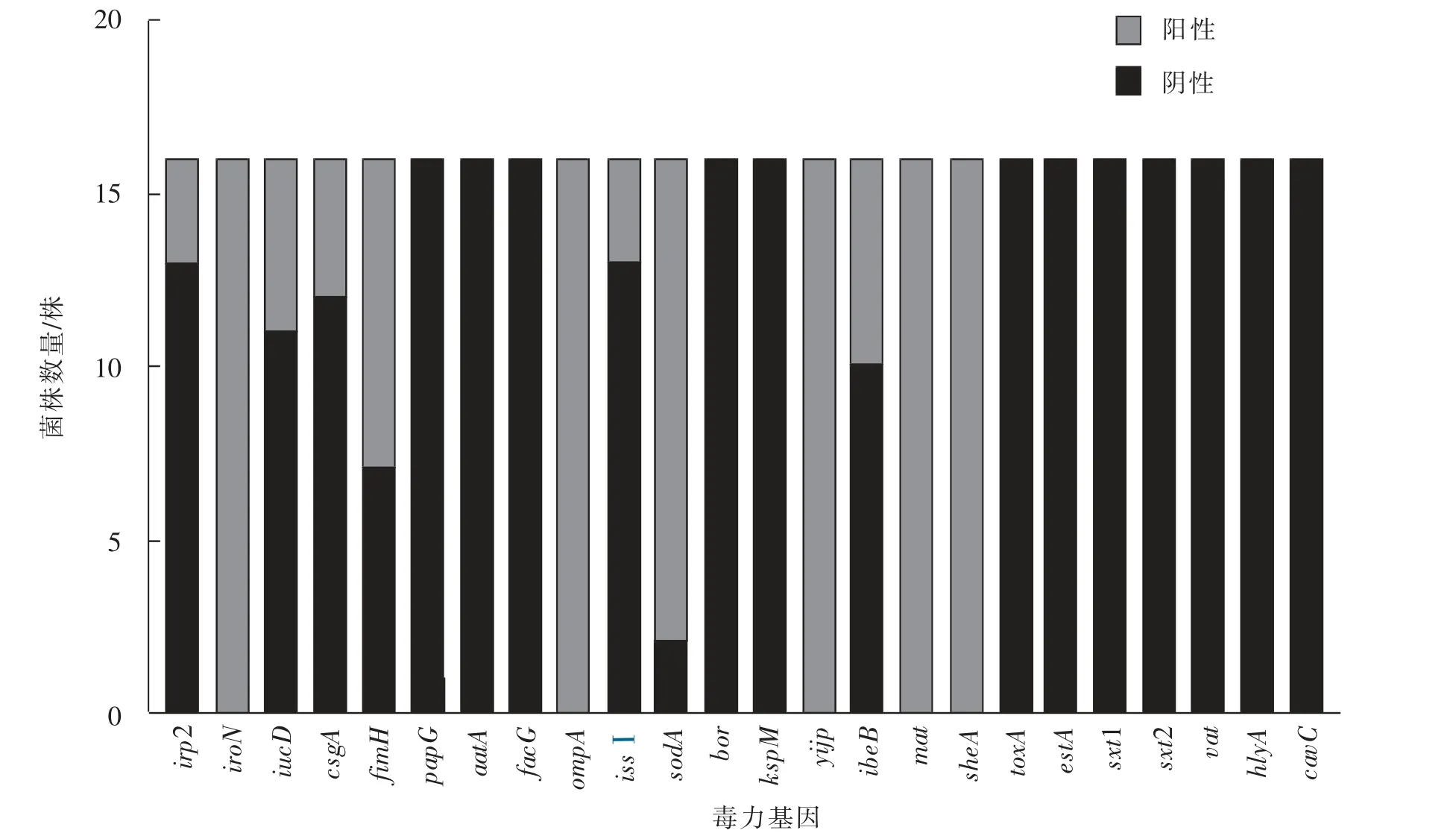
图4 牛源大肠杆菌毒力基因检出情况
2.6 生物被膜形成能力检测结果
16 株牛源大肠杆菌中,有15 株(93.75%)可形成生物被膜,其中,1 株(6.25%)具有强生物被膜形成能力,5 株(31.25%)具有中等生物被膜形成能力,9 株(56.25%)具有弱生物被膜形成能力;1 株(6.25%)没有生物被膜形成能力。
3 讨论
大肠杆菌宿主范围广泛,在人、畜禽和野生动物中均可寄生,并可造成宿主疾病。 携带CTX-M基因的大肠杆菌在全球各地均有报道, 对公共卫生安全和畜禽养殖与食品安全存在严重威胁。2003—2012 年,Rao 等[22]在中国广东、广西和四川等多个省份的患病动物(鸡、猪和水禽)中检测到携带CTX-M 基因的大肠杆菌(24.10%,677/2 815),并且其对环丙沙星、 庆大霉素和氟苯尼考等具有较高的耐药率(>70.00%)。 田国宝等[23]于2006—2008 年从全国19 个省市97 个规模化猪场分离鉴定602 株大肠杆菌,其中,有57 株(9.50%)产ESBLs,35 株为CTX-M 型ESBLs,检出率61.40%(35/57)。 郑红青等[24]从分离自养殖场的1 273 株大肠杆菌中筛选出产ESBLs 阳性菌181 株(14.20%),其中151 株(83.40%)为CTX-M 型。 本研究中分离自塔额垦区的16 株牛腹泻粪便大肠杆菌均携带CTX-M 基因, 通过双纸片法验证,其中11 株(68.75%)具有产ESBLs 表型,高于之前的研究。 16 株大肠杆菌对青霉素(100%)、 利福平(68.75%)和复方新诺明(68.75%)等耐药率较高,并且75.00%(12/16) 的大肠杆菌具有多重耐药表型,耐药情况较为严重。但所有菌株均对碳青霉烯类抗菌药物敏感, 这一现象与文献报道类似,产ESBLs 大肠杆菌对碳青霉烯类抗生素的耐受性较低, 其可能原因是ESBLs 通常不能水解头孢素类(头孢西丁、头孢美唑等)和碳青霉烯类(亚胺培南、美罗培南等)抗菌药物。 不仅如此,15 株大肠杆菌具有生物被膜形成能力, 生物被膜的形成可以提高大肠杆菌对抗生素的耐受能力, 并且可以协助病原菌实现免疫逃避[25]。 本研究表明新疆塔额垦区携带CTX-M 基因的大肠杆菌在牛身上可能广泛流行存在, 而且对临床常用抗生素具有较强的耐受性。
耐药基因的产生和传播是导致细菌耐药的重要原因之一, 并且由于其产生和传播速率远远大于抗生素的研发速度, 因此对耐药基因的流行情况进行检测, 可为细菌耐药性的控制和临床用药提供试验数据。 本研究检测的耐药基因中,TEM、CTX-M、ant (6′)、sul1、sul2、parC、gyrA、marA、aac(6′)-Ib、floR、gyrB 的检出率较高,与田国宝等[23]、杨鑫等[26]、杜向党等[27]的报道相似。周万蓉等[28]从四川省10 个规模化猪场和16 种野生动物粪样中分离鉴定出的124 株菌中sul1 基因的检出率为47.60%,sul2 基因的检出率为17.70%, 本研究中sul1(100.00%,16/16)、sul2(100.00%,16/16)基因检出率高于其报道, 但本研究中对磺胺类药物的耐药率(68.75%,11/16)与其报道的猪源分离菌类似(72.00%,72/100)。 这可能与新疆塔额垦区在饲养管理和临床药物有关, 需要在饲养管理和临床用药上对磺胺类药物的使用加以规范。 本研究表明新疆塔额垦区牛源大肠杆菌可携带多种耐药基因,可能会造成大肠杆菌耐药基因的水平传播,给公共卫生安全造成威胁。
致病性大肠杆菌发挥致病作用需要多种毒力因子的共同协作,如毒素、菌毛以及毒力岛等,其中irp2、tsh、iucD 和issⅠ等基因与大肠杆菌的致病性关系密切[29]。 吕殿红等[30]从105 株大肠杆菌中检出iucD(49.52%)和iss(23.81%)。 与之类似,在本研究中共检测到12 种毒力基因, 其中iroN、ompA、yijp、mat、sheA 的检出率均为100%,其他毒力基因的检出率较低,并且检测到iucD(31.25%)和issⅠ(18.75%)。 这表明新疆塔额垦区牛源大肠杆菌携带多种毒力基因, 这些毒素可在大肠杆菌侵袭宿主与致病时发挥重要作用, 存在潜在的致病风险。
分子分型与大肠杆菌的致病性、 免疫原性以及毒力基因分布等特性具有相关性。研究表明,根据LPS 核心多糖的不同,LPS 核心型可将大肠杆菌分为R1、R2、R3、R4 和K12,共5 种。 在张宇曦等[31]的研究中R1 为主要核心型,并且R1 核心型大肠杆菌与neuC、cva/cvi、irp2 等毒力基因具有显著正相关性, 携带毒力基因的数目高于其他核心型。 与该研究类似,在本研究中的15 株(93.75%)牛源大肠杆菌属于R1 核心型,只有1 株(6.25%)菌属于R3 核心型, 并且携带irp2 等多种毒力基因。 根据系统发育群分析可将大肠杆菌分为A、B1、B2 和D 群, 其中共生性大肠杆菌主要集中在A 和B1 群, 致病性大肠杆菌主要集中在B2 和D群[32]。 在本研究中,14 株(87.50%)大肠杆菌为B1群,1 株为(6.25%)D 群菌株,1 株为(6.25%)A 群菌株, 表明在新疆塔额垦区牛腹泻样本中存在致病性较强的大肠杆菌, 可能是导致牛腹泻的主要病原。分子分型可为大肠杆菌的溯源、致病性和耐药性研究等方面提供支持, 但在本研究中样本数量较少,未能进行相关性分析。
4 结论
本研究调查了新疆维吾尔自治区塔额垦区牛腹泻源大肠杆菌CTX-M 基因的携带情况,并确定其基因亚型主要为CTX-M-1G 基因亚型 (占87.50%)以及CTX-M-2G 基因亚型(占6.25%)。同时,还发现16 株牛腹泻源大肠杆菌对多种临床常用抗菌药物的耐药情况严重,多数(12/16,75.00%)具有多重耐药特征。 分子分型、生物被膜、耐药基因和毒力基因检测结果也表明塔额垦区牛源大肠杆菌存在潜在致病风险, 应加强对其流行情况的监测。

