红花清肝十三味丸通过激活HNF4α改善肝功能的保肝机制研究
肖海军,卞康坤,包 旭,包玉龙,王 利
(1.内蒙古医科大学基础医学院,内蒙古 呼和浩特 010000;2.内蒙古乌兰察布市中心医院检验医学科,内蒙古 乌兰察布 012000)
肝损伤是一种临床常见疾病[1],是指由药物滥用、 病毒感染和大量饮酒引起的肝细胞坏死、凋亡、脂肪变性、炎症反应以及肝功能损害的严重疾病[2-3]。 持续或反复肝损伤可引起肝炎、肝纤维化、肝硬化、肝癌[4-5]。 目前,一些肝保护剂已应用于临床实践,但很大一部分存在潜在的不良反应[6],因此, 开发及筛选安全有效的肝损伤治疗药物具有重要的临床意义。
肝细胞核因子4α (hepatocyte nuclear factor 4α,HNF4α)在肝脏的正常发育及功能维持中起重要作用。 疾病状态下,肝脏中HNF4α 的表达水平和活性会发生改变[7]。 肝脏特异性基因的表达受HNF4α 的调控,进而影响肝细胞的功能[8]。HNF4α能够调控肝细胞功能相关基因群的表达, 并参与蛋白质的合成以及脂肪酸和胆汁酸的代谢等重要生理生化过程[9]。 开发能够有效增强HNF4α 表达和活性的靶向药物, 对于肝脏疾病的治疗具有重要的临床价值。
红花清肝十三味丸(以下简称HHQG)为国家药品标准名称,又名古日古木-13、古日古木·朱苏木[10]。 HHQG 先后被收入《内蒙古蒙成药标准》和《中华人民共和国卫生部药品标准·蒙药分册》(1998 版),后者记载的功能与主治为:清肝热,除“亚玛”病,解毒。 该方剂的处方为:红花60 g,丁香30 g,莲子30 g,麦冬60 g,木香30 g,诃子30 g,川楝子30 g,栀子30 g,紫檀香30 g,人工麝香0.5 g,水牛角浓缩粉30 g,人工牛黄30 g,银朱30 g[11]。HHQG 是目前临床应用较多的传统保肝蒙药方剂,主要用于治疗肝炎和肝功能衰竭[10],对乙型肝炎[12-13]、中毒性肝炎[14]、酒精性和非酒精性脂肪肝[15-17],以及蒙医赫依盛型肝病、热盛型肝病[18]具有显著的疗效。 然而,关于HHQG 治疗急性肝损伤方面的研究仍然匮乏。 本研究旨在通过建立四氯化碳 (CCl4) 诱导的小鼠肝损伤模型, 研究HHQG 对肝损伤的保护作用, 并初步探究其作用机制,以期为该药物的临床合理用药提供依据。
1 材料与方法
1.1 试验材料
1.1.1 实验动物
6~8 周龄雄性C57BL/6J 小鼠45 只, 体重为(22±2)g,购自北京维通利华实验动物技术有限公司, 动物生产合格证号: 北京百善SCXK (京)2021-0006。 饲养环境温度为22 ℃, 相对湿度为60%,光照12 h/黑暗12 h 交替,自由摄食、饮水。试验开始前预饲养1 周。
1.1.2 药物与试剂
HHQG 购自内蒙古国际蒙医医院。 谷丙转氨酶(ALT)(批号:C009-2-1)、谷草转氨酶(AST)(批号:C010-2-1)、总超氧化物歧化酶(SOD)(批号:A001-1-2)活力测定试剂盒购自南京建成生物工程研究所。 HHQG 灌胃液:称取0.616 5 g HHQG,用10 mL 无菌蒸馏水溶解,用前摇匀。肝损伤造模液: 将CCl4与橄榄油按1∶4 的比例(V/V) 混匀。HNF4α 抗体(批号:ab181604)购自英国Abcam 公司;即用型免疫组化超敏UltraSensitiveTMSP 试剂盒(批号:KIT-9921)、DAB 显色试剂盒(批号:DAB-0031)购自福州迈新生物技术开发有限公司。
1.1.3 仪器设备
全自动轮转式切片机(型号:RM2255)、石蜡包埋机(型号:Arcadia)、烤片机(型号:HI1220)、展片机(型号:HI1210)、正置显微镜(型号:DM6B),均为德国Leica 公司产品;全自动数字切片扫描系统(型号:PRECICE 500),北京优纳科技有限公司产品。
1.2 试验方法
1.2.1 分组及给药
将45 只C57BL/6J 小鼠随机分为对照组、CCl4损伤组、HHQG 组,每组15 只。HHQG 组灌胃剂量为0.616 5 g/(kg·BW)的HHQG,每天1 次,持续7 d,对照组和CCl4损伤组灌胃等体积的无菌蒸馏水。
1.2.2 肝损伤模型的建立
末次灌胃4 h 后, 对照组小鼠腹腔注射剂量为5 mL/(kg·BW)的橄榄油,CCl4损伤组和HHQG组小鼠腹腔注射相同剂量的CCl4与橄榄油混合液进行肝损伤造模。 小鼠腹腔注射前24 h 禁食不禁水。分别在造模后第2、5、7 天,每组选取5 只小鼠,处死后收集血液及肝脏组织样本。 将血液样本以3 500 r/min 离心10 min,取上清液,用于后续试验。
1.2.3 体重监测
从造模后第0 天开始至第7 天,每天8:00 对各组小鼠进行称重,记录体重数据。
1.2.4 肝功能及抗氧化应激指标的检测
严格按照试剂盒说明书检测血清ALT、AST、SOD 活力。
1.2.5 肝脏组织形态学观察
取小鼠肝脏大叶组织1/3, 于4%组织固定液中固定,经组织脱水、透蜡、包埋、切片、脱脂、脱蜡后,分别进行HE 染色和Masson 染色,在光学显微镜下观察肝脏组织的结构变化。
1.2.6 免疫组织化学技术分析肝脏组织中HNF4α 蛋白的表达情况
石蜡切片用3%山羊血清在室温下封闭30 min,一抗(HNF4α,1∶200)4 ℃过夜孵育;切片用PBS 溶液洗涤后,辣根过氧化物酶(HRP)-聚合物抗小鼠/兔二抗室温孵育50 min;切片在PBS 溶液中浸泡5 min,DAB 染色,苏木精复染;切片在1%盐酸乙醇分化液中浸泡3 s,自来水冲洗后拍照并保存。
1.2.7 转录组测序(RNA-seq)分析
分别提取各组小鼠造模后第2 天相同部位的肝叶组织(每组独立3 次重复样本)的总RNA,用于创建RNA 文库并进行RNA 测序。 基于至少2次具有相同趋势的成对比较, 运用DESeq2 软件包, 基于统计学分析方法, 筛选出表达变化高于1.5 倍的基因(P<0.01),即差异表达基因,用于后续研究分析。 RNA-seq 分析委托北京诺禾致源科技股份有限公司完成。
1.3 统计学分析
试验数据用“平均值±标准差”的形式表示,采用Student′s t 检验(SPSS 13.0 统计学软件)进行差异显著性分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 HHQG 对肝损伤小鼠体重的影响
由表1 可知,与对照组相比,在肝损伤造模后第1~4 天以及第6~7 天,CCl4损伤组小鼠体重显著(P<0.05)或极显著(P<0.01 或P<0.001)降低;与CCl4损伤组相比, 在肝损伤造模后第4 天以及第6~7 天,HHQG 组小鼠体重显著(P<0.05)或极显著(P<0.01)增加。

表1 肝损伤造模后不同时间各组小鼠体重测定结果(n=3) 单位:g
2.2 HHQG 对肝损伤小鼠肝功能指标的影响
由表2 和表3 可知,与对照组相比,在肝损伤造模后第2 天,CCl4损伤组小鼠血清ALT 和AST活力极显著(P<0.001)升高;与CCl4损伤组相比,在肝损伤造模后第2 天,HHQG 组小鼠血清ALT和AST 活力显著(P<0.05)降低;在肝损伤造模后第5、7 天,各组小鼠血清ALT 和AST 活力无显著(P>0.05)差异。

表2 肝损伤造模后不同时间各组小鼠血清ALT 活力检测结果(n=3) 单位:U/L

表3 肝损伤造模后不同时间各组小鼠血清AST 活力检测结果(n=3) 单位:U/L
2.3 HHQG 对肝损伤小鼠抗氧化应激指标的影响
由表4 可知,与对照组相比,在肝损伤造模后第2 天,CCl4损伤组小鼠血清SOD 活力显著 (P<0.05)降低;与CCl4损伤组相比,在肝损伤造模后第2 天,HHQG 组小鼠血清SOD 活力显著 (P<0.05)升高;在肝损伤造模后第5、7 天,各组小鼠血清SOD 活力无显著(P>0.05)差异。

表4 肝损伤造模后不同时间各组小鼠血清SOD 活力检测结果(n=3) 单位:U/L
2.4 HHQG 对肝损伤小鼠肝脏组织形态学的影响
HE 染色显示(见图1),对照组小鼠的肝小叶结构完整,肝实质细胞轮廓清晰,细胞核为蓝色,细胞质为红色,核质分布均匀,肝细胞排列整齐。在肝损伤造模后第2 天,CCl4损伤组的肝门静脉周围形成大面积弥漫性变性坏死, 边缘的肝细胞排列混乱,多数呈水肿状态,并有胶原纤维物质沉积,可见部分炎性细胞浸润;此时,HHQG 组的肝损伤及坏死面积明显减小, 并且胶原纤维物质沉积也明显减少。在肝损伤造模后第5 天,虽然CCl4损伤组的肝脏损伤坏死面积比第2 天减小, 但是损伤区域仍可见大量炎性细胞浸润;此时,HHQG组的肝损伤面积更小, 并且炎性细胞浸润和胶原纤维物质沉积也受到了明显抑制。 在肝损伤造模后第7 天,CCl4损伤组的损伤区域通过肝细胞增殖进行组织修复, 大部分沉积的胶原纤维物质被降解,在损伤修复后,炎性细胞浸润减少,炎症开始消退; 此时,HHQG 组的肝损伤修复基本完成,无炎症反应。

图1 各组小鼠肝脏组织病理学变化HE 染色观察结果(200×)
Masson 染色显示(见图2),与对照组相比,在肝损伤造模后第2 天,CCl4损伤组小鼠肝脏的大面积弥漫性坏死区域有大量胶原纤维物质沉积;在肝损伤造模后第5 天,损伤虽然有所减轻,但是胶原纤维物质沉积明显增加, 并且在损伤区域周围出现大量炎性细胞浸润; 在肝损伤造模后第7天,胶原纤维物质逐渐降解,大部分坏死区域已被修复, 但门管区与中央静脉周围仍有部分胶原纤维物质沉积和炎性细胞浸润。相比之下,HHQG 组小鼠肝脏胶原纤维物质的沉积得到明显改善,并且炎性细胞浸润被抑制, 肝脏组织的损伤状况明显减轻。

图2 各组小鼠肝脏组织病理学变化Masson 染色观察结果(200×)
2.5 肝脏组织差异基因KEGG 信号通路富集分析
如图3 所示, 与CCl4损伤组相比,HHQG 组上调的前20 个信号通路分别为:过氧化物酶体增殖物激活受体,脂肪酸降解,脂肪酸代谢,丁酸盐代谢,脂肪消化和吸收,过氧化物酶体,α-亚麻酸代谢,碳代谢,丙酸盐代谢,缬氨酸、亮氨酸和异亮氨酸降解, 果糖和甘露糖代谢,β-丙氨酸代谢,不饱和脂肪酸生物合成,酮体合成与降解,赖氨酸降解,昼夜节律,胰岛素抵抗,甘氨酸、丝氨酸和苏氨酸代谢,昼夜节律诱导,成年发病型糖尿病。此外,与CCl4损伤组相比,HHQG 组下调的前20 个信号通路分别为:核糖体、甘油磷脂代谢、甲状腺癌、癌症中的异常转录调控、p53 信号通路、 胶质瘤、脂肪细胞因子信号通路、甘露糖型O-聚糖生物合成、小细胞肺癌、收集导管酸分泌、肾细胞癌、突触囊泡周期、非小细胞肺癌、甲状腺激素信号通路、SNARE 在膀胱运输中的相互作用、 非洲锥虫病、亚油酸、昼夜节律、慢性髓性白血病、FoxO 信号通路。 KEGG 信号通路富集分析结果进一步表明,HHQG 能够促进肝脏功能的恢复。

图3 HHQG 组与CCl4 损伤组肝脏组织差异基因KEGG 信号通路富集分析
2.6 HHQG 对肝损伤小鼠肝脏功能相关基因表达的影响
如图4 所示, 与CCl4损伤组相比,HHQG 组小鼠肝脏组织中与肝细胞分化相关的基因群显著上调, 包括HNF4α、ATF5、Cebpb、Rxra、Tsc22d3、Jun、Nr1i2、Nr2f6、Rela、Stat5b、Nfix、Nr5a2、Gpbp1l1、Foxo3、Nr4a1、Irf6、Foxo4、Foxp4、Zscan26、Rora、Elk4、Tsc22d2、Foxo1、Foxn3、Nfib、Tsc22d1、Fosl2、Crem、Myrf、Jdp2、Zkscan1、Nfia、Nfat5、Smad9、Fosb、Nr6a1、Nr4a2、Nr4a3。
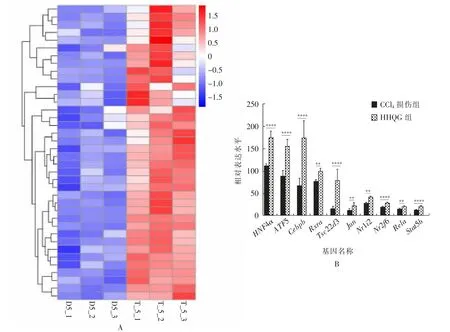
图4 HHQG 促进肝损伤小鼠肝细胞分化的相关基因群分析
2.7 HHQG 对肝损伤小鼠肝脏组织HNF4α 蛋白表达的影响
免疫组织化学分析表明 (见图5),HNF4α 在正常肝细胞的细胞核中均匀表达; 在肝损伤造模后第2 天,与对照组相比,CCl4损伤组肝损伤区域周边快速增殖的肝细胞中HNF4α 不表达,而HHQG 组的HNF4α 表达量有所增加;在肝损伤造模后第5 天,CCl4损伤组可见HNF4α 表达量增加,HHQG 组的HNF4α 表达增加更明显; 在肝损伤造模后第7 天,CCl4损伤组和HHQG 组的HNF4α 表达基本恢复正常。以上结果提示,HHQG可以使增殖后的肝细胞迅速表达HNF4α,促进肝细胞分化,维持肝细胞的功能,从而减轻肝损伤。
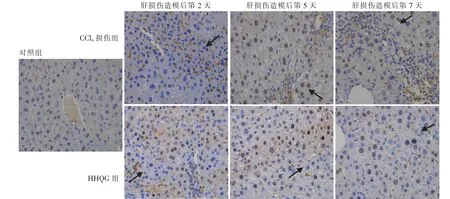
图5 免疫组织化学技术分析肝损伤小鼠肝细胞中HNF4α 的表达情况(400×)
3 讨论
肝脏是人类和动物体内最大而且是最重要的腺体,是由肝实质细胞、肝窦细胞、肝窦周细胞组成的复杂的关键器官。 在肝损伤的预防和治疗方面, 民族医药复方因具有多靶点效应而显示出独特的优势。 蒙药传统保肝良方HHQG 对肝热病的治疗有着非常显著的功效,在临床中使用广泛,但其作用机制尚不明确。 深入研究蒙药方剂HHQG在肝损伤中的保护和促修复机制, 可为肝病的预防和治疗开辟一个新的途径。 CCl4诱导的动物肝脏病理损伤与人类肝病的症状具有相似性[19],所以CCl4诱导的肝损伤、肝纤维化和肝硬化模型是评估药物保肝活性的经典模型[20]。 本研究发现,CCl4损伤后小鼠血清中ALT 和AST 活力在损伤早期迅速显著升高,SOD 活力显著降低;病理组织切片观察可见,CCl4损伤组小鼠肝小叶结构紊乱,中央静脉周围和小叶周围带可见多处坏死灶,多数肝细胞肿胀呈气球样变, 伴有混合性炎性细胞浸润;以上结果表明小鼠肝损伤模型构建成功。在肝损伤早期,HHQG 组小鼠血清中ALT 和AST 活力显著下降,SOD 活力显著升高, 并且HHQG 能抑制CCl4引起的肝脏病理学改变,这一结果与文献报道的结果一致[21],表明HHQG 可以明显改善CCl4诱导的肝损伤。
已有研究表明,HHQG 可通过提高抗氧化能力, 抑制JNK/c-Jun 信号通路与FasL/Fas 死亡受体凋亡途径和线粒体凋亡途径,减少肝细胞凋亡,从 而 发 挥 保 肝 作 用[22]。 HHQG 也 可 通 过 平 衡MMP-1 和TIMP-1 细胞因子, 抑制脂质过氧化和调节肝纤维化发挥保肝作用[23]。 前期研究显示,HHQG 对CCl4诱导的小鼠慢性肝损伤的保护作用可能与HHQG 增加肝再生增强因子, 抑制JNK信号通路激活有关[24]。 本研究RNA-seq 分析结果显示,HHQG 组小鼠肝脏组织上调的基因富集于促进代谢以及细胞抗氧化等途径, 这表明HHQG可以通过恢复肝脏代谢能力, 维持肝脏功能来改善CCl4诱导的肝损伤。
HNF4α 是肝脏特异性表达基因的主要调节因子,可促进肝细胞分化[25],与肝脏代谢及肝功能维持密切相关[26]。 HNF4α 能够在转录水平调控相关基因的表达, 有研究表明, 在小鼠中敲除HNF4α 基 因 后,PAH、EPO、APOA Ⅰ、APOA Ⅱ、APOB、APOCⅡ、APOCⅢ等与成熟肝细胞功能相关的基因不表达[27]。对肝细胞特异性HNF4α基因敲除的成年小鼠的研究结果表明,HNF4α 可以调节药物代谢关键基因的表达,发挥维持细胞黏附、稳定细胞增殖、抗凋亡的作用[28-29]。HNF4α 处于调控网络中心的上游, 与多种靶基因的启动子相互作用以调控与肝细胞功能相关的基因表达, 并参与胆汁酸代谢、蛋白质合成等过程,是肝细胞分化和功能维持的关键转录因子[9]。 本研究通过免疫组织化学技术分析发现,HHQG 可以明显增加肝损伤小鼠肝脏组织中HNF4α 蛋白的表达, 同时,RNA-seq 分析结果也显示, 与CCl4损伤组相比,HHQG 组小鼠肝脏组织中HNF4α基因表达水平显著上调, 提示HNF4α 是HHQG 发挥保肝作用的靶点之一。
4 结论
HHQG 通过激活HNF4α, 抑制肝脏氧化损伤、促进肝脏组织修复以及维持肝脏功能,改善小鼠肝损伤,从而发挥保肝效应。

