地衣芽孢杆菌活菌胶囊治疗溃疡性结肠炎的临床疗效及对患者肠道黏膜通透性和肠道菌群的影响
田静 邓莉 (恩施州中心医院脾胃科,恩施 445000)
溃疡性结肠炎(ulcerative colitis,UC)是多发于结直肠黏膜及黏膜下层的慢性非特异性炎症疾病,腹痛、腹泻、黏液脓血便是其主要症状,该病具有反复发作、病情周期长、严重程度多变的特征,且与结肠癌有一定关系,严重影响患者的身心健康及生活质量,积极治疗是关键[1]。目前临床治疗UC以氨基水杨酸类制剂药物为主,但有部分患者治疗后症状改善不明显,此时临床往往会辅以糖皮质激素、免疫抑制剂、生物制剂等治疗,但这些治疗存在副作用大、价格昂贵等弊端,一般不主张长期应用[2]。近年来,有学者指出肠道菌群失调在UC的发生、发展中占有重要地位,重建肠道菌群治疗方案,如益生菌制剂、粪菌移植等,成为临床研究热点[3]。地衣芽孢杆菌活菌胶囊是一类益生菌制剂,可拮抗葡萄球菌、酵母样菌等致病菌,并促进双歧杆菌、消化链球菌、乳酸杆菌等益生菌生长,从而调整菌群失调,保护肠道功能[4]。虽然目前益生菌制剂在UC的治疗中有一定应用,但从益生菌制剂对患者疾病活动度、肠道黏膜通透性、肠道菌群等多个角度探究其疗效及机制的报道并不多见。基于此,本研究将地衣芽孢杆菌活菌胶囊用于UC治疗,观察其临床疗效及对患者内镜下活动度分级、肠道黏膜通透性、肠道菌群、免疫功能等多方面的影响,旨在为临床UC的治疗及病情评估提供参考。
1 资料与方法
1.1 资料 选取2019年1月至2021年5月恩施州中心医院收治的200例UC患者,纳入标准:符合《炎症性肠病诊断与治疗的共识意见》(2018北京)[5]中UC诊断,改良Mayo评分为轻中度活动(3~10分),精神、认知正常,治疗依从性良好,签署知情同意书。排除标准:与克罗恩病、缺血性肠病等无法鉴别者;伴肠道狭窄、息肉、穿孔等肠道器质性病变者;合并恶性肿瘤、重要脏器功能不全、消化性溃疡、血液系统疾病、免疫缺陷者;妊娠或哺乳期女性;对氨基水杨酸类药物过敏者;入组前已接受相关药物治疗;无法耐受肠镜检查,精神异常,治疗依从性差者。按随机数字表法将纳入对象分为观察组和对照组,100例/组,观察组男性56例,女性44例,年龄20~67岁,平均(42.86±10.08)岁,Mayo评分3~5分53例,6~10分47例,病变部位:左半结肠炎41例,直乙结肠炎34例,全结肠炎25例;对照组男性49例,女性51例,年龄18~69岁,平均(40.25±13.15)岁,Mayo评分3~5分58例,6~10分42例,病变部位:左半结肠炎44例直乙结肠炎33例,全结肠炎23例;两组患者性别、年龄、Mayo评分、病变部位比较差异无统计学意义(P>0.05),具有可比性。本研究经恩施土家族苗族自治州中心医院伦理委员会批准(2019-KL-012-11)。
1.2 方法
1.2.1 给药方法 两组均有饮食指导、营养支持、维持水电解质平衡等基础治疗。对照组患者予以美沙拉嗪肠溶片(葵花药业集团佳木斯鹿灵制药有限公司,国药准字:H19980148,规格:0.25 g)口服,4片/次,4次/d;观察组患者在对照组治疗基础上,予以地衣芽孢杆菌活菌胶囊(东北制药集团沈阳第一制药厂,国药准字:S20010022,规格:0.25 g)口服,2粒/次,3次/d。两组连续用药12周,评价疗效。
1.2.2 观察指标
1.2.2.1 临床疗效 参照《炎症性肠病诊断与治疗的共识意见》中疗效标准[5]。缓解:治疗后排便次数恢复正常,无血便及里急后重复查结肠镜见肠黏膜基本正常或无活动性炎症;有效:治疗后临床症状明显改善,结肠镜可见肠黏膜轻度炎症;无效:临床症状、结肠镜检查与治疗前相比均无改善。有效率(%)=(缓解例数+有效例数)/总例数×100%。
1.2.2.2 活动度分级 治疗前后采用改良Baron内镜分级法[6]记录患者活动度分级。0级:肠黏膜正常;1级:见黏膜充血,血管模糊;2级:黏膜有接触性出血;3级:黏膜自发性出血;4级:见黏膜大小不等溃疡。
1.2.2.3 肠黏膜通透性 治疗前后,采集患者外周静脉血4 ml,分离血清待测,采用鲎试剂法检测血清内毒素(endotoxin,ETX),分光光度法检测二胺氧化酶(diamine oxidase,DAO)水平;检测均在院内检验科进行,由1名具有5年以上工作经验的检验科医师完成。
1.2.2.4 肠道菌群 治疗前后收集患者新鲜粪便0.5 g,采用磷酸盐缓冲液10倍连续稀释,混合均匀,需氧菌、厌氧菌浓度分别为1×107~1×108个/L、1×108~1×109个/L,采用选择性培养基(大肠埃希菌、乳酸杆菌、双歧杆菌培养基)培养,均匀涂抹50 μl稀释液至平板,各菌群涂布3个平板,大肠埃希菌、乳酸杆菌、双歧杆菌分别选择伊红美蓝琼脂、LBS琼脂、BBL琼脂,需氧菌、厌氧菌分别培养24 h、48 h,记录相同稀释度下菌群菌落数,采用lg(n/g)表示;细菌的培养在院内微生物实验室进行,由1名具有中级职称的微生物检验技师完成。
1.2.2.5 粪便样品DNA定量分析 治疗前后收集患者新鲜大便0.2 g,采用TIANamp Bacteria DNA Kit试剂盒提取粪便细菌基因组DNA,根据大肠埃希菌、乳酸杆菌、双歧杆菌16SrDNA基因序列设计特异性PCR引物,由上海生工生物工程技术服务有限公司合成;采用16SrDNA荧光定量PCR法对待测粪便样品进行DNA定量分析,反应体系、反应条件参考文献[7]。
1.2.2.6 免疫球蛋白水平检测 治疗前后采集患者外周空腹静脉血5 ml,分离血清待测,采用血清蛋白醋酸纤维膜电泳检测血清免疫球蛋白A(IgA)、IgG、IgM水平。
1.2.2.7 不良反应 记录患者用药不良反应。
1.3 统计学分析 采用SPSS19.0软件进行统计分析,计数资料用[n(%)]描述,行χ2检验,等级资料行两独立样本秩和检验;计量资料用±s表述,组间比较、组内治疗前后比较分别行独立样本t检验、配对样本t检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较 治疗12周后,两组疗效比较差异有统计学意义(P<0.05),且观察组总有效率高于对照组(P<0.05)。见表1。
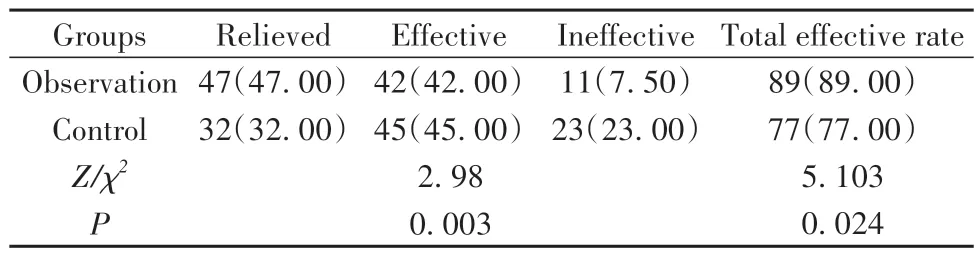
表1 两组临床疗效比较[例(%),n=100]Tab.1 Comparison of clinical efficacy between two groups[n(%),n=100]
2.2 两组治疗前后活动度分级比较 治疗前,两组活动度分级比较差异无统计学意义(P>0.05);治疗后12周,两组活动度分级均明显优于治疗前(P<0.05),且观察组优于对照组(P<0.05)。见表2。
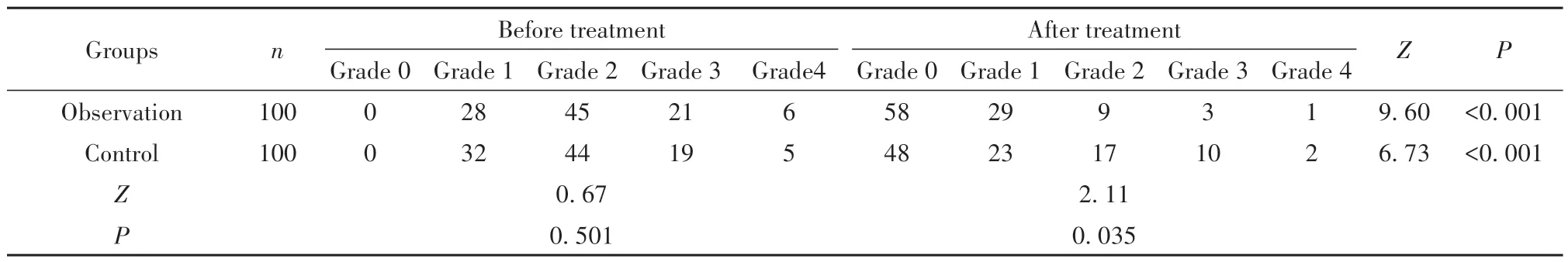
表2 两组治疗前后活动度分级比较(例)Tab.2 Comparison of activity classification between two groups before and after treatment(n)
2.3 两组治疗前后血清ETX、DAO水平比较 治疗前,两组血清ETX、DAO水平差异无统计学意义(P>0.05);治疗12周后,两组血清ETX、DAO水平较治疗前明显下降(P<0.05),且观察组血清ETX、DAO水平均明显低于对照组(P<0.05)。见表3。
表3 两组治疗前后血清ETX、DAO水平比较(±s)Tab.3 Comparison of serum ETX and DAO levels between two groups before and after treatment (±s)
Note:Compared with before treatment group, 1)P<0.05;compared with control group, 2)P<0.05.
Groups Observation Control n ETX/(EU·ml-1)Before treatment 0.18±0.05 0.17±0.06 1.280 0.202 After treatment 4.78±1.361)2)6.14±1.521)6.668<0.001 100 100 t P After treatment 0.05±0.011)2)0.08±0.021)13.416<0.001 DAO/(U·ml-1)Before treatment 7.85±2.02 7.76±2.14 0.306 0.760
2.4 两组治疗前后各菌群菌落数比较 治疗前,两组各菌落菌群数差异无统计学意义(P>0.05);治疗12周后,观察组大肠埃希菌菌落数明显低于治疗前及对照组治疗后(P<0.05),乳酸杆菌、双歧杆菌菌落数均高于治疗前及对照组治疗后(P<0.05),对照组各菌群菌落数与治疗前比较差异均无统计学意义(P>0.05)。见表4。
表4 两组治疗前后各菌群菌落数比较[±s,lg(n/g)]Tab.4 Comparison of colony counts of intestinal flora between two groups before and after treatment [±s,lg(n/g)]
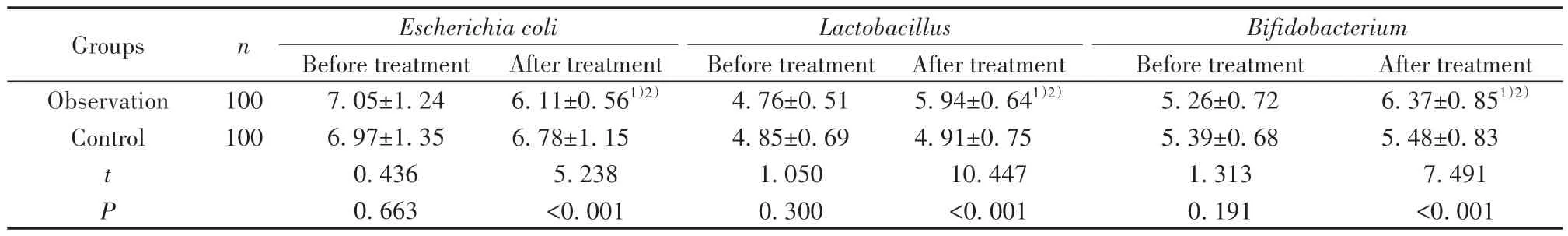
表4 两组治疗前后各菌群菌落数比较[±s,lg(n/g)]Tab.4 Comparison of colony counts of intestinal flora between two groups before and after treatment [±s,lg(n/g)]
Note:Compared with before treatment, 1)P<0.05;compared with control group, 2)P<0.05.
Groups Observation Control n After treatment 6.37±0.851)2)5.48±0.83 7.491<0.001 100 100 t P Escherichia coli Before treatment 7.05±1.24 6.97±1.35 0.436 0.663 After treatment 6.11±0.561)2)6.78±1.15 5.238<0.001 Lactobacillus Before treatment 4.76±0.51 4.85±0.69 1.050 0.300 After treatment 5.94±0.641)2)4.91±0.75 10.447<0.001 Bifidobacterium Before treatment 5.26±0.72 5.39±0.68 1.313 0.191
2.5 两组治疗前后粪便标本细菌定量结果 治疗前,两组各细菌16SrDNA拷贝数比较差异无统计学意义(P>0.05);治疗12周后,观察组大肠埃希菌数量明显低于治疗前及对照组治疗后(P<0.05),乳酸杆菌、双歧杆菌数量均高于治疗前及对照组治疗后(P<0.05),对照组各细菌数量与治疗前比较差异均无统计学意义(P>0.05)。见表5。
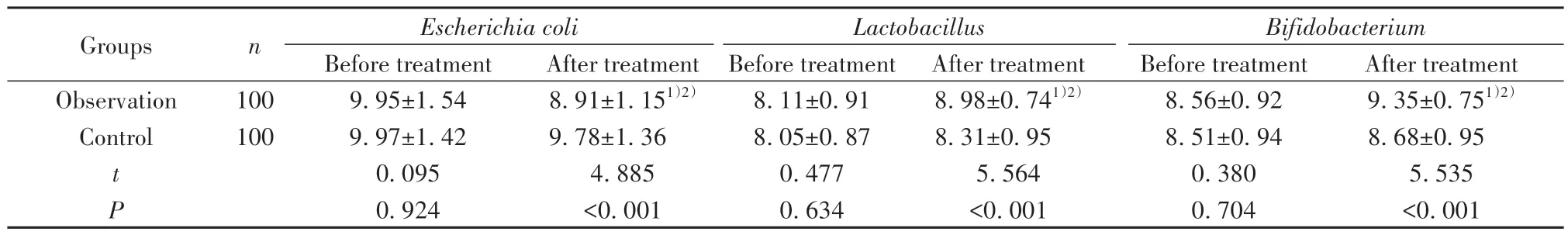
表5 两组治疗前后粪便标本细菌定量结果比较[Xlgx±Slgx,拷贝数/克湿粪]Tab.5 Comparison of bacterial quantitation results of feces samples between two groups before and after treatment [Xlgx±Slgx, copy count/g (wet feces)]
2.6 两组治疗前后血清免疫球蛋白水平比较 治疗前,两组血清IgA、IgG、IgM水平差异无统计学意义(P>0.05);治疗12周后,观察组血清IgA、IgM水平均明显高于治疗前及对照组治疗后(P<0.05),对照组血清IgA、IgG、IgM水平与治疗前比较差异无统计学意义(P>0.05)。见表6。
表6 两组治疗前后血清免疫球蛋白水平比较(±s,g/L)Tab.6 Comparison of serum immunoglobulins levels between two groups before and after treatment (±s,g/L)

表6 两组治疗前后血清免疫球蛋白水平比较(±s,g/L)Tab.6 Comparison of serum immunoglobulins levels between two groups before and after treatment (±s,g/L)
Note:Compared with before treatment group, 1)P<0.05;compared with control group, 2)P<0.05.
Groups Observation Control n After treatment 1.17±0.351)2)0.98±0.33 3.950<0.001 100 100 t P IgA Before treatment 1.95±0.44 1.92±0.41 0.499 0.619 After treatment 2.21±0.381)2)1.95±0.43 4.531<0.001 IgG Before treatment 12.88±2.31 12.72±2.54 0.466 0.642 After treatment 12.37±2.25 12.48±2.38 0.336 0.737 IgM Before treatment 0.91±0.22 0.95±0.24 1.229 0.221
2.7 两组药物不良反应 治疗期间,两组均未见严重影响治疗的不良反应,观察组发生2例腹胀、3例恶心、2例皮疹、1例轻度白细胞降低、1例轻度肝功能异常,不良反应发生率为9.00%;对照组发生4例腹胀、1例头晕、3例皮疹、3例轻度白细胞下降、2例轻度肝功能异常,不良反应发生率为13.00%,两组不良反应发生率比较差异无统计学意义(P>0.05),且均无需特殊处理,后期可自行消退。
3 讨论
UC是以20~49岁为高发群体的一类常见炎症性肠疾病,近年来,其发病率呈明显上升趋势,被认为是现代难治疾病[8]。当前UC病因、病机并未完全阐明,一般认为与遗传、感染、饮食、精神心理、免疫、肠道微生物等多种因素有关[9]。美沙拉嗪是当前UC治疗中应用最多的一种不含磺胺的5-氨基水杨酸制剂,其肠溶片经口服后于大肠崩解,药物大部分可到达结肠并作用于炎症黏膜,通过抑制自然杀伤细胞活性、抑制前列腺素及白三烯等炎症介质形成、清除氧自由基等途径对肠壁炎症产生显著消炎效果,从而达到诱导和维持缓解作用[10]。本研究对照组采用美沙拉嗪治疗,治疗12周后,总有效率达77.00%,与既往报道类似[11-12]。
人类肠道栖息着不同种类、数量的细菌,包括需氧菌、兼性厌氧菌、厌氧菌,其中专性厌氧菌占99%以上,且以乳酸杆菌、双歧杆菌占绝大多数,正常情况下这些菌群维持着动态平衡状态,对宿主的营养吸收、免疫调节、抵御致病菌等具有重要意义,但在多种因素影响下,肠道菌群可出现失调,引起肠道屏障功能、机体免疫力等下降,进而引起或加重疾病[13]。当前,肠道菌群失调在UC的发生、发展中越来越受重视,患者主要表现为病原菌大量繁殖、益生菌数量减少,且随着疾病活动度增加,病原菌会进一步增多,有益菌会进一步减少,调整肠道菌群平衡成为新的治疗方向[14]。地衣芽孢杆菌活菌胶囊是一种主要成分为地衣芽孢杆菌的好氧或兼性好氧益生菌制剂,相较双歧杆菌、乳杆菌等发酵来源益生菌,其对胃肠道环境耐受性更好,存活率可达90%以上,其到达肠道后,可引起肠道环境低氧状态,促进双歧杆菌、乳杆菌等肠道优势菌群生长,抑制好氧致病菌生长,进而调整肠道菌群失调,且该药可促进机体产生抗菌活性物质,杀灭致病菌[15]。本研究显示,观察组治疗后总有效率达89.00%,高于对照组,且改良Baron内镜活动度分级明显优于对照组,说明辅以地衣芽孢杆菌活菌胶囊治疗,可进一步提高临床疗效,减轻肠道炎症,与张煦等[16]的报道类似。
UC患者因肠道炎症反应可引起肠杯状细胞损害及其黏液分泌下降、肠上皮细胞坏死脱落,进而导致肠道通透性改变,黏膜屏障功能下降。当机体肠道黏膜屏障功能降低时,肠道ETX可穿过肠黏膜进入血液循环,存在于肠黏膜上层绒毛细胞质中的DAO也会释放入血,因此检测血清ETX、DAO可反映肠黏膜通透性及屏障功能[17]。本研究结果显示,治疗后两组血清ETX、DAO水平均较治疗前降低,且观察组明显低于对照组,提示予以地衣芽孢杆菌活菌胶囊治疗后,患者肠道黏膜屏障功能得到改善,可能与患者肠道炎症反应减轻、组织微循环及缺氧状态得到改善有关。黄晓春等[18]研究显示,地衣芽孢杆菌用于老年腹泻患者,能明显改善患者肠道黏膜通透性,支持本研究结果。比较两组治疗前后肠道菌群变化发现,观察组治疗后大肠埃希菌菌落数及16SrDNA拷贝数低于治疗前及对照组治疗后,乳酸杆菌、双歧杆菌菌落数及16SrDNA拷贝数均高于治疗前及对照组治疗后,而对照组各菌群菌落无明显改善,提示地衣芽孢杆菌活菌胶囊对患者肠道菌群可起到明显调节作用。既往研究显示,UC患者肠道菌群失调与机体免疫异常关系密切,可表现出血清IgA、IgM等免疫球蛋白下降,且病情越重,患者免疫力越低[19]。本研究结果显示,治疗后观察组血清IgA、IgM水平均明显高于治疗前及对照组治疗后,提示予以地衣芽孢杆菌活菌胶囊有助于调节免疫功能。
综上所述,地衣芽孢杆菌活菌胶囊辅助治疗UC患者可进一步提高临床疗效,减轻疾病活动度,对增强患者肠道黏膜屏障功能、调整肠道菌群平衡、改善免疫功能也发挥积极意义,具有临床应用价值。

