血清IL-34表达水平与原发性胆汁性胆管炎的相关性分析
唐笛娇 王艳萍 邹麟 陈瀑 李侨 (重庆医科大学附属第一医院检验科,重庆 400060)
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是主要累及肝内小叶间胆管的器官特异性自身免疫性疾病,可导致胆管上皮细胞死亡、胆囊周围纤维化、胆汁淤积,若控制不佳可进展为肝纤维化甚至最终发展为肝硬化,已成为最常见的肝内胆道疾病之一[1]。随着对该疾病认知和检测水平提高,PBC全球发病率均呈上升趋势,我国发病率为49.2/10万[2]。目前PBC诊断基于特异性血清抗线粒体抗体(anti-mitochondrial antibody,AMA)对丙酮酸脱氢酶复合体E2亚基(PDC-E2)的反应(>95%患者)。PBC起病隐匿,发病机制不明,仍是自身免疫性肝病难点之一。PBC目前被认为是一种多因素多基因疾病,许多动物模型表明,对自身组织(抗原)丧失免疫耐受和产生自身抗体是PBC发生的基础,在免疫信号、外源修饰蛋白和微生物免疫等共同作用下导致小叶间胆管炎发生[1]。肝内胆管上皮细胞(biliary epithelial cells,BECs)是肝细胞重要组成,其损伤机制是研究PBC发病机制的关键。过度活化的T细胞和B细胞是目前研究较多的方向,但仍未解释PBC中BEC的攻击特异性。最近一项研究表明,来自胆道小上皮细胞的凋亡小体可诱导PBC患者巨噬细胞分泌细胞因子。AMA存在条件下,PBC患者巨噬细胞、BEC凋亡小体和AMA可组成三联体,导致炎症细胞因子暴发[3]。提示巨噬细胞和AMAs与胆管损伤有关,并解释了PBC的组织特异性。
IL-34是一种新型细胞因子,为分泌型同二聚体糖蛋白,是集落刺激因子1受体(colony-stimulating factors-1R,CSF-1R)的组织特异性配体,可激活多种信号通路,调控巨噬细胞主要功能,包括增殖、分化、生存、代谢、细胞因子/趋化因子表达及细胞黏附和迁移[4]。IL-34结合至CSF-1R有助于髓系细胞增殖和生存。此外,巨噬细胞在PBC患者中起重要作用[4-5]。尽管IL-34被认为是几种疾病的关键诊断指标[6],但IL-34与PBC、AMA的关系以及与PBC进展的相关性尚未明确。因此,本研究探讨IL-34在AMA阳性PBC患者血清中的表达,更好地了解IL-34与PBC的关系,改善对PBC的认知。
1 资料与方法
1.1 资料
1.1.1 研究对象 收集2020年6月至2021年12月重庆医科大学第一附属医院及两所分院可检测到AMA-M2阳性的PBC患者49例,女47例,男2例,平均年龄(57.55±14.15)岁。PBC诊断标准符合中华医学会肝病学分会制定的《原发性胆汁性胆管炎的诊断和治疗指南(2021)》[7]。纳入标准满足以下3条标准中的2条:①存在胆汁淤积的生物化学证据,主要为碱性磷酸酶(ALP)和γ-谷氨酰转氨酶(GGT)升高,且影像学检查排除肝外或肝内大胆管梗阻;②AMA-M2阳性;③组织学上有非化脓性破坏性胆管炎和小胆管破坏证据。排除标准:①合并其他可能引起胆汁淤积相关生化指标升高的疾病,包括病毒性肝炎、脂肪肝、自身免疫性肝炎、原发性硬化性胆管炎、肝内局部胆管梗阻、肝外胆管梗阻和药物性肝损害等;②合并其他自身免疫病,如干燥综合征;③接受过生物制剂、免疫抑制剂或激素治疗。从重庆医科大学附属第一医院体检中心收集健康对照者50例,平均年龄(55.64±16.21)岁,纳入标准:①性别和年龄与其他两组基本匹配;②身体状况好,无感冒、消化不良等不适;③既往无自身免疫病、传染病和肿瘤病史,无自身免疫病和肿瘤相关家族史;④无其他可能引起肝脏酶学和或引起胆汁淤积生化指标升高的疾病。收集每例PBC患者标准化病史并进行体格检查,9例未经熊去氧胆酸(ursodeoxycholic acid,UDCA)治疗的PBC患者入组后均接受13~15 mg/(kg·d) UDCA口服治疗。9例患者UDCA治疗6个月后再次收集血液样本。收集PBC患者血清样本,完成所有患者病史信息和体格检查。所有患者均要求空腹,禁食8 h,避免血脂影响,早上空腹抽取外周静脉血4 ml,孵育30 min,3 000 r/min离心6 min,收集血清于EP管,-80 ℃保存。本研究经重庆医科大学第一附属医院伦理委员会批准,所有操作按地区伦理委员会指导原则和规范进行,所有参与者知情同意。
1.1.2 试剂与仪器 ELISA检测试剂盒(R&D,USA);生化仪(Cobas 701,Roche,Switzerland);特定蛋白分析仪(image 800,Beckman,USA);欧蒙免疫印迹仪(EURO BlotMaster,Euroummun,Germany);免疫分析仪(YHLO Union,YHLO,中国);酶标仪(Tecan,奥地利)。
1.2 方法
1.2.1 实验室数据检测 实验室常规检测项目包括:血常规、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、GGT、ALP、乳酸脱氢酶(LDH)、三酰甘油(TG)、胆红素(BIL)、IgG、IgM、抗线粒体抗体M2(AMA-M2)及细胞因子IL-1、IL-2、IL-6、IL-8、IL-10、TNF-α。以上各指标均由实验室自动化仪器检测并按照厂家说明书进行测试。率比色法检测血清AST、ALT、ALP、LDH、GGT、BIL和TG水平。比浊法测定血清IgG和IgM水平。免疫印迹法检测血清AMA-M2。仅AMA-M2阳性患者进一步定量。ELISA测定人血清AMA-M2浓度,由免疫分析仪自动进行。化学发光法定量测定人血清IL-1、IL-2、IL-6、IL-8、IL-10和TNF-α浓度。所有方法均按生产商操作流程执行。
1.2.2 血清标本IL-34水平测定 根据生产商说明书采用ELISA试剂盒测定血清IL-34水平。收集49例患者和50例健康对照者血清,按照试剂说明书要求制备所有试剂、标准品和样本。标准品制备:900 μl校准品稀释液移至100 μl浓度为2 000 pg/ml的原液标准品管,混匀后吸取500 μl转移至第二管进行对倍稀释,使用原液产生稀释系列7管,打开微孔板密封袋,每孔加100 μl稀释液后每孔加入50 μl待测血清、标准品和对照,胶膜封板,室温下在水平轨道微孔板摇床上振摇孵育2 h,轨道设置(500±50) RPM,用预先配制的洗涤缓冲液洗板3次,每孔加入400 μl洗涤缓冲液,每次均保证液体拍干无残留,每孔加入200 μl人IL-34酶结合抗体,胶膜封板,室温下水平轨道微孔板摇床振摇孵育2 h,重复上述洗板步骤3次,每孔加入200 μl底物溶液,室温下在桌面避光孵育30 min,每孔加入50 μl终止液,酶标仪在30 min内测定450 nm处吸光度。
1.3 统计学处理 所有数据均采用SPSS21.0软件进行分析,PBC患者与对照组采用Mann-WhitneyU检验分析两组间差异。采用Mann-WhitneyU检验分析IL-34水平与其他连续变量的关系。Spearman相关分析法分析IL-34与其他连续变量的关系。配对T检验比较同一患者相同指标治疗前后差异。P<0.05为差异有统计学意义。
2 结果
2.1 患者基本资料 PBC患者和健康对照者年龄、性别匹配,PBC患者血清ALT、AST、GGT、ALP、LDH、TG、BIL、IgG、IgM水平明显高于健康对照组(P<0.05,表1),PBC患者临床表现特点如表2所示,无明显临床症状患者13例。
表1 PBC患者及健康对照者基本资料(±s)Tab.1 Baseline clinical characteristics of PBC patients and controls (±s)
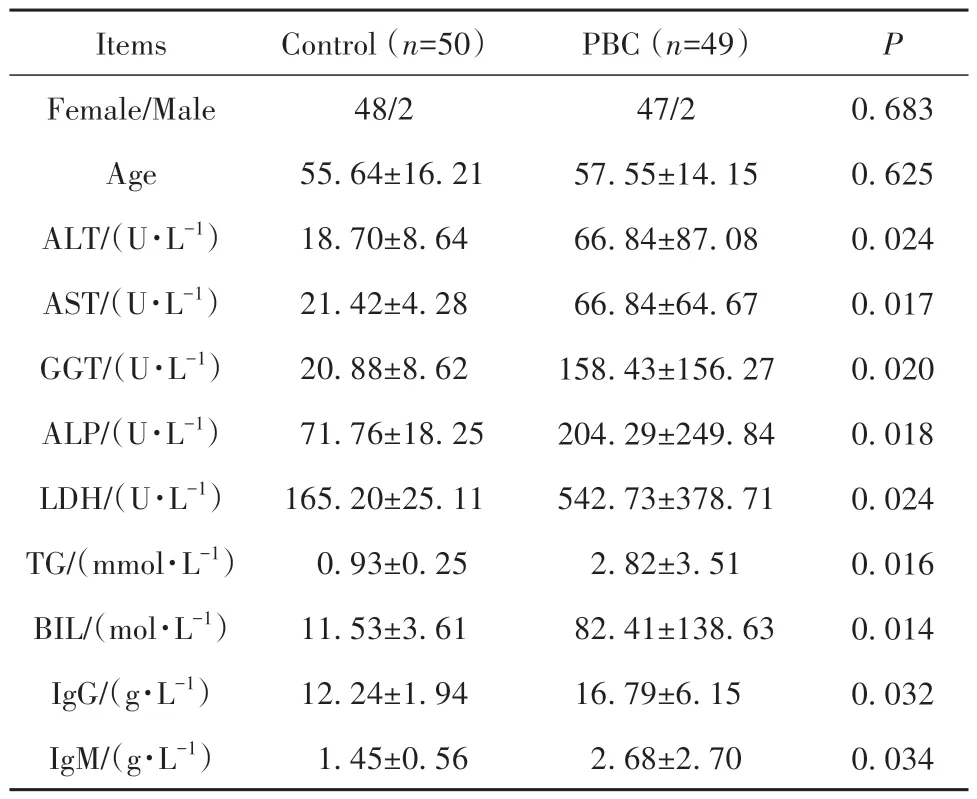
表1 PBC患者及健康对照者基本资料(±s)Tab.1 Baseline clinical characteristics of PBC patients and controls (±s)
Items Female/Male Age ALT/(U·L-1)AST/(U·L-1)GGT/(U·L-1)ALP/(U·L-1)LDH/(U·L-1)TG/(mmol·L-1)BIL/(mol·L-1)IgG/(g·L-1)IgM/(g·L-1)Control (n=50)48/2 55.64±16.21 18.70±8.64 21.42±4.28 20.88±8.62 71.76±18.25 165.20±25.11 0.93±0.25 11.53±3.61 12.24±1.94 1.45±0.56 PBC (n=49)47/2 57.55±14.15 66.84±87.08 66.84±64.67 158.43±156.27 204.29±249.84 542.73±378.71 2.82±3.51 82.41±138.63 16.79±6.15 2.68±2.70 P 0.683 0.625 0.024 0.017 0.020 0.018 0.024 0.016 0.014 0.032 0.034
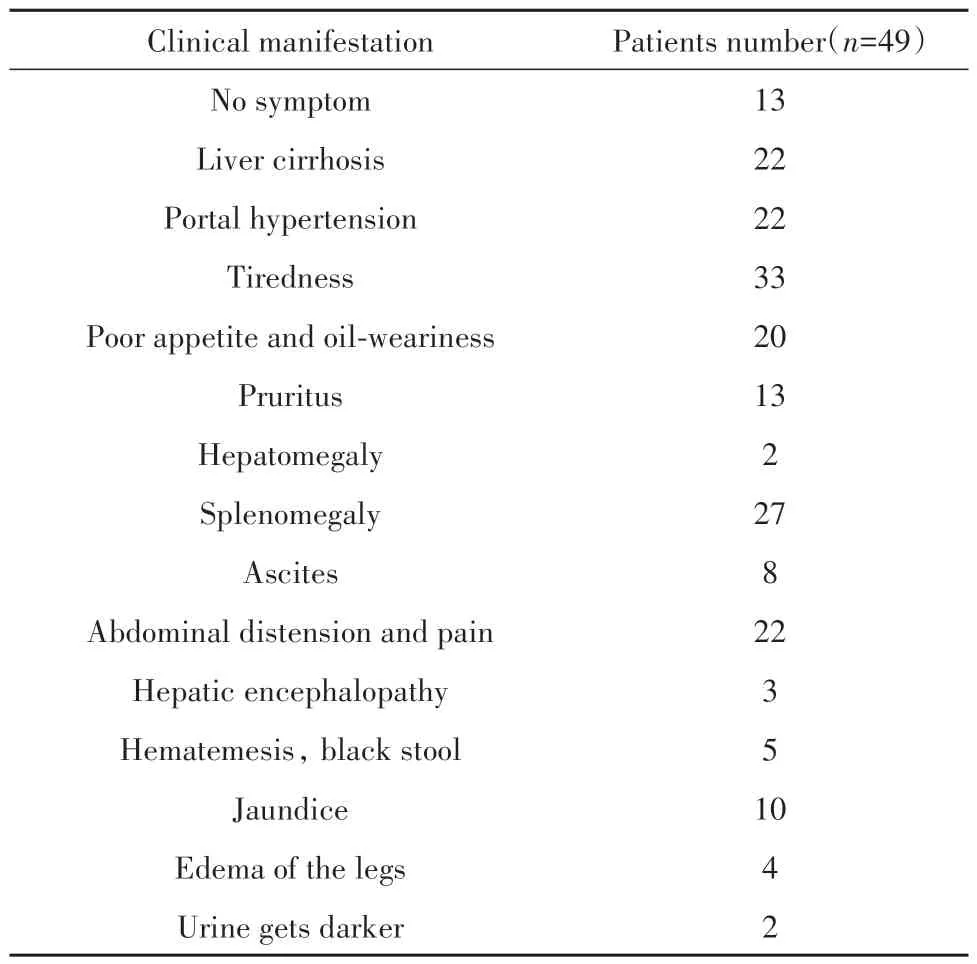
表2 PBC患者临床表现Tab.2 Clinical manifestation of PBC patients
2.2 PBC患者血清IL-34水平升高 比较49例PBC患者和50例健康对照者血清IL-34水平以探讨IL-34在PBC发病中的作用,结果显示PBC患者IL-34水平明显高于健康对照组[82.37(22.57~264.20) pg/mlvs37.67(28.87~63.54) pg/ml,P<0.05,图1]。
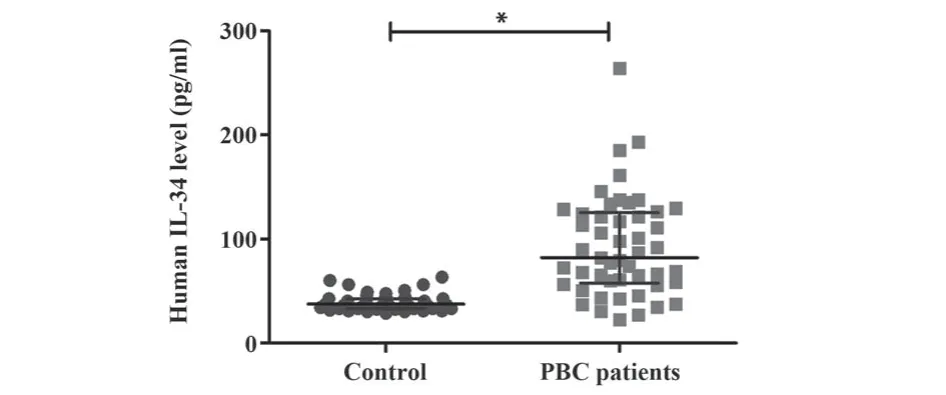
图1 PBC患者和健康对照者血清IL-34表达Fig.1 Serum IL-34 level in healthy control subjects and patients with PBC
2.3 IL-34与AMA-M2的相关性分析 AMA-M2是PBC最特异的标志物,AMA存在下巨噬细胞被激活。收集数据的所有患者均检测到AMA-M2,ELISA对AMA-M2进行血清学定量检测,结果显示IL-34升高与AMA-M2定量相关(r2=0.16,P<0.042,图2A),但相关系数不佳,尚不足以证实正相关结论,需进一步讨论。
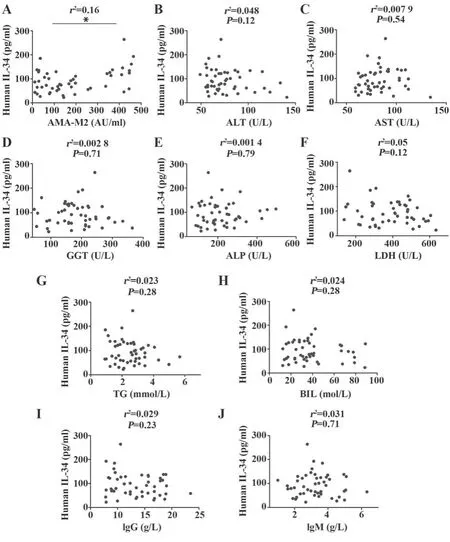
图2 血清IL-34与各指标的相关性分析Fig.2 Correlation analysis between serum IL-34 and each index
2.4 PBC患者血清IL-34水平与肝功能指标及免疫球蛋白的关系 IL-34水平与ALT(r2=0.048,P=0.12)、AST(r2=0.007 9,P=0.54)、GGT(r2=0.002 8,P=0.71)、ALP(r2=0.001 4,P=0.79)、LDH(r2=0.05,P=0.12)、TG(r2=0.023,P=0.28)、BIL(r2=0.024,P=0.28)、IgG(r2=0.029,P=0.23)、IgM(r2=0.003 1,P=0.71)等均无显著相关关系(图2B~J)。
2.5 PBC患者血清IL-34水平与临床表现的关系PBC患者临床表现存在显著个体差异。肝组织病理学检查并非诊断必需,仅少数患者有肝组织活检结果,无法根据肝脏病理学表现对入组患者进行分期。根据临床症状(表2)和肝功能指标(表1)将患者分为3组:Ⅰ组无症状,仅肝功能指标异常;Ⅱ组有临床症状及肝功能指标异常,但无肝硬化;Ⅲ组为肝硬化组。比较IL-34水平差异,结果显示血清IL-34水平在不同临床表现间差异无统计学意义(P>0.05,表3)。
2.6 PBC患者血浆细胞因子浓度 如表4所示,PBC组血清IL-2、IL-6和TNF-α浓度显著高于健康对照组。PBC血清IL-1、IL-8、IL-10浓度较健康对照组升高,但差异无统计学意义(P>0.05)。
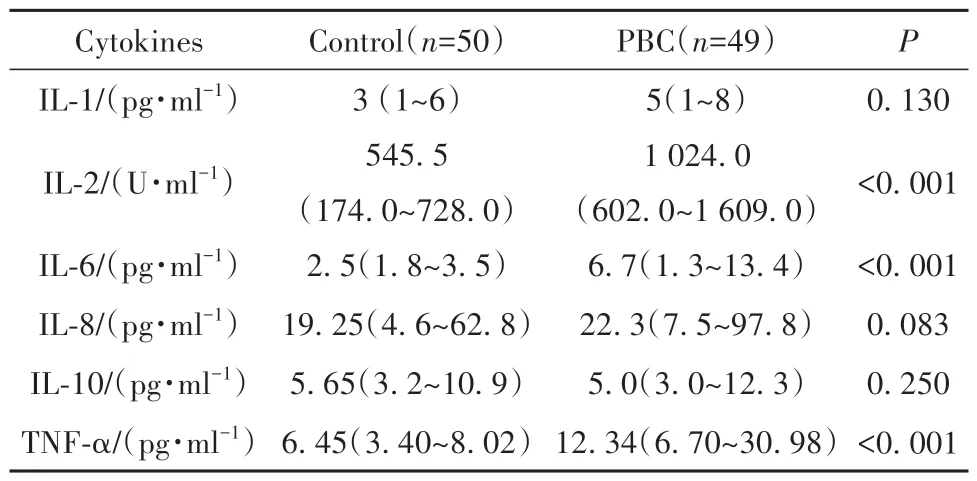
表4 PBC患者炎症细胞因子浓度 [Median (min~max)]Tab.4 Serum cytokine levels in patients with PBC and healthy controls [Median(min-max)]
2.7 PBC患者血清IL-34水平与血清细胞因子水平的关系 分析PBC中IL-34与IL-1、IL-2、IL-6、IL-8、IL-10和TNF-α等细胞因子的关系,IL-34与IL-1(r2=0.030,P=0.23)、IL-2(r2=0.002,P=0.72)、IL-6(r2=0.020,P=0.29)、IL-8(r2=0.050,P=0.12)、IL-10(r2=0.010,P=0.60)、TNF-α(r2=0.010,P=0.51)均无显著相关性(图3)。
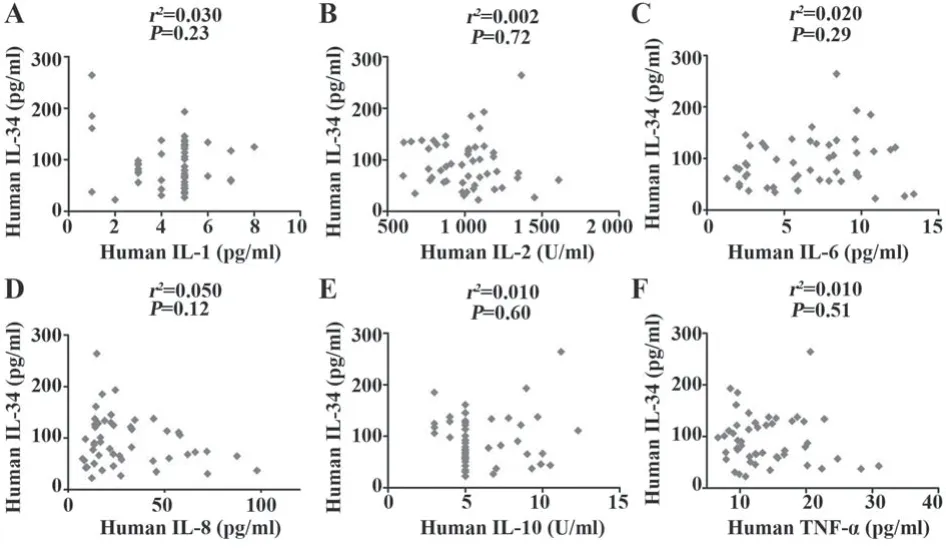
图3 血清IL-34与炎症细胞因子的相关性分析Fig.3 Correlation analysis between serum IL-34 and inflammatory cytokines
2.8 PBC患者血清IL-34水平治疗前后对比 UDCA是治疗PBC的一线药物,选取9例治疗前血清IL-34较健康对照明显升高的患者进行随访,UDCA治疗后进行血清IL-34检测,结果表明PBC患者经UDCA治疗后血清IL-34水平显著降低(P=0.023,图4)。
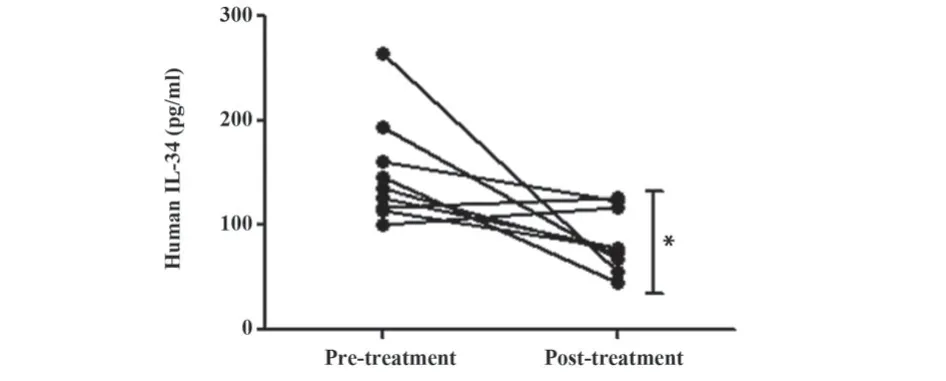
图4 血清IL-34治疗前后变化Fig.4 Changes of serum IL-34 before and after treatment
3 讨论
PBC被认为是一种典型的自身免疫性疾病,其特点为存在抗线粒体抗体AMA和BEC特异性破坏结果。免疫抑制剂已被证明对PBC几乎无效果[8]。PBC病因机制复杂,小胆管上皮细胞的靶向特异性是PBC发病机制的主要未解问题。所有有核细胞均有线粒体,但PBC中仅有肝内BECs和较小的唾液腺细胞是自身免疫攻击的目标。已有文献证明BECs可将免疫完整的PDC-E2转移至凋亡小体并形成凋亡细胞,确定研究巨噬细胞能够解释PBC的器官特异性[3]。深入了解巨噬细胞的预测指标及其在PBC进展中的功能作用对改善预后和治疗有重要意义。本研究表明PBC患者血清IL-34水平显著升高,并在一线药物治疗后显著降低,血清IL-34和AMA-M2存在一定相关性。
IL-34是CSF-1R的替代配体,可促进吞噬细胞增殖、存活、分化等多种生理功能和病理过程[9]。与仅和CSF-1R结合的CSF-1相比,IL-34可通过许多信号网络与CSF-1R、PTPz和CD138结合,在某些细胞亚群中产生部分重叠作用,发挥对巨噬细胞的调节作用[4]。
研究表明IL-34在肝脏病变进展中发挥关键作用,是慢性肝炎及肝组织炎症、纤维化患者的血清学指标[10]。免疫激活被认为参与PBC发病机制,其中巨噬细胞激活是最受关注的。LLEO等[3]证实AMA存在下,胆道小上皮细胞凋亡小体可刺激患者巨噬细胞释放强烈的炎症细胞因子。CD1a阳性的朗格汉斯细胞可能存在于PBC患者胆道上皮中[11]。越来越多的证据表明IL-34在单核吞噬细胞系增殖和分化、破骨细胞形成和炎症中发挥重要作用[6]。PBC患者单核细胞来源巨噬细胞与胆道小上皮细胞凋亡小体培养后,在AMAs存在下可显著增加TNF-α相关凋亡诱导配体表达[12]。推测IL-34在PBC患者中对巨噬细胞激活可能发挥重要作用,为证实该假设,本研究全部选取AMA阳性PBC患者,各种类型(M1~M9)中,M2被认为是诊断最特异的,但滴度与PBC疾病严重程度无关[13]。
患者基本资料调查显示,PBC部分患者无症状,但由于对该病认知不足,仍有约1/3患者出现了肝硬化,部分患者初诊时肝功能损伤较为严重,促进该病的普及尤其是偏远地区,路仍然很长。
本研究证实血清IL-34在PBC患者中有显著的表达上调趋势,并与PBC患者其他炎症因子水平显著相关。与健康对照组相比,PBC患者血清IL-2、IL-6和TNF-α等炎症细胞因子显著升高。但与预期一样,IL-34表达与肝功能指标、免疫球蛋白、病情严重程度及血清炎症白介素表达无显著相关性,但患者经过治疗后,血清IL-34表达显著下降,提示IL-34对PBC患者疾病发生及巨噬细胞激活有一定作用,但与疾病发展无显著相关性。报道显示IL-6增强IL-34诱导免疫抑制巨噬细胞分化的病理过程[14]。IL-34引起的巨噬细胞活化可诱导分泌炎症细胞因子,如IL-6、IL-8和TNF-α等,其下游作用可在AMA存在情况下进一步损伤BECs[15]。本研究虽表明血清IL-34和AMA-M2存在一定相关性,但经过结果讨论后认为目前数据尚不足以支持IL-34和AMA-M2定量结果存在正相关关系,且IL-34表达与疾病严重程度无关,需要更大样本量对该结果进行验证。
胆汁上皮细胞的免疫损伤循环导致胆汁淤积和肝细胞纤维化。PBC免疫学发病机制复杂。参与破坏胆管的免疫细胞包括T细胞、B细胞、单核细胞和巨噬细胞,T细胞和B细胞在PBC中的作用已有一些研究[16]。因此本研究关注单核-巨噬细胞系统。IL-34在单核吞噬细胞、谱系细胞和炎症增殖分化中起重要作用[17-18]。PBC中通过T和B细胞相互作用,AMAs产生特定于PDC-E2的组分,激活免疫细胞(包括巨噬细胞)。只有在AMAs存在情况下,PBC患者巨噬细胞与人BEC凋亡小体培养后才会分泌促炎细胞因子,包括高水平的IL-6(促炎,诱导IL-34表达)、IL-17(促炎,诱导IL-34表达)和TNF-α(诱导BEC凋亡或衰老)[19]。BECs死亡后进一步释放PDC-E2,产生更多凋亡小体,IL-34介导一个正反馈回路促进巨噬细胞增殖分化。另一方面,IL-34是一种参与纤维原性巨噬细胞活化诱导的细胞因子,与肝纤维化和炎症严重程度相关[20]。综上,AMA存在下,IL-34介导的巨噬细胞激活对BEC造成了特异性损伤。
本研究证明IL-34血清表达在AMA-M2阳性PBC患者中升高,并在治疗有效患者中水平明显降低。PBC患者血清IL-34表达与部分炎症因子呈正相关,提示AMA存在情况下,IL-34介导的巨噬细胞活化对肝BEC造成了特异性损伤。本研究揭示IL-34可能是PBC发生和潜在治疗的重要炎症介质,血清IL-34可能成为PBC的候选生物标志物。
(3)在区域内部不平等贡献率中,城市群地区对总的收入不平等程度的贡献占比最高并不断提升,从1986年与非城市群地区对总的收入不平等贡献率从36.7∶62.0上升到2014年24.5∶72.9。其结果意味着,城市群地区对总收入不平等的贡献率比重将进一步提升,这可能是由于城镇化引起的,因此中国在未来加快城镇化过程的同时要防范区域收入不平等的进一步加剧。
[1]RODRIGUES P M, PERUGORRIA M J,SANTOS A,et al.Primary biliary cholangitis:A tale of epigenetically-induced secretory failure?[J].Hepatol,2018,69(6):1371-1383.DOI:10.1016/j.jhep.2018.08.020.
[2]GONZALEZ R S,WASHINGTON K.Primary biliary cholangitis and autoimmune hepatitis[J].Surg Pathol Clin,2018,11(2):329-349.DOI:10.1016/j.path.2018.02.010.
[3]LLEO A,BOWLUS C L,YANG G X,et al.Biliary apotopes and anti-mitochondrial antibodies activate innate immune responses in primary biliary cirrhosis[J].Hepatology,2010,52(2):987-998.DOI:10.1002/hep.23783.
[4]程苕莼,李 民,李 晗,等.白介素34在自身免疫性疾病中的研究进展[J].中国免疫学杂志,2021,37(23):2924-2928.DOI:10.3969/j.issn.1000-484X.2021.23.020.
[5]LLEO A,SELMI C,INVERNIZZI P,et al.Apotopes and the biliary specificity of primary biliary cirrhosis[J].Hepatology,2009,49(3):871-879.DOI:10.1002/hep.22736.
[6]BAGHDADI M,ENDO H,TANAKA Y,et al.Interleukin 34,from pathogenesis to clinical applications[J].Cytokine,2017,99:139-147.DOI:10.1016/j.cyto.2017.08.020.
[7]中华医学会肝病学分会.原发性胆汁性胆管炎的诊断和治疗指南(2021)[J].中华内科杂志,2021,60(12):1024-1037.DOI:10.3760/cma.j.cn112138-20211112-00794.
[8]GRIFFITHS L,DYSON J K,JONE D E.The new epidemiology of primary biliary cirrhosis[J].Semin Liver Dis,2014,34(3):318-328.DOI:10.1055/s-0034-1383730.
[9]LIN H,LEE E,HESTIR K,et al.Discovery of a cytokine and its receptor by functional screening of the extracellular proteome[J].Science,2008,320(5877):807-811.DOI:10.1126/science.115 4370.
[11]GRAHAM R P,SMYRK T C,ZHANG L.Evaluation of langerhans cell infiltrate by CD1a immunostain in liver biopsy for the diagnosis of primary biliary cirrhosis[J].Am J Surg Pathol,2012,36(5):732-736.DOI:10.1097/PAS.0b013e31824b1dff.
[12]SELMI C,GERSHWIN M E,The role of environmental factors in primary biliary cirrhosis[J].Trends Immunol,2009,30(8):415-420.DOI:10.1016/j.it.2009.05.006.
[13]CAREY E J,ALI A H,LINDOR K D.Primary biliary cirrhosis[J].Lancet,2015,386(10003):1565-1575.DOI:10.1016/S01 40-6736(15)00154-3.
[14]FOUCHER E D,BLANCHARD S,PREISSER L,et al.IL-34 induces the differentiation of human monocytes into immunosuppressive macrophages.Antagonistic effects of GM-CSF and IFNgamma[J].PLoS One,2013,8(2):e56045.DOI:10.1371/journal.pone.0056045.
[15]吴夏楠,罗 艳,邹 鳞,等.IL-34诱导肺成纤维细胞IL-6、IL-8表达机制研究[J].中国免疫学杂志,2020,36(4):405-410.DOI:10.3969/j.issn.1000-484X.2020.04.005.
[16]HIRSCHFIELD G M,GERSHWIN M E.The immunobiology and pathophysiology of primary biliary cirrhosis[J].Annu Rev Pathol,2013,8:303-330.DOI:10.1146/annurev-pathol-020712-164014.
[17]WANG Y Q,CAO W J,GAO Y F,et al.Serum interleukin-34 level can be an indicator of liver fibrosis in patients with chronic hepatitis B virus infection[J].World J Gastroenterol,2019,24(12):1312-1320.DOI:10.3748/wjg.v24.i12.1312.
[18]ZWICKER S,MARTINEZ G L,BOSMA M,et al.Interleukin 34: A new modulator of human and experimental inflammatory bowel disease[J].Clin Sci (Lond),2015,129(3):281-290.DOI:10.1042/CS20150176.
[19]ZHOU R P,WU X S,XIE Y Y,et al.Functions of interleukin-34 and its emerging association with rheumatoid arthritis[J].Immunology,2016,149(4):362-373.DOI:10.1111/imm.12660.
[20]GALLIGAN C L,FISH E N.Interleukin-34 promotes fibrocyte proliferation[J].J Interferon Cytokine Res,2017,37(4):440-448.DOI:10.1089/jir.2017.0063.

