槲皮素通过下调缓激肽受体B1表达减轻糖尿病大鼠神经病理性疼痛
张书力 冯 丹 (武汉市第一医院疼痛科,武汉 430022)
糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)是临床上常见的糖尿病并发症之一,以肢端诱发或自发性痛觉超敏为主,夜间疼痛加剧,造成患者失眠、烦躁、精神差,极大影响其工作效率与生活质量,是如今医学研究的难点和热点[1-2]。高糖引发的炎症级联反应在DNP的发生和病情进展过程中起到关键作用,积极抗炎、减轻躯体神经组织受损是很有前景的DNP治疗策略[3-4]。槲皮素是普遍存在于植物中的黄酮类化合物,是一种天然抗氧化剂,具有降低血糖、消炎止痛、抗衰老等多种生物学活性,可通过降低血糖及抗氧化作用减轻糖尿病大鼠神经损伤,促使神经元存活[5];还能够以剂量依赖性方式降低紫杉醇诱导的炎症因子表达,减轻大鼠神经病理学疼痛[6]。由此可知,槲皮素对DNP具有很大的治疗潜力。激肽释放酶-激肽系统激活会促进病理性炎症产生并进行放大,参与介导糖尿病视网膜病变、神经病理性疼痛等疾病发病过程。而缓激肽B1受体(bradykinin B1 receptor,BDKRB1)是调控激肽系统的重要受体蛋白,在糖尿病患者体内过度表达,对其进行抑制可限制炎症发展,治疗高糖引发的视网膜疾病,并改善神经病理性疼痛症状[7-8]。但槲皮素是否可以通过下调BDKRB1表达减轻糖尿病导致的神经病理性疼痛尚未有明确阐述。本文通过构建DNP大鼠模型对此问题进行研讨。
1 材料与方法
1.1 材料
1.1.1 实验动物 78只SPF级SD雄性大鼠购自北京科兴中维生物技术有限公司,许可证号:SYXK(京)2020-0054,体质量180~210 g。于武汉市第一医院动物中心的屏障环境动物房中适应饲养1周后用于实验,分笼饲养,5~6只/笼,采用明暗各12 h循环交替进行光照,温度22.5~25.0 ℃,湿度55%~60%,通风设为9~12次/h。本研究经武汉市第一医院伦理委员会审批通过。
1.1.2 主要试剂与仪器 槲皮素(纯度:HPLC≥98%,货号:SQ8030)、大鼠白细胞介素-17(interleukin-17,IL-17) ELISA试剂盒(货号:SEKR-0007)、总RNA提取试剂盒(货号:R1200)、大鼠IL-18 ELISA试剂盒(货号:SEKR-0054)、大鼠环氧化酶-2(cyclooxygenase,COX-2)ELISA试剂盒(货号:SEKR-0075)、OCT冰冻切片包埋剂(货号:4583)购自北京索莱宝科技有限公司;BDKRB1过表达质粒、空载质粒、BDKRB1与GAPDH引物、一步法反转录荧光定量试剂盒(货号:B639277-0100)、RIPA裂解液(货号:C500005-0050)购自生工生物工程(上海)股份有限公司;兔源Anti-BDKRB1一抗(货号:ABR-011)购自上海优宁维生物科技股份有限公司;大鼠二步法免疫组织化学试剂盒(货号:ZLI-9017)购自北京中杉金桥公司;兔源Anti-β-Tubulin一抗(货号:ab21058)、兔源Anti-LFA-1一抗(货号:ab186873)购自美国Abcam公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(货号:P0012S)、羊抗兔二抗(货号:A0277)购自上海碧云天生物技术有限公司。Von Frey纤毛机械刺激针购自意大利UGO公司;ZH-YLS-6B智能热板仪购自上海珂淮仪器有限公司;ND-2000C超微量核酸分析仪、Multiskan FC多功能酶标仪购自美国赛默飞世尔科技公司;CFX96 Touch Deep Well荧光定量PCR仪、PowerPac Universal电泳仪购自美国Bio-Rad公司;CM1950冰冻切片机购自德国徕卡公司;CX23光学显微镜购自日本奥林巴斯公司;eBlot L1快速湿转仪购自南京贝登医疗股份有限公司;JS-1070P化学发光成像系统购自上海培清科技有限公司。
1.2 方法
1.2.1 DNP大鼠模型的制备及分组给药 SD大鼠给予60 mg/kg的链脲佐菌素(溶于生理盐水)腹腔注射,同时以Von Frey纤毛机械刺激针检测大鼠后足机械性缩足阈值,作为基础值,1周后取尾静脉血测量空腹血糖,选用连续2次测量值均>16.7 mmol/L的大鼠继续饲养,3周后再次检测大鼠后足机械性缩足阈值,当其<80%基础值时,表明DNP模型建立成功[9]。本研究造模65只,共成功60只,将其以随机数表法平均分为5组:模型组、槲皮素(100 mg/kg)组、BDKRB1过表达质粒组、空载质粒组、槲皮素(100 mg/kg)+BDKRB1过表达质粒组,另选12只大鼠,腹腔注射等剂量生理盐水,作为对照组。
将槲皮素加入生理盐水中溶解混匀,得到10 mg/ml的药液,槲皮素+BDKRB1过表达质粒组大鼠以10 ml/kg剂量灌胃药液,使槲皮素给药剂量达到100 mg/kg,1次/d[10]。同时参照文献[11]及说明书尾静脉注射BDKRB1过表达质粒,给药剂量为10 nmol,2次/周;槲皮素组大鼠每日灌胃100 mg/kg槲皮素1次,同时以与槲皮素+BDKRB1过表达质粒组相同的剂量尾静脉注射生理盐水,2次/周;BDKRB1过表达质粒组、空载质粒组大鼠参照文献[9]及说明书尾静脉注射BDKRB1过表达质粒与空载质粒,给药剂量均为10 nmol,每周2次,同时每日以与槲皮素+BDKRB1过表达质粒组相同的剂量灌胃生理盐水1次;对照组与模型组大鼠以与槲皮素+BDKRB1过表达质粒组相同的剂量尾静脉注射生理盐水,每周2次,同时每日以与槲皮素+BDKRB1过表达质粒组相同的剂量灌胃生理盐水1次,各组大鼠均给药干预3周。
1.2.2 检测大鼠痛觉超敏症状 最后一次给药后24 h,取出各组大鼠进行安抚,待其安静后,以Von Frey纤毛机械刺激针刺大鼠右侧后足至爪轻度弯曲,探针克数由小至大分别针刺6 s,记录大鼠产生缩足或舔爪疼痛反应时的探针克数,重复测量3次,取平均值,即得到机械缩足阈值。
机械性刺激痛觉检测结束后,将大鼠安抚至安静,智能热板仪的温度设为43~45 ℃,待温度达标后,分别将大鼠置于热板上,记录大鼠产生舔爪或撤回后足疼痛反应的所用时间,重复测量3次,取平均值,即得到热缩足潜伏期,为避免大鼠受伤,热缩足潜伏期最长为60 s。
热刺激痛觉检测结束后,将大鼠安抚至安静,于其后足皮肤上滴加0.1 ml丙酮,大鼠出现抬足行为时开始计时,至其放下抬起的后足,计时结束,共重复3次,得到的时间取平均值,即为冷刺激抬足时间。
1.2.3 采集标本并检测大鼠脊髓背根神经节淋巴细胞浸润情况 痛觉超敏检测结束后,大鼠吸入异氟醚麻醉,采集颈动脉血4 ℃离心,吸出上清、分组标记后-80 ℃保存备用。颈椎脱臼处死大鼠,解剖取出脊髓背根神经节,以手术剪取下0.4 g组织块保存在液氮中备用;以同样方法再次取脊髓背根神经节组织0.5 g,剪碎,冰水浴匀浆,4 ℃离心,吸出上清,BCA测量蛋白总浓度,分组标记后于-80 ℃保存备用;剩余脊髓背根神经节组织经生理盐水漂洗、30%蔗糖脱水沉底、OCT包埋、液氮冰冻成块、切片后,选出没有破损且厚薄均匀的切片复温5 min后浸入冰丙酮中固定,滴加LFA-1一抗孵育后洗涤,根据试剂盒说明书进行免疫组织化学染色后拍照,镜下观察,Image J软件分析计算背根神经节LFA-1阳性细胞比例(%)=LFA-1阳性细胞数/总细胞数×100%。
1.2.4 测定大鼠血清炎症介质IL-17、COX-2、IL-18水平 取1.2.3中冻存的血清,冰水浴解冻,参照试剂盒说明书测量其中IL-17、COX-2、IL-18水平。
1.2.5 检测大鼠脊髓背根神经节BDKRB1 mRNA表达水平 取1.2.3中冻存的脊髓背根神经节组织,置研钵中加入总RNA提取试剂研碎,参照试剂盒说明书提取组织中RNA后,超微量核酸分析仪测量其浓度,荧光定量PCR进行扩增,反应条件按照说明书设定,得到各组基因Ct值,以2-ΔΔCt法分析计算,GAPDH做内参对照,最终获得BDKRB1 mRNA的相对表达水平,引物序列见表1。
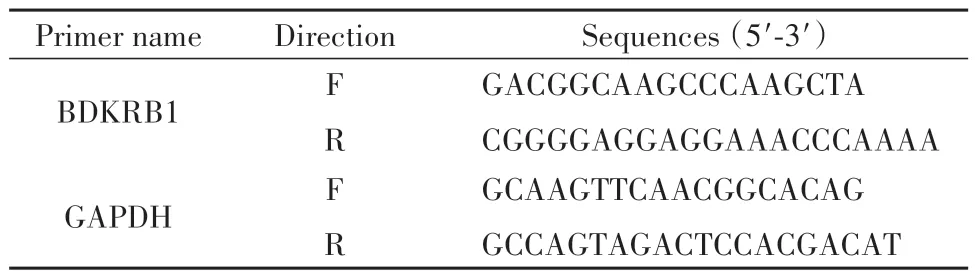
表1 基因引物序列Tab.1 Gene primer sequences
1.2.6 检测脊髓背根神经节BDKRB1蛋白表达自液氮中取出1.2.3中的脊髓背根神经节组织蛋白样品液,根据分子量测定结果各组均取总蛋白20 μg,煮沸变性(100 ℃,6 min)、上样电泳(恒压120 V,60 min)、湿转(稳流40 mA,70 min),以脱脂奶粉溶液封闭分离后蛋白的非特异位点,然后将目的蛋白BDKRB1、β-Tubulin自硝酸纤维膜上剪下,孵育一抗(4 ℃,10 h)、TBST洗涤(3次,5 min/次)、孵育二抗(37.5 ℃,90 min)、TBST洗涤(3次,5 min/次)、化学发光法显色、拍照,使用软件Image J定量图片中蛋白条带灰度值,进行统计分析后获得其相对表达量。
1.3 统计学分析 实验所得数据采用±s表示,作为计量资料输入SPSS24.0软件进行统计分析,两组间差异比较采用t检验;多组间差异比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 槲皮素对大鼠疼痛的影响 与对照组比较,模型组大鼠机械性缩足阈值降低,热敏潜伏期显著缩短(P<0.05),冷刺激抬足时间显著延长(P<0.05);与模型组、槲皮素+BDKRB1过表达质粒组分别比较,槲皮素组大鼠机械性缩足阈值增大,热敏潜伏期均延长(P<0.05),冷刺激抬足时间缩短(P<0.05);BDKRB1过表达质粒组大鼠机械性缩足阈值降低,热敏潜伏期均缩短(P<0.05),冷刺激抬足时间延长(P<0.05);空载质粒组大鼠机械性缩足阈值、冷刺激抬足时间、热敏潜伏期差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠机械性缩足阈值、冷刺激抬足时间、热敏潜伏期(±s,n=12)Tab.2 Mechanical paw withdrawal threshold, cold stimulation foot lift time and heat sensitivity latency of rats in each group (±s,n=12)

表2 各组大鼠机械性缩足阈值、冷刺激抬足时间、热敏潜伏期(±s,n=12)Tab.2 Mechanical paw withdrawal threshold, cold stimulation foot lift time and heat sensitivity latency of rats in each group (±s,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with quercetin+BDKRB1 overexpression plasmid group, 3)P<0.05.
Groups Control Model Quercetin BDKRB1 overexpression plasmid Empty plasmid Quercetin+BDKRB1 overexpression plasmid Mechanical paw withdrawal threshold/g 22.46±2.61 8.57±1.271)20.01±3.152)3)Cold stimulation paw lift time/s 2.43±0.36 13.05±1.431)3.01±0.392)3)Heat sensitivity latency/s 59.32±0.67 11.03±1.121)56.58±6.402)3)1.23±0.302)3)20.67±3.602)3)1.81±0.422)3)8.72±1.46 12.87±1.15 11.72±1.45 7.98±1.52 12.34±1.76 12.24±1.73
2.2 槲皮素对大鼠脊髓背根神经节淋巴细胞浸润的影响 与对照组比较,模型组大鼠脊髓背根神经节LFA-1阳性细胞比例显著升高(P<0.05);与模型组、槲皮素+BDKRB1过表达质粒组分别比较,槲皮素组大鼠脊髓背根神经节LFA-1阳性细胞比例均降低(P<0.05);BDKRB1过表达质粒组大鼠脊髓背根神经节LFA-1阳性细胞比例均升高(P<0.05);空载质粒组大鼠脊髓背根神经节LFA-1阳性细胞比例差异均无统计学意义(P>0.05)。见图1、表3。

图1 免疫组织化学染色检测各组大鼠脊髓背根神经节淋巴细胞浸润(×200)Fig.1 Lymphocyte infiltration in spinal dorsal root ganglion of rats in each group was detected by immunohistochemical staining (×200)
表3 各组大鼠脊髓背根神经节LFA-1阳性细胞比例(±s,n=12)Tab.3 Proportion of LFA-1 positive cells in spinal dorsal root ganglion of rats in each group (±s,n=12)
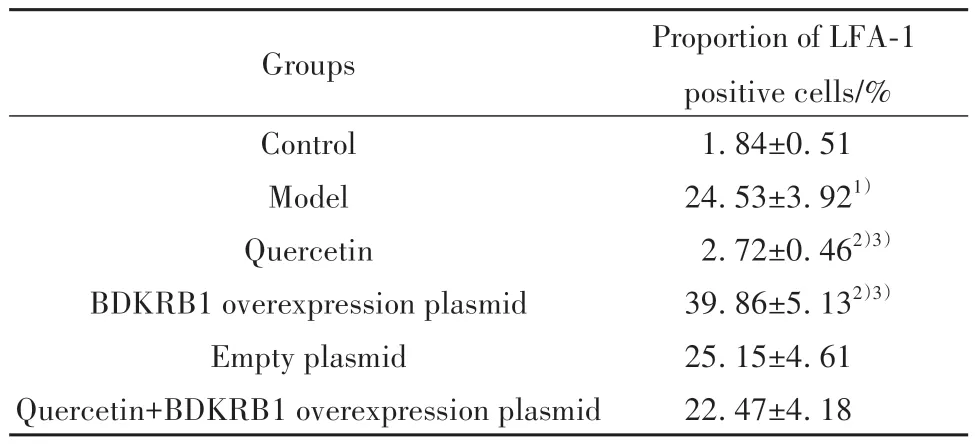
表3 各组大鼠脊髓背根神经节LFA-1阳性细胞比例(±s,n=12)Tab.3 Proportion of LFA-1 positive cells in spinal dorsal root ganglion of rats in each group (±s,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with quercetin+BDKRB1 overexpression plasmid group, 3)P<0.05.
Proportion of LFA-1 positive cells/%1.84±0.51 24.53±3.921)2.72±0.462)3)39.86±5.132)3)25.15±4.61 22.47±4.18 Groups Control Model Quercetin BDKRB1 overexpression plasmid Empty plasmid Quercetin+BDKRB1 overexpression plasmid
2.3 槲皮素对大鼠血清炎症介质IL-17、COX-2、IL-18水平的影响 与对照组比较,模型组大鼠血清IL-17、COX-2、IL-18水平显著升高(P<0.05);与模型组、槲皮素+BDKRB1过表达质粒组分别比较,槲皮素组大鼠血清IL-17、COX-2、IL-18水平均降低(P<0.05);BDKRB1过表达质粒组大鼠血清IL-17、COX-2、IL-18水平均升高(P<0.05);空载质粒组大鼠血清IL-17、COX-2、IL-18水平差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠血清炎症介质IL-17、COX-2、IL-18水平(±s,n=12)Tab.4 Levels of serum inflammatory mediators IL-17,COX-2 and IL-18 of rats in each group (±s,n=12)
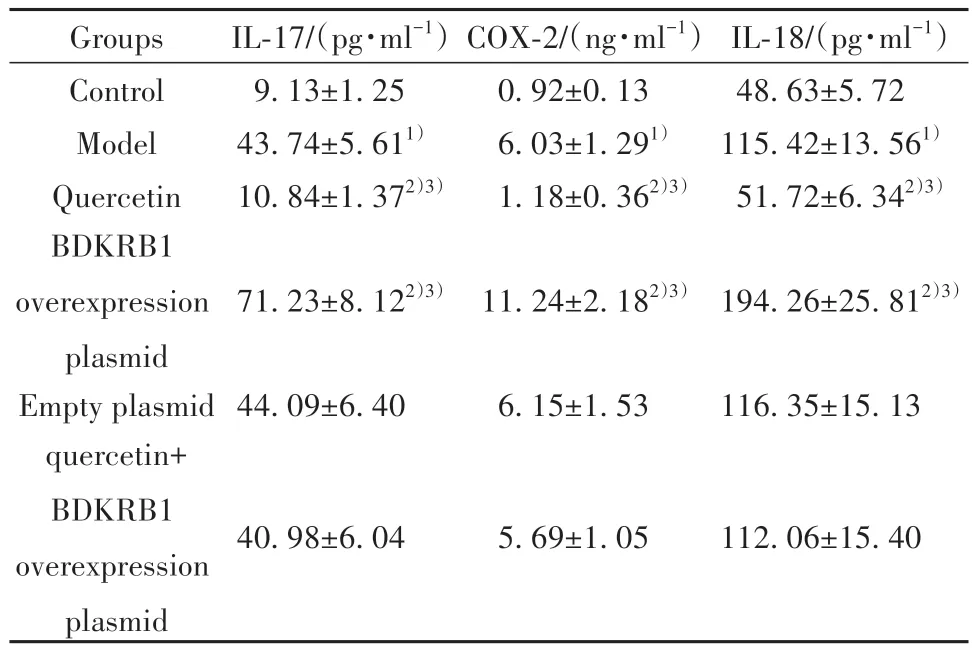
表4 各组大鼠血清炎症介质IL-17、COX-2、IL-18水平(±s,n=12)Tab.4 Levels of serum inflammatory mediators IL-17,COX-2 and IL-18 of rats in each group (±s,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with quercetin+BDKRB1 overexpression plasmid group, 3)P<0.05.
Groups Control Model Quercetin BDKRB1 overexpression plasmid Empty plasmid quercetin+BDKRB1 overexpression plasmid IL-17/(pg·ml-1)9.13±1.25 43.74±5.611)10.84±1.372)3)COX-2/(ng·ml-1)0.92±0.13 6.03±1.291)1.18±0.362)3)IL-18/(pg·ml-1)48.63±5.72 115.42±13.561)51.72±6.342)3)71.23±8.122)3)11.24±2.182)3)194.26±25.812)3)44.09±6.40 6.15±1.53 116.35±15.13 40.98±6.04 5.69±1.05 112.06±15.40
2.4 槲皮素对大鼠脊髓背根神经节BDKRB1 mRNA表达水平的影响 与对照组比较,模型组大鼠脊髓背根神经节BDKRB1 mRNA表达水平显著升高(P<0.05);与模型组、槲皮素+BDKRB1过表达质粒组分别比较,槲皮素组大鼠脊髓背根神经节BDKRB1 mRNA表达水平降低(P<0.05);BDKRB1过表达质粒组大鼠脊髓背根神经节BDKRB1 mRNA表达水平均升高(P<0.05);空载质粒组大鼠脊髓背根神经节BDKRB1 mRNA表达水平差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠脊髓背根神经节BDKRB1 mRNA表达水平(±s,n=12)Tab.5 Expression level of BDKRB1 mRNA in spinal dorsal root ganglion of rats in each group (±s,n=12)

表5 各组大鼠脊髓背根神经节BDKRB1 mRNA表达水平(±s,n=12)Tab.5 Expression level of BDKRB1 mRNA in spinal dorsal root ganglion of rats in each group (±s,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group,2)P<0.05; compared with quercetin+BDKRB1 overexpression plasmid, 3)P<0.05.
BDKRB1/GAPDH 0.97±0.12 1.78±0.361)1.08±0.152)3)2.46±0.412)3)1.83±0.32 1.49±0.24 Groups Control Model Quercetin BDKRB1 overexpression plasmid Empty plasmid Quercetin+BDKRB1 overexpression plasmid
2.5 槲皮素对大鼠脊髓背根神经节BDKRB1蛋白表达水平的影响 与对照组比较,模型组大鼠脊髓背根神经节BDKRB1蛋白表达水平显著升高(P<0.05);与模型组、槲皮素+BDKRB1过表达质粒组分别比较,槲皮素组大鼠脊髓背根神经节BDKRB1蛋白表达水平均降低(P<0.05);BDKRB1过表达质粒组大鼠脊髓背根神经节BDKRB1蛋白表达水平均升高(P<0.05);空载质粒组大鼠脊髓背根神经节BDKRB1蛋白表达水平差异无统计学意义(P>0.05)。见图2、表6。

图2 免疫印迹检测各组大鼠脊髓背根神经节BDKRB1蛋白表达Fig.2 Expression of BDKRB1 protein in spinal dorsal root ganglion of rats in each group was detected by Western blot
表6 各组大鼠脊髓背根神经节BDKRB1蛋白相对表达水平(±s,n=12)Tab.6 Relative expression level of BDKRB1 protein in spinal dorsal root ganglion of rats in each group(±s,n=12)

表6 各组大鼠脊髓背根神经节BDKRB1蛋白相对表达水平(±s,n=12)Tab.6 Relative expression level of BDKRB1 protein in spinal dorsal root ganglion of rats in each group(±s,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with quercetin+BDKRB1 overexpression plasmid group, 3)P<0.05.
BDKRB1/β-Tubulin 0.63±0.11 1.29±0.281)0.70±0.132)3)1.82±0.322)3)1.31±0.27 1.15±0.19 Groups Control Model Quercetin BDKRB1 overexpression plasmid Empty plasmid Quercetin+BDKRB1 overexpression plasmid
3 讨论
我国糖尿病患者众多,临床资料显示其中大多数会发生DNP,是造成患者肢端疼痛和步态障碍,甚至残疾的重要因素,因此积极探索有效的治疗药物极具临床价值[12]。本研究以腹腔注射60 mg/kg链脲佐菌素方法建立DNP大鼠模型,结果显示,大鼠注射链脲佐菌素后,其血糖显著升高,诱导炎症细胞因子IL-17、COX-2及IL-18大量产生释放,可引发神经炎症反应,进而造成外周神经损伤[13]。LFA-1作为淋巴细胞功能相关抗原,是反映组织炎症中淋巴细胞浸润情况的重要标志物[14]。本实验中造模大鼠脊髓背根神经节中LFA-1阳性细胞比例明显升高,提示高糖诱导的炎症因子过量表达导致了炎症细胞浸润脊髓神经组织,引发了严重的外周神经炎症损伤,造成大鼠机械性刺激与冷、热刺激痛觉超敏,表明DNP模型建立成功。
目前DNP的临床治疗方法不多,主要以维生素营养神经、抗炎止痛及降低血糖等为主,但患者预后并不理想,如今中医药中含有的天然化合物在DNP的治疗中越来越受到重视[15-16]。槲皮素作为一种天然抗炎抗氧化剂,常用于改善糖尿病、关节炎、慢性前列腺炎等多种炎症性疾病的治疗,可明显抑制炎症介质的表达和分泌,减轻慢性前列腺炎/慢性骨盆疼痛综合征大鼠痛觉超敏,并显著改善紫杉醇所致的神经病理学疼痛[6,17-18]。因此,槲皮素可作为防治DNP的潜在药物。本实验以槲皮素处理DNP大鼠,可显著降低炎症因子IL-17、COX-2及IL-18水平及LFA-1阳性细胞比例,阻碍炎症细胞浸润脊髓背根神经节,减弱大鼠机械性刺激与冷、热刺激痛觉超敏,表明槲皮素可抑制炎症因子表达,阻碍炎症细胞浸润及脊髓神经组织炎性级联反应,减轻DNP大鼠疼痛,与既往研究结果相似,具有很强的消炎镇痛功效,在DNP的治疗中具有很大的发展前景。
BDKRB1是激肽释放酶-激肽系统的重要调控蛋白,在糖尿病、谷氨酸诱导的神经毒性、神经疼痛等病理过程中均过表达,下调BDKRB1表达或拮抗其活性可抑制高糖引发的炎症,改善谷氨酸导致的神经元损伤,并通过阻碍炎症进展减轻创伤引起的慢性疼痛,提示BDKRB1是DNP的一个潜在治疗靶点[7,19-20]。本研究探讨了下调BDKRB1表达是否为槲皮素改善DNP疼痛症状的分子机制,结果显示,以BDKRB1过表达质粒上调DNP大鼠BDKRB1表达,可促进炎症细胞因子分泌,加重炎症细胞浸润,最终加剧大鼠疼痛;当其与槲皮素合用时,可拮抗槲皮素对炎症因子表达与炎症细胞浸润的抑制作用,并减弱对大鼠痛觉超敏的改善作用,最终逆转槲皮素对DNP大鼠的镇痛作用。
综上,本研究证实槲皮素可通过下调BDKRB1表达减少炎症因子的生成分泌,抑制炎性淋巴细胞浸润,抵抗脊髓背根神经炎症,减弱DNP大鼠疼痛超敏症状,最终发挥显著的消炎止痛功效。本研究为DNP的临床治疗提供了新的参考,对槲皮素的推广应用做出了一定贡献。

