黄芪甲苷通过调控Caspase-1介导的经典焦亡途径抑制细胞焦亡缓解脑缺血/再灌注损伤的研究
张怡 侯仙明 张拴成 周晓红 刘璐瑶 王泽超 高维娟
(河北中医药大学,河北省心脑血管病中医药防治研究重点实验室,石家庄 050091)
脑卒中是世界范围内引发人类死亡和残疾的常见病。近年来,尽管脑卒中的发病率有所下降,但其相关病死率在发达国家和发展中国家都居高不下[1]。流行病学调查显示脑卒中已经成为全球第二位、我国首位致死原因,其中缺血性脑卒中占比较大,约占全部脑血管病的87%[2-3]。脑组织极易受缺血影响,脑血流完全中断5 min后就会触发神经元大量死亡,因此亟需通过血流的再通恢复脑组织氧气和营养的供应,但血流恢复后,有时也会由于自由基的过量产生和炎症细胞的异常募集等造成脑组织二次损伤,即脑缺血/再灌注(ischemia/reperfusion,I/R)损伤。最新研究发现,细胞焦亡在脑I/R损伤中具有重要作用,是干预脑I/R损伤的最新靶点[4]。黄芪甲苷(astragaloside Ⅳ)从中药黄芪中提取,是黄芪的主要活性成分之一。大量研究表明,黄芪甲苷可有效缓解包括脑I/R损伤在内的多种中枢神经系统疾病[5]。课题组前期研究证实,黄芪甲苷可通过调控细胞自噬和凋亡缓解脑I/R损伤[6],但其对I/R损伤后神经细胞焦亡的作用及具体机制鲜有报道。因此,依托前期基础,本实验通过大鼠大脑中动脉阻塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型研究黄芪甲苷对Caspase-1经典焦亡信号通路的影响,从抑制细胞焦亡角度,探讨其缓解脑I/R损伤的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性清洁级SD大鼠60只,体质量240~280 g,8~10周龄,购于北京维通利华实验动物技术有限公司,动物生产许可证:SCXK(京)2016-0011。本研究经河北中医学院实验动物管理和伦理委员会审核(编号:DWLL202203020),受试动物实验过程符合医学伦理要求。
1.1.2 实验药物及主要试剂 黄芪甲苷,规格:20 mg,纯度>98%,购于上海源叶生物科技有限公司。TTC染色液(2%)由北京索莱宝科技有限公司提供;NLRP3单克隆抗体(ab270449)、IL-18单克隆抗体(ab207323)均购于Abcam公司;IL-1β多克隆抗体(A11369)由Abclonal公司提供;Cleaved Caspase-1多克隆抗体(AF4005)购自Affinity公司;HE染色试剂盒、小鼠抗β-actin单克隆抗体、兔抗β-actin多克隆抗体、TUNEL试剂盒均购自武汉赛维尔生物科技有限公司。
1.1.3 主要仪器 多功能小动物手术台购自Kent公司;体式显微镜(SMZ745)购自NIKON公司;组织包埋机(EG11508)、全自动轮转切片机(RM2265)、荧光显微镜(DM5000B)均为Leica公司产品;双色红外激光成像系统(Odyssey clx)购自Licor公司。
1.2 方法
1.2.1 模型制备与给药方法 根据实验需求将SD大鼠随机分为4组:假手术组(Sham)、模型组(MCAO/R)、溶剂对照组(DMSO)和黄芪甲苷组(AS-Ⅳ)(20 mg/kg)。大鼠脑I/R损伤模型按照如下方法制备:戊巴比妥钠(40 mg/kg)腹腔注射麻醉提前禁食禁水的大鼠,麻醉后的大鼠采用仰卧位固定于小动物手术台上,并将体温保持在(37±0.5) ℃。将大鼠沿颈部中线切开皮肤,小心分离颈外动脉,然后将线栓从颈外动脉插入颈内动脉并抵达大脑中动脉的起点,从而闭塞大脑中动脉,实现脑组织缺血[7]。阻塞大脑中动脉2 h后,拔出线栓恢复脑血流,完成大鼠脑组织I/R。假手术组大鼠除不进行插线外,其他步骤与模型组相同。黄芪甲苷溶于DMSO中,于再灌注的同时腹腔注射给药,药物浓度为20 mg/kg[8]。
1.2.2 Zea Longa神经功能学评分 在大鼠手术苏醒后和脑I/R 24 h,由对实验分组不明的研究人员对大鼠进行Zea Longa神经功能学评分,评估大鼠的神经功能缺陷[9]。
1.2.3 TTC染色 I/R 24 h后,每组随机选择3只大鼠,麻醉后断头取脑,脑组织置于-20 ℃冰箱冷冻10 min后,分解为2 mm厚的冠状切片,37 ℃下采用2%TTC染液对脑组织切片进行染色,终止染色后使用相机对脑组织切片进行拍照。其中白色区域为梗死区,红色区域表示正常组织。
1.2.4 HE染色 脑组织石蜡切片脱蜡至水后,按试剂盒说明进行HE染色,镜下观察脑组织病理损伤并进行拍照。
1.2.5 Caspase-1和TUNEL免疫荧光双染色 将脑组织石蜡切片脱蜡至水,滴加Proteinase K工作液,室温孵育20 min,PBS冲洗3次,每次5 min;按照Recombinant TdT enzyme∶FITC-12-dUTP Labeling Mix∶Equilibration Buffer=1 μl∶5 μl∶50 μl(1∶5∶50)比例配制TdT孵育缓冲液;滴加50 μl TdT孵育缓冲液,孵育Caspase-1一抗(1∶50),4 ℃过夜,孵育二抗,DAPI工作液37 ℃染核,甘油封片。荧光显微镜下观察拍照,Caspase-1呈红色荧光,TUNEL呈绿色荧光,细胞核呈蓝色荧光。阳性细胞为3色重叠细胞,使用Image-Pro Plus 6.0软件对细胞进行分析。
1.2.6 Western blot测定脑组织焦亡通路相关蛋白表达 分离缺血侧脑组织并匀浆,12 000 r/min、4 ℃离心收集上清液,BCA法测定蛋白浓度,蛋白经电泳、转膜、封闭后,滴加NLRP3、Cleaved Caspase-1、IL-18及IL-1β抗体,稀释浓度均为1∶1 000, 4 ℃冰箱内孵育过夜。二抗稀释浓度为1∶3 000,摇床轻摇,室温孵育1 h,化学发光法显影条带,条带分析应用Image J软件进行。
1.3 统计学处理 应用GraphPad Prism 8软件对数据结果进行统计学分析。实验数据采用xˉ±s表示,不同实验组间的比较应用单因素方差分析和多重比较的dunnett′s方法,P<0.05表示差异有统计学意义。
2 结果
2.1 黄芪甲苷显著改善MCAO/R大鼠神经功能缺损 如图1所示,脑I/R 24 h导致大鼠神经功能学评分显著升高,出现严重神经功能缺损情况(P<0.01);黄芪甲苷治疗后,大鼠神经缺损情况明显缓解,神经功能学评分显著降低(P<0.01);溶剂对照组大鼠神经功能学评分与模型组比较差异无统计学意义(P>0.05)。
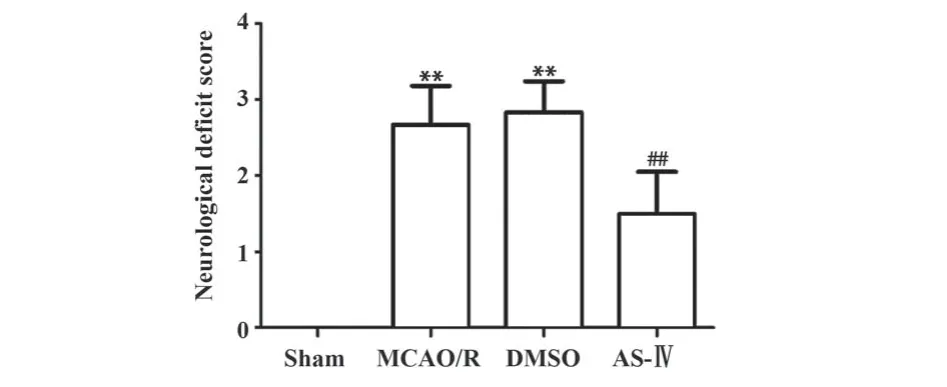
图1 各组大鼠脑I/R 24 h神经功能缺损情况Fig.1 Neurological deficit of rats at 24 h after I/R in each group
2.2 黄芪甲苷有效缩小MCAO/R大鼠脑梗死体积 如图2所示,假手术组大鼠脑组织全域红染,无明显梗死灶;与假手术组比较,模型组大鼠脑组织出现大范围白色梗死区域(P<0.01);黄芪甲苷治疗后,大鼠脑梗死体积同模型组相比显著缩小(P<0.01);溶剂对照组大鼠脑梗死体积与模型组比较差异无统计学意义(P>0.05)。
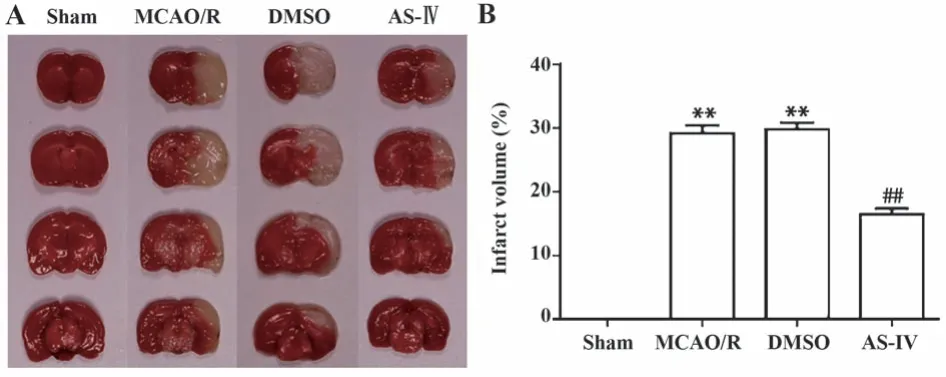
图2 各组大鼠脑I/R 24 h脑组织梗死体积Fig.2 Infarct volume of rats measured at 24 h after cerebral I/R in each group
2.3 黄芪甲苷显著缓解MCAO/R大鼠脑组织病理损伤 如图3所示,假手术组大鼠脑组织细胞数量丰富且形态正常;模型组及溶剂对照组大鼠脑组织细胞数量明显减少,部分细胞核浓缩、染色变深,或见细胞核溶解、消失,细胞体变小,排列紊乱,部分坏死细胞溶解消失(黑色箭头所示);黄芪甲苷治疗后,大鼠脑组织病理损伤显著缓解,细胞数量相对丰富,细胞水肿、胞质呈空泡状(黑色箭头所示)。
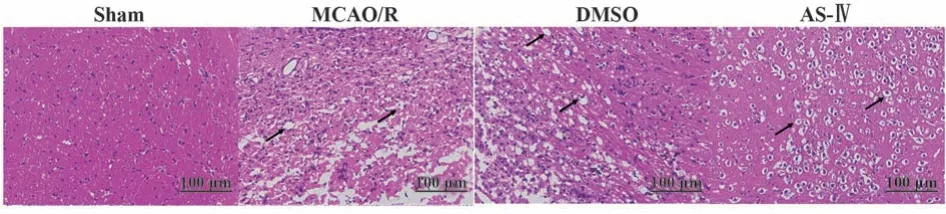
图3 各组大鼠脑组织形态(×200)Fig.3 Morphology of brain tissue of rats in each group(×200)
2.4 黄芪甲苷有效减轻MCAO/R大鼠脑组织细胞焦亡 如图4所示,假手术组脑组织可见个别红、绿、蓝三色重叠细胞;与假手术组比较,模型组大鼠脑组织三色重叠细胞(绿色箭头所示)明显增多,细胞焦亡显著增多(P<0.01);与模型组比较,黄芪甲苷组大鼠脑组织阳性细胞(绿色箭头所示)显著减少,细胞焦亡有所缓解(P<0.01);溶剂对照组大鼠脑组织焦亡细胞数与模型组比较差异无统计学意义(P>0.05)。
2.5 黄芪甲苷显著降低MCAO/R大鼠脑组织经典焦亡途径相关蛋白NLRP3、Cleaved Caspase-1、IL-1β及IL-18表达 如图5所示,与假手术组相比,模型组大鼠脑组织NLRP3、Cleaved Caspase-1、IL-1β及IL-18蛋白表达显著升高(P<0.01);与模型组比较,黄芪甲苷组大鼠脑组织NLRP3、Cleaved Caspase-1、IL-1β及IL-18蛋白表达显著降低(P<0.01),溶剂对照组各蛋白表达与模型组比较差异无统计学意义(P>0.05)。

图5 各组大鼠脑组织NLRP3、Cleaved Caspase-1、IL-1β及IL-18蛋白表达Fig.5 Expressions of NLRP3, Cleaved Caspase-1,IL-1β and IL-18 in brain tissue of rats in each group
3 讨论
I/R损伤是缺血性脑卒中通过溶栓或手术恢复血流供应后的常见并发症,可引发一系列有害的细胞反应,最终通过细胞死亡导致脑功能衰竭[10]。最新研究发现,细胞焦亡是脑I/R损伤的重要病理生理过程,可引发炎症反应,导致神经细胞损伤或死亡,调控细胞焦亡成为干预脑I/R损伤的最新靶点[11]。
细胞焦亡是一类程序性、溶解性细胞死亡方式,以质膜快速破裂,随后释放细胞内容物和促炎介质为特征,其中经典焦亡途径依赖于Caspase-1介导[12]。大量研究显示,Caspase-1介导的经典焦亡途径参与了脑I/R后神经元损伤,阻断Caspase-1表达能显著缓解I/R后脑组织损伤[13]。Caspase-1的激活由一系列能形成炎性小体的模式识别受体触发。NLRP3是中枢神经系统中最丰富的炎性小体,由NLRP3、ASC和Caspase-1组成[14]。脑I/R损伤发生后,受损脑组织细胞线粒体迅速产生活性氧,并启动氧化应激等程序[15]。活性氧可促进NLRP3、ASC、pro Caspase-1寡聚,进而激活NLRP3炎性小体。活化的NLRP3炎性小体促进pro Caspase-1自切割为成熟的Caspase-1。成熟的Caspase-1具有两种功能:①切割GSDMD并产生GSDMD-NT片段,GSDMD-NT片段可与质膜中的磷酸肌醇结合,在细胞膜形成寡聚孔,导致细胞发生焦亡;②催化pro-IL-18和pro-IL-1β成熟为IL-18和IL-1β,它们被释放到细胞外基质,引起炎症反应[16]。因此,寻找能够安全有效缓解细胞焦亡、抑制炎症反应的神经保护剂成为神经科学界亟待解决的问题。本研究显示,大鼠脑I/R后,神经功能严重缺损,脑组织大范围梗死,神经细胞焦亡显著,NLRP3、Cleaved Caspase-1、IL-1β及IL-18蛋白表达明显升高,Caspase-1介导的经典焦亡通路被激活。
大量研究发现,许多中药具有良好的神经保护作用。其中黄芪为诸多医家治疗脑卒中的首选药。名医王肯堂曾提出:“卒仆、偏枯之症,虽有多因……黄芪为必用之君药”。黄芪,出自《神农本草经》,从古至今被广泛应用于脑卒中的临床治疗,其具有皂苷、多糖等200多种化学成分,其中黄芪甲苷为黄芪的质控标志物。黄芪甲苷是提取自黄芪的纯化小分子皂苷,药理学研究证实,黄芪甲苷具有调节能量代谢、抗炎、抑制氧化应激和控制细胞凋亡等作用,是具有良好应用前景的神经保护剂[17-18]。过去几十年,许多不同临床前研究在动物模型中证实了黄芪甲苷对局灶性脑I/R损伤的干预作用。本研究发现,黄芪甲苷能够有效减轻大鼠因脑I/R造成的神经功能缺损症状,显著缓解脑组织梗死,改善脑组织神经细胞坏死、丢失情况。本研究进一步探求其具体作用机制发现,黄芪甲苷能够显著降低Caspase-1与TUNEL共表达细胞数,缓解细胞焦亡;降低大鼠脑组织NLRP3、Cleaved Caspase-1、IL-1β和IL-18等经典焦亡通路蛋白表达。
综上所述,黄芪甲苷可能通过调控Caspase-1介导的经典焦亡途径抑制细胞焦亡,对I/R损伤后脑组织发挥神经保护作用(图6)。但细胞焦亡途径众多,黄芪甲苷是否可通过其他焦亡途径发挥抗脑I/R损伤的作用,仍待进一步探索。
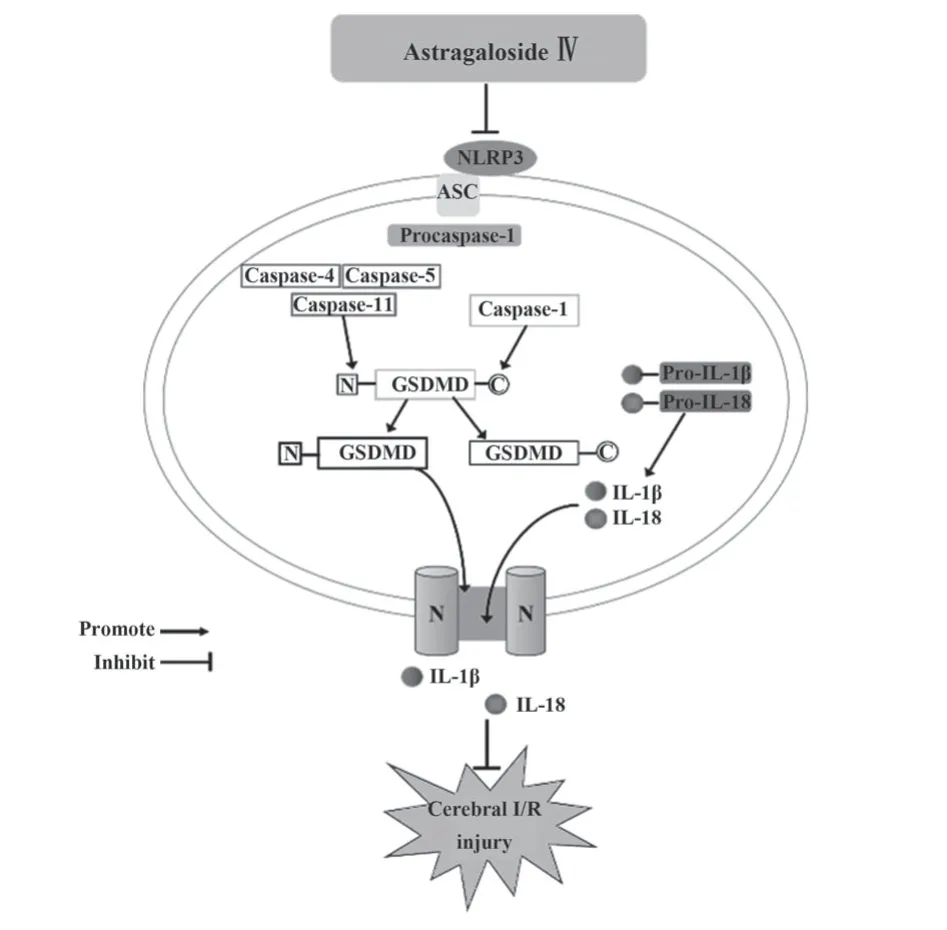
图6 黄芪甲苷缓解脑I/R损伤的作用机制Fig.6 Mechanisms of astragaloside Ⅳ alleviating cerebral I/R injury