人乳头瘤病毒16型E7基因靶向调控cGAS-STING信号通路抑制宫颈癌细胞免疫功能的研究
阿尼克孜·阿不都艾尼 夏日瓦娜·阿巴斯 木则帕尔·太来提 程祥 许爱敏
(喀什地区第一人民医院,喀什 844000)
在全球妇女常见的恶性肿瘤中,宫颈癌是女性生殖系统最常见的恶性肿瘤之一[1-2]。人乳头瘤病毒(human papillomavirus,HPV)感染是宫颈癌的主要病因,其中70%为HPV16型和18型引起[3]。流行病学显示,临床上以HPV16型感染的子宫颈鳞状细胞癌最为常见[4]。在宫颈癌的发生发展过程中,HPV的重要癌蛋白E7发挥关键作用。现有研究表明,E7蛋白可与肿瘤抑制蛋白结合,导致细胞周期调控异常,引起细胞增殖失控,抑癌基因对DNA的损伤修复功能丧失,导致癌前病变及癌症的发生发展[5-6]。目前针对HPV16 E7为靶点的基因研究及治疗已成为研究的热点。然而长期以来对HPV16 E7的研究主要集中在其对宫颈癌细胞侵袭转移的作用方面,而有关宫颈癌细胞免疫功能方面的研究一直处于空白阶段。
固有免疫系统可以迅速识别外源病原体入侵,并诱导巨噬细胞和自然杀伤细胞对病原体进行吞噬和降解,同时释放大量干扰素(interferons,IFNs)和炎症因子,进而激活适应性免疫,形成长期的免疫记忆[7]。cGAS-STING信号通路在机体的抗病毒、抗细菌方面发挥重要作用。研究发现,HIV-2中的Vpx蛋白可与STING结合,选择性抑制cGAS-STING信号通路介导的下游经典NF-κB信号通路,减少炎症因子释放[8]。登革热病毒的非结构蛋白2B可以靶向并引起cGAS溶酶体降解,使其不能识别感染过程中泄露的线粒体DNA,抑制了Ⅰ型IFNs的表达和释放[9]。因此本研究通过构建稳定表达HPV16 E7基因的SiHa细胞株,转染cGAS、STING基因siRNA,探究HPV16 E7基因是否通过靶向调控cGASSTING信号通路进而抑制宫颈癌细胞的免疫功能。
1 材料与方法
1.1 材料 人宫颈癌细胞株SiHa来源于中国科学院上海细胞库。MEM培养基、胎牛血清(FBS)购自Gibco公司;PBS、0.25%胰蛋白酶、CCK8、RIPA(强)组织细胞快速裂解液和BCA蛋白浓度测定试剂盒购自Solarbio公司;CD95、MICA/B、CD73、CD39、CTLA-4和CD25购自eBioscienceTM;Annexin V-PE/7 AAD凋亡检测试剂盒购自BD公司;Trizol购自Ambion公司;反转录试剂购自TaKaRa公司;SYBR Green染料购自KAPA Biosystems公司;cGAS、STING、IFN-Ⅰ、GAPDH、羊抗兔IgG抗体均购自Bioswamp公司。
1.2 方法
1.2.1 细胞培养 宫颈癌细胞株SiHa培养于含10%FBS的MEM培养基中,置于37 ℃、含5%CO2的培养箱内培养,待细胞生长达到80%汇合时,按照1∶2比例进行传代培养。取对数生长期细胞进行后续实验。
1.2.2 HPV16 E7慢病毒的构建及效率鉴定 根据HPV16 E7(GI号:KC935953)基因序列,按照过表达质粒及RNA干扰序列设计原则,分别设计扩增E7特异性引物和干扰靶点序列,合成针对HPV16 E7基因靶序列的过表达和干扰质粒。将SiHa细胞分为空白对照组(转染空载组)、HPV16 E7过表达组(转染HPV16 E7过表达质粒)、HPV16 E7干扰组(转染HPV16 E7干扰质粒)及阴性对照组,通过荧光拍照及qPCR检测鉴定慢病毒感染效率。
1.2.3 cGAS、STING基因siRNA合成及效果鉴定设计合成cGAS、STING基因特异性寡核苷酸序列干扰靶点,将其分别转染至SiHa细胞,qPCR和Western blot检测siRNA对SiHa细胞中cGAS和STING基因表达的干扰效果。
1.2.4 HPV16 E7调控宫颈癌细胞免疫功能 将SiHa细胞分为空白对照组(转染空载组)、HPV16 E7过表达组(转染HPV16 E7过表达质粒)、HPV16 E7干扰组(转染HPV16 E7干扰质粒)及阴性对照组,48 h后收集细胞,qPCR检测HPV16 E7 mRNA表达水平。流式细胞术检测CD95、MICA/B、CD73、CD39、CTLA-4和CD25表达。
1.2.5 HPV16 E7调控cGAS-STING信号通路抑制细胞免疫功能 将SiHa细胞分为空白对照组(转染空载组)、cGAS-siRNA对照组(转染cGAS-siRNA)、cGAS-siRNA+HPV16 E7过表达组(转染cGAS-siRNA和HPV16 E7过表达质粒)、cGAS-siRNA+HPV16 E7干扰组(转染cGAS-siRNA和HPV16 E7干扰质粒)、cGAS-siRNA阴性对照组、STING-siRNA对照组(转染STING-siRNA)、STING-siRNA+HPV16 E7过表达组(转染STING-siRNA和HPV16 E7过表达质粒)、STING-siRNA+HPV16 E7干扰组(转染STING-siRNA和HPV16 E7干扰质粒)、STING-siRNA阴性对照组。48 h后收集细胞,CCK8检测细胞活力,流式细胞术检测细胞凋亡。qPCR和Western blot检测cGAS、STING、IFN-Ⅰ、HPV16 E7的 mRNA及蛋白表达。
1.2.6 流式细胞术检测细胞CD95、MICA/B、CD73、CD39、CTLA-4和CD25表达 收集1.2.5中各组细胞,100 μl PBS重悬后,加入2 μl CD95、MICA/B、CD73、CD39、CTLA-4和CD25,4 ℃避光孵育30 min。加入2 ml PBS洗涤,4 ℃离心5 min,弃上清。400 μl PBS重悬细胞,4 ℃避光,流式细胞仪检测,NovoCyte分析软件分析实验结果。
1.2.7 流式细胞术检测细胞凋亡 收集各组细胞,重悬离心弃上清。加入1 ml预冷PBS,轻轻吹打混匀细胞,4 ℃离心5 min。细胞重悬于200 μl PBS,加入5 μl Annexin V-PE和5 μl 7-AAD,轻轻混匀,4 ℃避光孵育30 min。加入300 μl PBS,进行流式检测,NovoExpress软件进行分析。
1.2.8 qPCR检测 收集处理好的细胞,加入1 ml Trizol试剂提取各组细胞总RNA,按照试剂盒说明方法逆转录获得cDNA,qPCR检测cGAS、STING、IFN-Ⅰ和HPV16 E7的表达水平。依据Ct值计算2-ΔΔCt,以GAPDH为内参基因计算相对表达量。PCR引物序列由武汉天一华煜基因科技有限公司合成,见表1。

表1 引物序列Tab.1 Primer sequences
1.2.9 Western blot检测 收集细胞,弃去培养液,PBS洗涤后,加入含有蛋白酶和磷酸酶抑制剂的裂解液4 ℃充分裂解细胞,12 000 g离心10 min,取上清进行蛋白质定量。取20 μg蛋白上样进行凝胶电泳分离,转至PVDF膜。5%脱脂奶粉4 ℃封闭过夜,分别加入cGAS、STING、IFN-Ⅰ和GAPDH抗体(1∶1 000)室温孵育1 h。PBST洗涤3次后加入羊抗兔IgG二抗(1∶20 000),室温孵育1 h。加入化学发光试剂显色,读取条带灰度值。
1.3 统计学分析 采用SPSS19.0软件对数据进行统计分析,实验数据均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验,P<0.05表示差异有统计学意义。
2 结果
2.1 HPV16 E7慢病毒效率鉴定 荧光显微镜下观察HPV16 E7呈绿色荧光。qPCR结果显示,HPV16 E7过表达慢病毒转染SiHa细胞后,HPV16 E7表达量显著增加(P<0.01)。HPV16 E7干扰慢病毒转染SiHa细胞后,HPV16 E7表达量显著降低(P<0.01)。见图1。
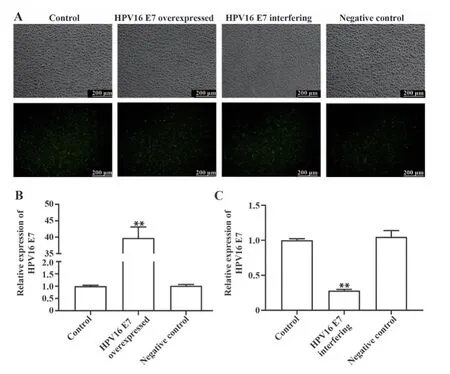
图1 HPV16 E7慢病毒效率Fig.1 Efficiency identification of HPV16 E7 lentivirus
2.2 cGAS siRNA和STING siRNA转染效率鉴定qPCR和Western blot结果显示,cGAS siRNA和STING siRNA分别转染SiHa细胞后,cGAS、STING的mRNA和蛋白表达水平显著降低(P<0.05,图2)。
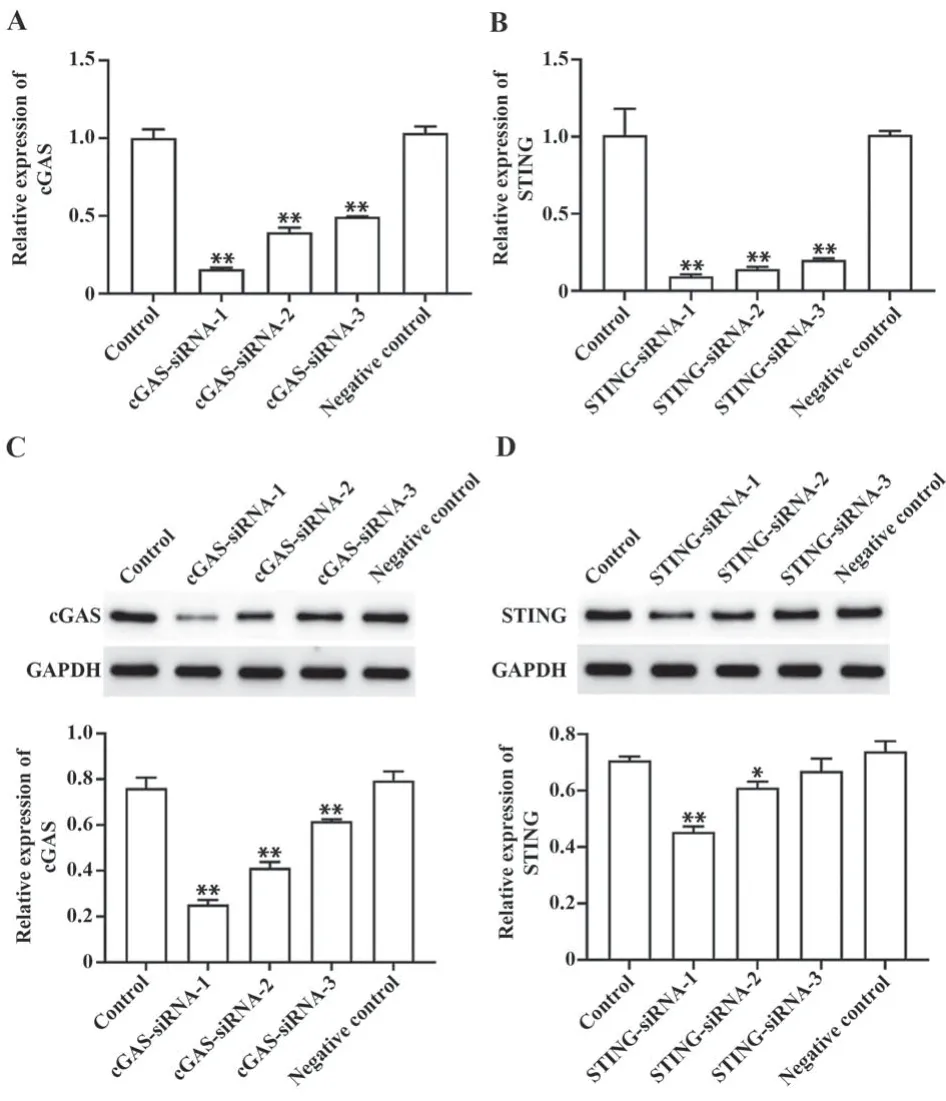
图2 cGAS siRNA和STING siRNA的转染效率Fig.2 Transfection efficiency of cGAS siRNA and STING siRNA
2.3 HPV16 E7对宫颈癌细胞免疫功能的影响 与空白对照组比较,HPV16 E7过表达组中CD95和MICA/B水平降低(P<0.01),CD73、CD39、CTLA-4和CD25水平升高(P<0.01)。HPV16 E7干扰组中CD95和MICA/B水平升高(P<0.05或(P<0.01),CD73、CD39、CTLA-4和CD25水平降低(P<0.01)。qPCR结果显示HPV16 E7过表达组HPV16 E7表达水平显著高于空白对照组,HPV16 E7干扰组HPV16 E7表达水平显著降低(P<0.01)。见图3。
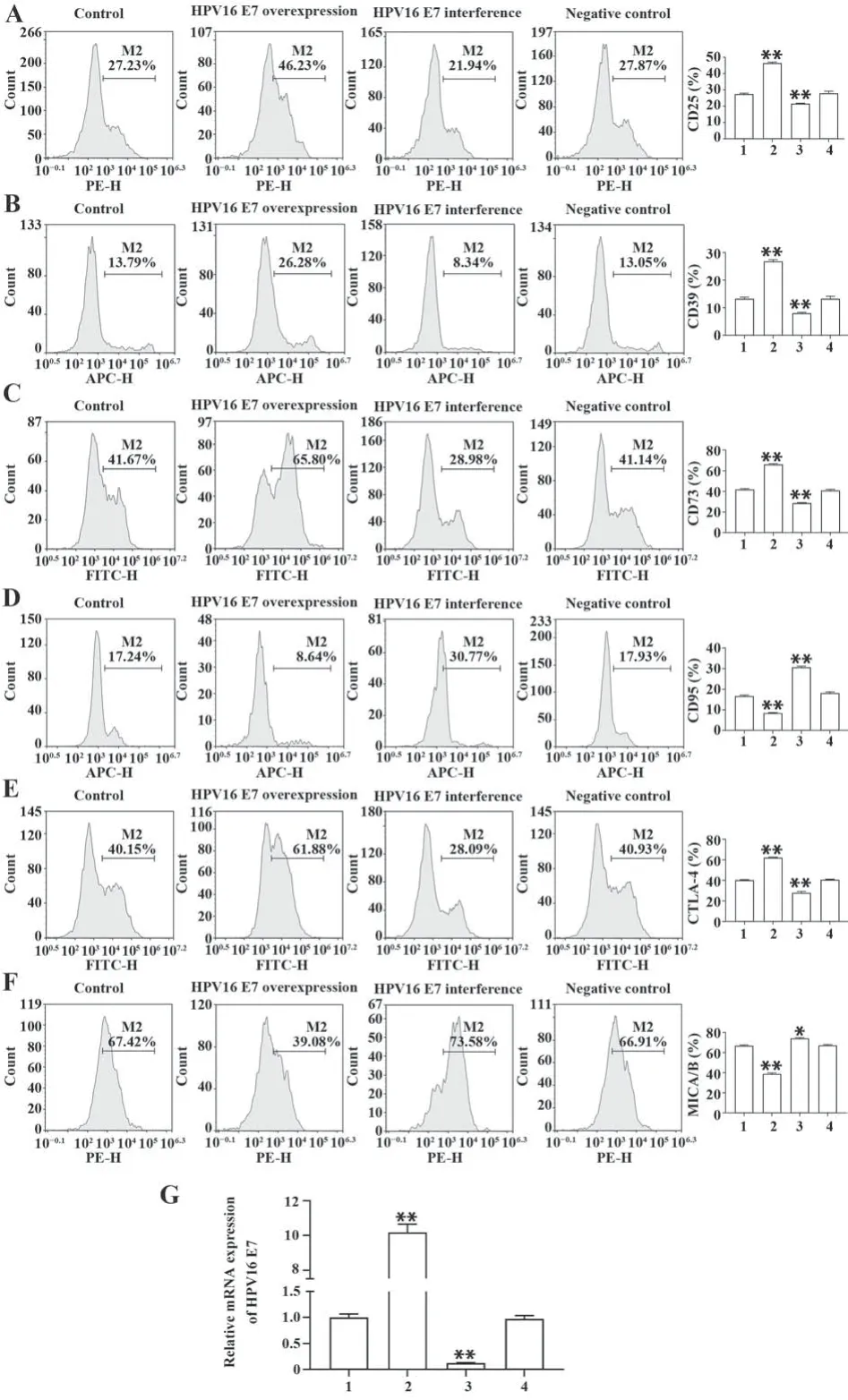
图3 HPV16 E7对宫颈癌细胞免疫功能的影响Fig.3 Effect of HPV16 E7 on immune function of cervical cancer cells
2.4 HPV16 E7调控cGAS-STING对细胞活力和细胞凋亡的影响 CCK8结果显示,在HPV16 E7过表达和HPV16 E7干扰基础上转染cGAS-siRNA对细胞活力和细胞凋亡无显著影响。与STING-siRNA对照组比较,STING-siRNA+HPV16 E7过表达组细胞活力增强,凋亡率降低,STING-siRNA+HPV16 E7干扰组细胞活力降低,凋亡率升高(P<0.05或P<0.01)。见图4。
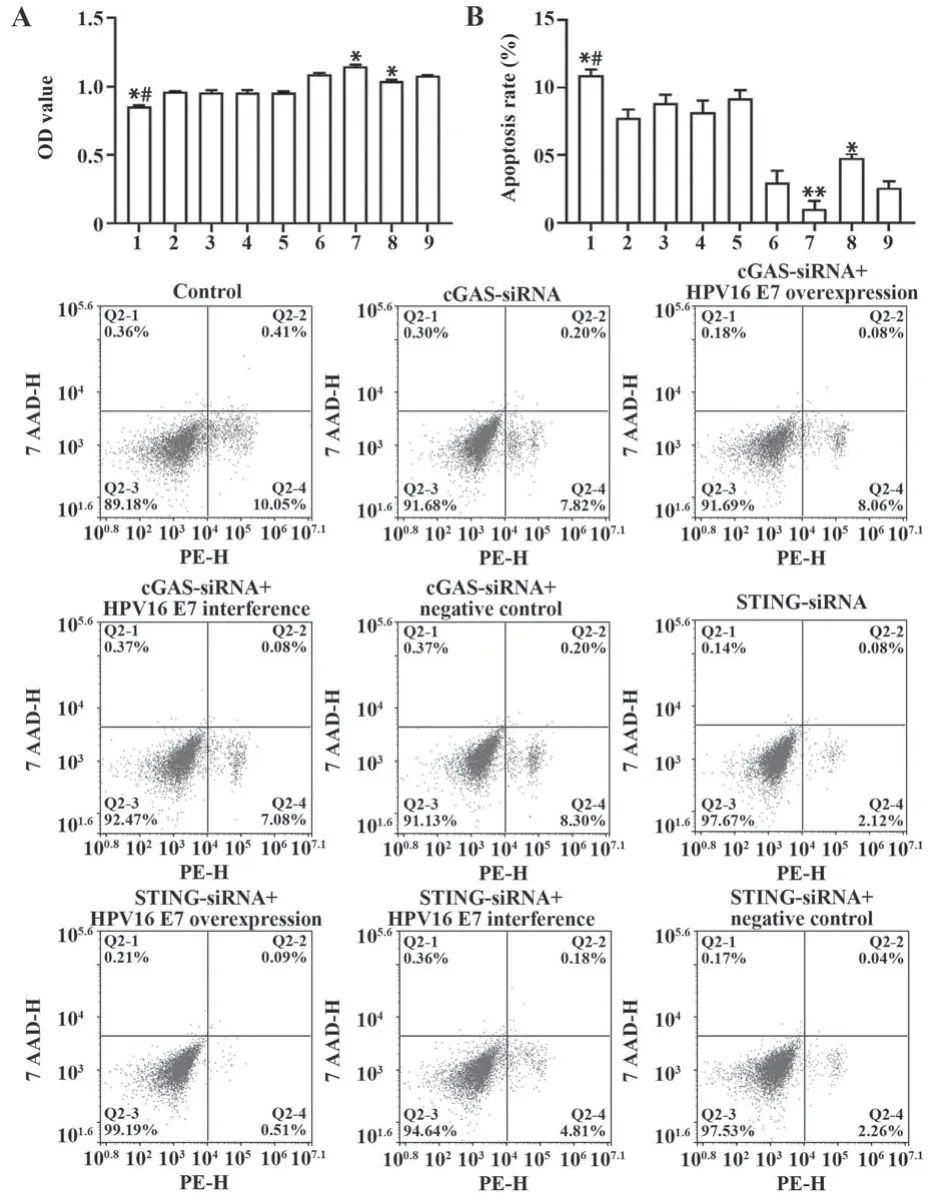
图4 细胞活力和细胞凋亡检测Fig.4 Detection of viability and apoptosis
2.5 HPV16 E7调控cGAS-STING对细胞免疫功能的影响 在HPV16 E7过表达和HPV16 E7干扰基础上转染cGAS-siRNA后,CD95、MICA/B、CD73、CD39、CTLA-4和CD25无显著变化。与STING-siRNA对照组比较,STING-siRNA+HPV16 E7过表达组CD95和MICA/B水平降低(P<0.01),CD73、CD39、CTLA-4和CD25水平升高(P<0.01)。STING-siRNA+HPV16 E7干扰组与STING-siRNA+HPV16 E7过表达组结果相反。见图5。
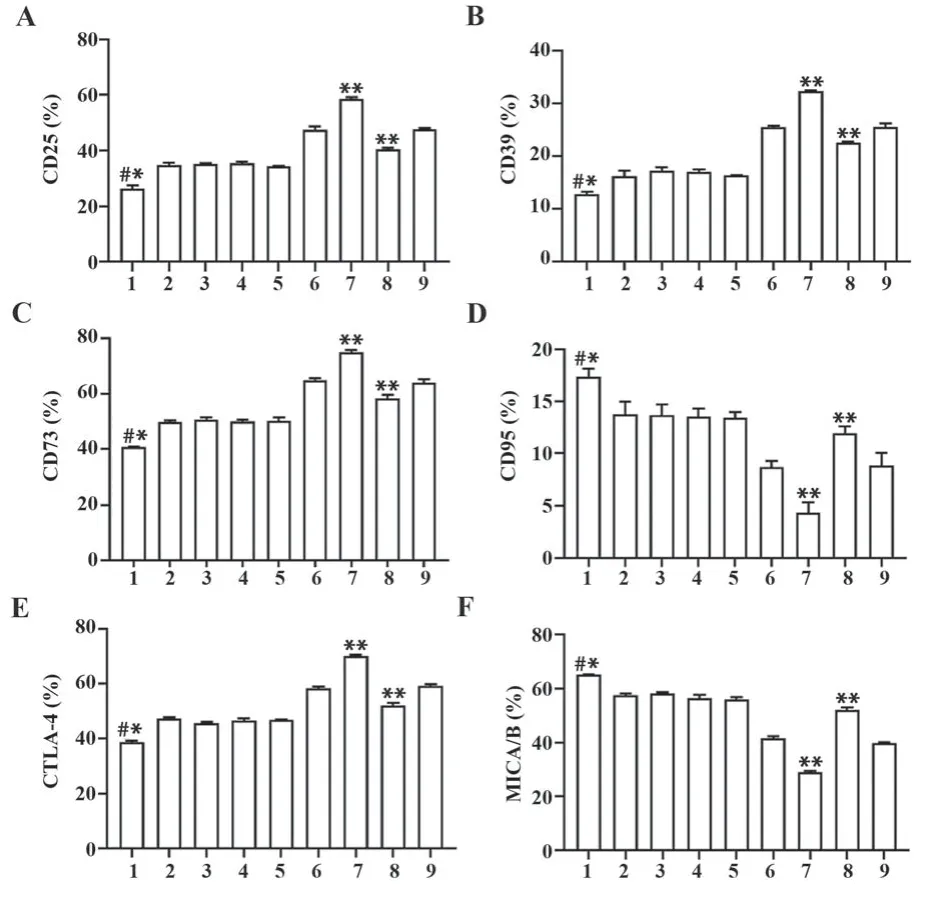
图5 HPV16 E7调控cGAS-STING对细胞免疫功能的影响Fig.5 Effects of HPV16 E7 on cellular immune function by regulating cGAS-STING
2.6 qPCR检测mRNA表达水平 在HPV16 E7过表达和HPV16 E7干扰基础上转染cGAS-siRNA后,cGAS、STING、IFN-Ⅰ、HPV16 E7的mRNA表达水平无显著变化。与STING-siRNA对照组比较,STINGsiRNA+HPV16 E7过表达组cGAS、STING和IFN-Ⅰ的mRNA表达水平降低(P<0.01),HPV16 E7表达水平升高(P<0.01)。STING-siRNA+HPV16 E7干扰组与STING-siRNA+HPV16 E7过表达组结果相反。见图6。
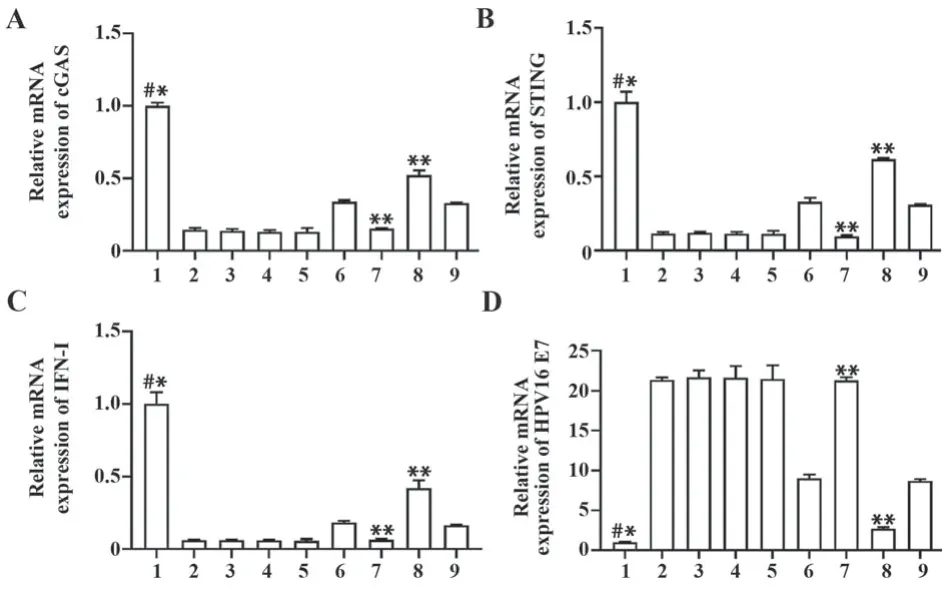
图6 cGAS、STING、IFN-Ⅰ、HPV16 E7的mRNA表达水平Fig.6 mRNA expression levels of cGAS, STING, IFN-Ⅰand HPV16 E7
2.7 Western blot检测蛋白表达水平 在HPV16 E7过表达和HPV16 E7干扰基础上转染cGAS-siRNA后,cGAS、STING和IFN-Ⅰ蛋白表达水平无明显变化。与STING-siRNA对照组比较,STING-siRNA+HPV16 E7过表达组cGAS、STING和IFN-Ⅰ蛋白表达水平降低(P<0.05或P<0.01),STING-siRNA+HPV16 E7干扰组cGAS、STING和IFN-Ⅰ蛋白表达水平升高(P<0.05)。见图7。

图7 cGAS、STING和IFN-Ⅰ的蛋白表达Fig.7 Protein expressions of cGAS, STING and IFN-Ⅰ
3 讨论
宫颈癌是一种在女性肿瘤中发病率和病死率较高的恶性癌症,据统计,2018年全球约有57万新发宫颈癌患者,占所有癌症患者的4%[2]。由于快速转移、免疫功能障碍和其他癌症并发症,宫颈癌患者的五年生存率仅为17%[10]。癌蛋白E7是HPV相关癌变的关键因素之一,靶向视网膜母细胞瘤蛋白促进异常细胞增殖并致癌[11]。从HPV感染到最终发展为宫颈癌的漫长过程中,HPV致癌基因E7是预防和治疗的关键目标[12]。本研究通过基因工程技术,构建靶向HPV16 E7基因的过表达载体和干扰载体,转染宫颈癌SiHa细胞后流式细胞术检测其对免疫功能的影响。在此基础上,转染cGAS、STING基因siRNA,探究HPV16 E7基因是否靶向cGASSTING信号通路从而抑制细胞的免疫功能。
肿瘤微环境,尤其是免疫环境在调节疾病进展和抗癌治疗的反应中发挥至关重要的作用[13]。阳性免疫活动的细胞和分子指标通常与患者的长期生存相关,有研究已将某些免疫背景或免疫相关基因特征鉴定为广泛人类恶性肿瘤中的预后生物标志物[14]。宫颈癌细胞中MICA/B可通过淋巴细胞和自然杀伤细胞激活可溶性细胞活化性受体发挥免疫防御作用[15]。CTLA-4是调节T细胞增殖、分化的重要分子之一,在调节细胞及体液免疫反应中起重要作用[16]。CD73在缺氧条件下,促使肿瘤微环境中腺苷聚积,从而发挥免疫抑制效应[17]。本研究结果显示,STING-siRNA+HPV16 E7过表达组中免疫系统激活相关的标志物CD95和MICA/B水平降低,免疫系统抑制相关的标志物CD73、CD39、CTLA-4和CD25水平升高。
cGAS-STING通路是一种先天免疫识别通路,在抗病原微生物中发挥重要作用。cGAS作为广泛的DNA识别受体,能够识别肿瘤、病原体和线粒体DNA等而引发宿主防御功能。作为胞质中的DNA感受器,cGAS识别DNA后活化STING,促进IFN表达以调节固有免疫功能[18]。STING蛋白作为DNA感受通路下游关键的接头分子,广泛表达于免疫细胞、肿瘤细胞和基质细胞等多种类型的细胞中,发挥感受胞质DNA和免疫防御的信号转导作用[19]。据报道,以siRNA靶向E7可有效降低HPV阳性细胞中HPV16的E7 mRNA水平,从而恢复被抑制的RB1表达并诱导细胞凋亡[20]。有研究报道HPV16 E7缺失可恢复人乳头瘤病毒阳性口咽鳞状细胞癌细胞的cGAS-STING反应[21]。本研究结果发现STING-siRNA+HPV16 E7过表达组cGAS、STING和IFN-Ⅰ蛋白表达水平降低,STING-siRNA+HPV16 E7干扰组cGAS、STING和IFN-Ⅰ蛋白表达水平升高。综上所述,HPV16 E7可通过靶向调控cGASSTING信号通路进而抑制宫颈癌细胞免疫功能,为临床治疗宫颈癌提供新思路。

