CD1c下调与乳腺癌预后不良和免疫浸润相关
于海洋 陈钦昊 王子鸣 曹越越 潘跃银
(1.中国科学技术大学附属第一医院, 合肥 230000;2.皖南医学院,芜湖 241000)
乳腺癌(breast cancer,BRCA)已成为全世界发病率最高的恶性肿瘤,也是导致癌症患者死亡的主要原因之一[1]。在过去的几十年里,BRCA患者的生存情况得到了一定程度的改善,然而,BRCA的行为学特征和治疗模式繁杂多变,导致部分患者的预后仍不理想[2]。目前认为免疫疗法在BRCA治疗领域具有光明的前景,免疫系统与参与免疫反应的肿瘤细胞相互调节,是BRCA肿瘤微环境的活跃成分[3]。CD1c分子与前列腺癌、肝癌及非小细胞肺癌的免疫治疗疗效均密切相关[4-6]。然而,CD1c在BRCA中的作用和预后价值尚未完全阐明。本研究通过分析TCGA数据库和GEO数据库的测序数据,并采用qRT-PCR和免疫组化(immunohistochemistry,IHC)方法对组织标本进行验证,探究CD1c分子在BRCA中的潜在作用及价值。
1 资料与方法
1.1 资料
1.1.1 数据来源 TCGA(https://portal.gdc.cancer.gov/)数据库共1 222例样本的测序数据来自TCGA BRCA项目中level 3 HTSeq-FPKM格式的RNAseq数据,详细临床参数见表1。GEO的数据来自GSE1456、GSE11121、GSE93601,部分乳腺正常组织数据来自GTEx(http://commonfund.nih.gov/GTEx/)。使用来自安徽省立医院病理科的石蜡包埋标本对CD1c分子进行IHC和qRT-PCR检测。
1.1.2 主要试剂 SYBR Premix Ex Taq Ⅱ、Termal Cycler DiceTP850(TaKaRa);IHC试剂盒(Dako,US)。
1.2 方法 IHC试剂盒检测CD1c蛋白表达水平。两位病理学专家对染色结果进行评分,对总共18个液体甲醛固定的石蜡包埋BRCA样本进行IHC染色。新鲜冰冻组织在TRIzol溶液中裂解并提纯获得纯化的RNA,并逆转录为cDNA。
根据SYBR Premix Ex Taq Ⅱ和 Termal Cycler DiceTP850试剂盒说明书行qRT-PCR试验,2-ΔΔCt法进行实验组和对照组靶基因表达量的测定(每个样品一式三份进行qRT-PCR),并将检测到的基因表达标准化为GAPDH的表达。
1.3 统计学处理 采用R软件(×64 3.6.3)进行统计分析。采用Mann-WhitneyU检验、DESeq2包分析了CD1c表达水平的差异。并用R软件中的“pROC”包进行ROC分析,用以评价CD1c在BRCA中的诊断价值。采用Kruskal-Wallis Test、Dunn's test和Logistic回归分析明确CD1c表达与临床病理特征的关系。使用R软件中的“clusterProfiler”包进行富集分析[7]。使用“survival”包进行绘制K-M生存分析,“GSVA”“estimate”包用于免疫浸润分析[8-10]。P<0.05为差异具有统计学意义。
2 结果
2.1 CD1c的表达水平差异 经Toil[11]流程处理后进行泛癌分析,结果表明,CD1c在膀胱尿路上皮癌、结肠癌、头颈鳞状细胞癌、肾嫌色细胞癌、肺腺癌、肺鳞癌、直肠腺癌及子宫内膜癌中的表达均显著低于正常组织(P<0.001,图1A)。TCGA中BRCA的CD1c表达水平同样显著低于乳腺正常组织(P<0.001,图1B)。此外,BRCA样本中的配对数据分析同样表明正常组织中CD1c的表达水平高于BRCA组织(图1C)。GEO数据库GSE93601数据集中的602个BRCA和508个邻近乳腺正常组织样本分析结果同样证实了上述结论(图1D)。受试者工作特征曲线下面积(AUC)为0.693(95%CI:0.658~0.728),表明CD1c对BRCA的诊断具有一定程度的准确性(图1E)。
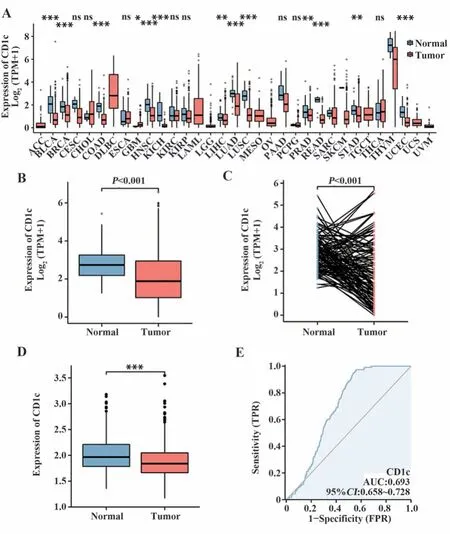
图1 CD1c在人类癌症中的表达水平Fig.1 Expression level of CD1c in human cancer
2.2 CD1c与临床特征的关系 根据CD1c表达的中位数值合并临床资料的患者分为CD1c低表达组和高表达组。表1显示,T分期、病理分期、年龄、组织学类型、PR状态、HER2状态和PAM50分型与CD1c分子表达显著相关。相比于年轻组(年龄≤60)BRCA患者,年老组(年龄>60)患者的CD1c表达水平更低(P<0.001,图2A)。此外,随着T分期和病理分期逐渐升高,CD1c表达水平总体呈下降趋势(图2B、C)。组织学类型、PR状态、HER2状态和PAM50分型同样对CD1c的表达具有不可忽略的影响(图2D~G)。
2.3 CD1c的表达与预后 对TCGA中BRCA患者的生存资料进行统计分析后,CD1c高表达组患者的总生存期(overall survival,OS)优于低表达组(P<0.05,图3A)。随后,通过GEPIA网站(图3B)和Kaplan-Meier Plotter网站(图3C)得到验证。此外,通过Kaplan-Meier Plotter对患者的无复发生存时间(recurrence-free survival,RFS)进行绘制,CD1c高表达组患者RFS显著长于对照组(P<0.001,图3D)。GEO数据库中GSE1456(P=0.003,图3E)与GSE11121(P=0.001,图3F)的生存分析表明,低表达CD1c患者的RFS相较于高表达组明显更短。
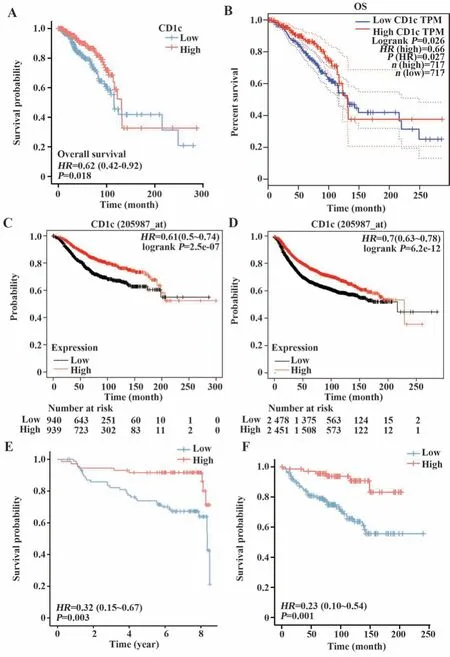
图3 CD1c与患者预后Fig.3 CD1c and prognosis of patients
2.4 IHC和qRT-PCR验证CD1c表达 部分IHC的代表性结果如图4A~F所示,以验证CD1c的表达特征。免疫组化分析结果显示,CD1c高表达与患者较长的PFS相关(P=0.024,图4G),与数据库预测结果相一致。此外,qRT-PCR结果显示,CD1c mRNA在BRCA组织中低表达,而在配对的癌旁组织中表达水平相对较高(P<0.01,图4H)。
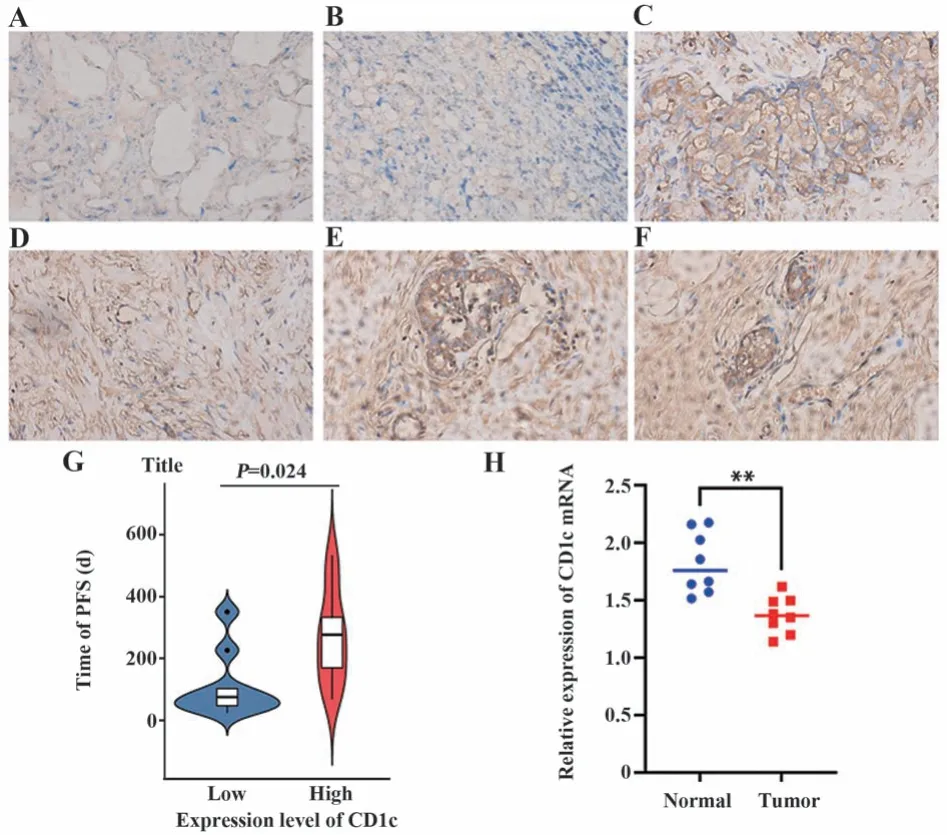
图4 IHC(×200)与qRT-PCR验证CD1c分子Fig.4 Verification of CD1c by IHC (×200) and qRT-PCR
2.5 差异表达基因分析 根据CD1c在TCGA数据库BRCA样本中的中位数表达值,将患者分为低表达组和高表达组。以|logFC|>1.5和FDR<0.05的基因为差异基因,火山图可视化结果见图5A。选择前10个上调最明显的差异基因,Spearman相关性分析计算CD1c与差异基因的相关性(图5B)。

图5 差异基因分析Fig.5 Analysis of differentially expressed genes
2.6 通路富集分析 对差异基因进行GO和KEGG分析,图6A展示了KEGG和GO分析靠前的途径。GSEA结果表明,CD1c高表达组的免疫调节相互作用及补体初始触发等通路被激活(图6B~G)。

图6 通路富集分析Fig.6 Pathway enrichment analysis
2.7 CD1c的免疫浸润分析 ssGSEA算法对BRCA患者样本免疫浸润分析结果如图7A,Spearman相关分析展示BRCA环境中CD1c表达水平与免疫细胞的相关性。CD1c与未成熟树突状细胞呈正相关(r=0.757,P<0.001,图7B),与T细胞也呈正相关(r=0.643,P<0.001,图7C)。树突状细胞及B细胞均与CD1c分子存在不弱的相关性(图7D、E)。表明CD1c分子在免疫调节和应答方面具有不可缺少的作用。Estimate方法对每个样本进行计算后得出,CD1c高表达组样本中,免疫浸润得分、基质得分与估计得分均大于低表达组(图7F),提示高表达组肿瘤微环境中的免疫细胞与基质细胞丰度更高。
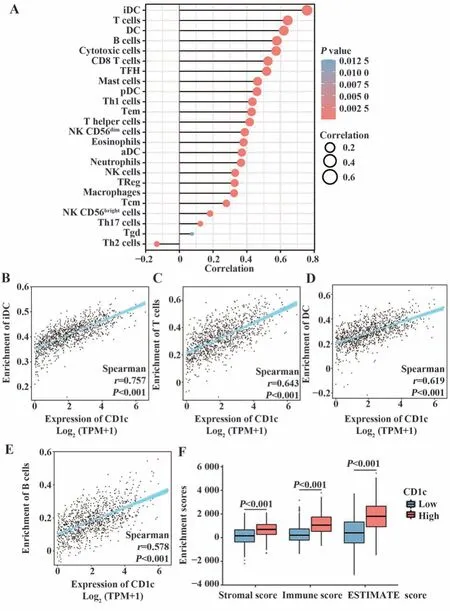
图7 免疫浸润分析Fig.7 Immune infiltration analysis
3 讨论
本研究发现,CD1c基因在BRCA中的表达水平明显低于配对或不配对的乳腺正常组织,高表达CD1c分子的患者预后明显优于低表达者,提示CD1c基因在BRCA的发生发展中起重要作用。尽管有许多关于CD1c分子在肿瘤发生中作用的报道,但目前尚未有研究报道此基因在BRCA中的预后价值。本研究发现CD1c低表达组BRCA患者的OS和RFS较差,提示CD1c可能成为BRCA治疗的生物标志物。
在BRCA的治疗模式中,免疫治疗发挥的作用日益重要,新的生物标志物的不断出现为BRCA的治疗获益奠定了基础[12]。既往研究已经证实CD1c在多种癌症的进展和治疗中发挥重要作用,尤其是在免疫治疗方面。DI BLASIO等[13]研究揭示了在非小细胞肺癌中诱导耐受性CD1c+DCs以及导致肿瘤细胞逃避免疫监视的免疫抑制性微环境发展的新细胞机制。本研究通过免疫浸润分析发现了高表达CD1c者的肿瘤微环境中基质成分与免疫浸润更高,国外有研究表明肿瘤微环境中免疫细胞浸润水平和基质细胞水平与免疫治疗疗效密切相关[14]。此外,免疫浸润分析同样揭示了iDC细胞、T细胞、DC及B细胞与CD1c的表达呈正相关,DC被认为是癌症和免疫系统间的关键接口之一,并已成为通过离体免疫调节进行癌症疫苗接种的有前景的平台[15]。T细胞与B细胞在多项研究中均被证明与BRCA的免疫治疗联系紧密[16-18]。
本研究通过多个数据库的多个数据集对CD1c在BRCA中的作用进行了初步探讨,随后通过收集临床标本进行qRT-PCR和IHC验证。本研究尚存在一些不足之处。首先,本研究收集的BRCA组织样本量较小;其次,本研究主要关注CD1c在BRCA中的表达及其预后意义,缺乏对具体分子机制的进一步研究,在未来的研究中需要加以完善。

