EGFR通路在动脉粥样硬化机制中的作用研究
涂艳虹 程波 (江汉大学附属医院武汉市第六医院综合科,武汉 430015)
动脉粥样硬化(atherosclerosis,AS)作为一种威胁人类健康的心血管疾病,是老年人最常见的死亡原因之一[1]。其主要病变特点为部分动脉脂质沉淀,伴有平滑肌细胞和纤维基质增生,逐渐发展为AS斑块形成。AS常被认为是一种慢性炎症性疾病[2]。炎症在AS病变过程中起重要作用,是AS发生和发展过程中生理和病理变化的共同基础[3]。来源于平滑肌细胞和巨噬细胞的泡沫细胞形成是AS的早期指标,也是AS发展的重要部分[4]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是G蛋白偶联受体、类固醇受体和酪氨酸激酶的重要信号通路整合因子[5]。EGFR在许多细胞过程中起主要作用,对活性氧(reactive oxygen species,ROS)产生和巨噬细胞炎症介质释放非常重要[6]。最近研究表明,EGFR参与血管病理生理学,尤其是巨噬细胞氧化应激调节[7]。EGFR也参与促炎症、增殖、迁移和重塑过程,增加细胞外基质成分沉积,促进血管疾病[5]。而EGFR在AS发病机制中的作用需进一步探讨。本研究采用纯AS敏感C57BL/6J小鼠和腹腔巨噬细胞与50 μg/ml ox-LDL培养48 h,建立典型的巨噬细胞源性泡沫细胞模型,采用EGFR抑制剂AG1478或EGFR-shRNA处理泡沫细胞,探讨EGFR通路在AS机制中的作用。
1 材料与方法
1.1 材料 DMEM购自Hyclone公司;胎牛血清、Collagenase Type Ⅰpowder购自Gibco公司;PBS、青-链霉素-两性霉素B溶液(三抗)、油红O、流式专用Buffer、0.25%胰蛋白酶、ROS检测试剂盒、IL-6和TNF-α ELISA试剂盒、RIPA(强)组织细胞快速裂解液、BCA蛋白浓度测定试剂盒(增强型)和磷酸盐缓冲液(PBS)购自Bioswamp;多聚赖氨酸购自Sigma;SYBR Green PCR试剂盒购自KAPA Biosystems;逆转录试剂盒购自TaKaRa;DNaseⅠ购自Fermentas;CO2恒温培养箱购自Thermo公司;荧光倒置显微镜购自Olympus公司;IMS图像分析系统购自武汉华联科生物技术有限公司;荧光定量PCR仪、电泳仪购自Bio-Rad;流式细胞仪购自Beckman公司。
1.2 方法
1.2.1 巨噬细胞原代分离 清洁级C57BL/6J小鼠(湖北省疾控中心提供)以颈椎脱臼法处死,全部浸入75%乙醇中5 min,倒立小鼠并向腹腔注射4 ℃预冷DMEM培养液5 ml,仰卧平放并轻揉小鼠腹部2~3 min,静置5~7 min,取出腹腔液(伦理批号:HLK-20210305-001)。进行巨噬细胞纯化,用含10%胎牛血清的RPMI1640培养液继续培养,得到接近纯净的巨噬细胞。
1.2.2 泡沫模型构建 取对数生长期细胞,分为正常组和模型组,调整细胞浓度为1×106个/ml,接种于12孔培养板,1 ml/孔,培养过夜,细胞贴壁后,模型组加入终浓度为50 mg/L的ox-LDL,共同孵育48 h,油红O染色,显微镜下观察成脂染色效果。
1.2.3 qRT-PCR 取样本于1 ml Trizol匀浆管提取总RNA。将RNA逆转录为cDNA,将制备好的cDNA进行PCR扩增,反应程序为:95 ℃预变性3 min,95 ℃ 5 s,56 ℃ 10 s,72 ℃ 25 s(40个循环),2-ΔΔCt计算mRNA相对含量。PCR引物由南京金斯瑞生物科技有限公司合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.4 Western blot 提取蛋白BCA试剂盒测定各组蛋白浓度。在凝胶中(配制12%分离胶和5%浓缩胶)加入20 μg蛋白(浓缩胶80 V 40 min,分离胶120 V 50 min),恒压90 V转膜50 min,5%脱脂奶4 ℃封闭过夜。加入一抗(EGFR 1∶5 000、p-EGFR 1∶2 000、CHOP 1∶250、ATF4 1∶1 000、EIF2α 1∶2 000、p-EIF2α 1∶3 000、Cyt-C 1∶5 000和GAPDH 1∶1 000)室温孵育1 h。洗膜后加入二抗(Goat anti-Rabbit IgG 1∶10 000)室温孵育1 h。加入ECL发光液后置于全自动化学发光分析仪中显色。TANON GIS软件读取相关条带灰度值,每组3次重复。
1.2.5 流式细胞术检测ox-LDL的提取 取生长良好的细胞,0.25%胰蛋白酶消化,吹打制成单细胞悬液,1 000 r/min离心5 min,弃上清。PBS缓冲液洗涤2次,细胞计数,调整细胞密度为1×106个/ml,加入100 μl单细胞悬液,按抗体名称标记,加入ox-LDL-FITC抗体,4 ℃避光孵育45 min,加入400 μl流式染色缓冲液重悬细胞,4 ℃避光保存。流式细胞仪检测,CYEXPERT软件分析。
1.2.6 ROS检测 按1∶1 000用无血清培养液稀释DCFH-DA,终浓度为10 μmol/L。细胞收集后悬浮于稀释好的DCFH-DA,细胞浓度为1×107个/ml,37 ℃孵育20 min,每隔3~5 min颠倒混匀,使探针和细胞充分接触。无血清细胞培养液洗涤细胞3次,充分去除未进入细胞的DCFH-DA。流式细胞仪检测ROS,CYEXPERT软件分析。
1.3 统计学分析 采用SPSS22.0软件进行统计学分析,计量资料采用±s表示。多组间比较使用单因素方差分析,均数间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
2 结果
2.1 泡沫细胞模型鉴定 ox-LDL处理细胞48 h,油红O染色发现,脂滴在泡沫细胞的细胞质中明显积聚(图1)。说明模型建立成功。
2.2 靶位点筛选 qRT-PCR和Western blot检测各靶点干扰效率。转染细胞后,EGFR表达依次下降(P<0.01,图2),其中EGFR sh-RNA3干扰效率最好。因此选择质粒3构建EGFR干扰慢病毒进行后续研究。

图2 EGFR相对表达Fig.2 Relative expression of EGFR
2.3 流式细胞术检测泡沫细胞对ox-LDL的摄取与模型组比较,EGFR抑制剂AG1478或EGFR shRNA3均能够显著降低细胞对ox-LDL的提取(P<0.01,图3)。
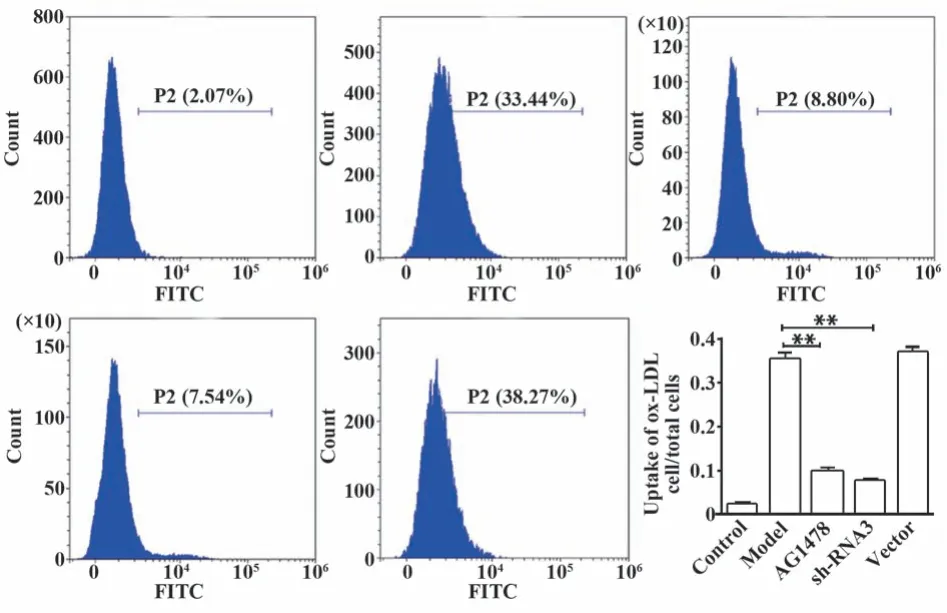
图3 流式细胞术检测ox-LDL摄取Fig.3 Uptake of ox-LDL by flow-cytometry
2.4 炎症因子表达 与模型组比较,EGFR抑制剂AG1478组和EGFR shRNA3组IL-6和TNF-α表达均显著降低(P<0.01,图4)。
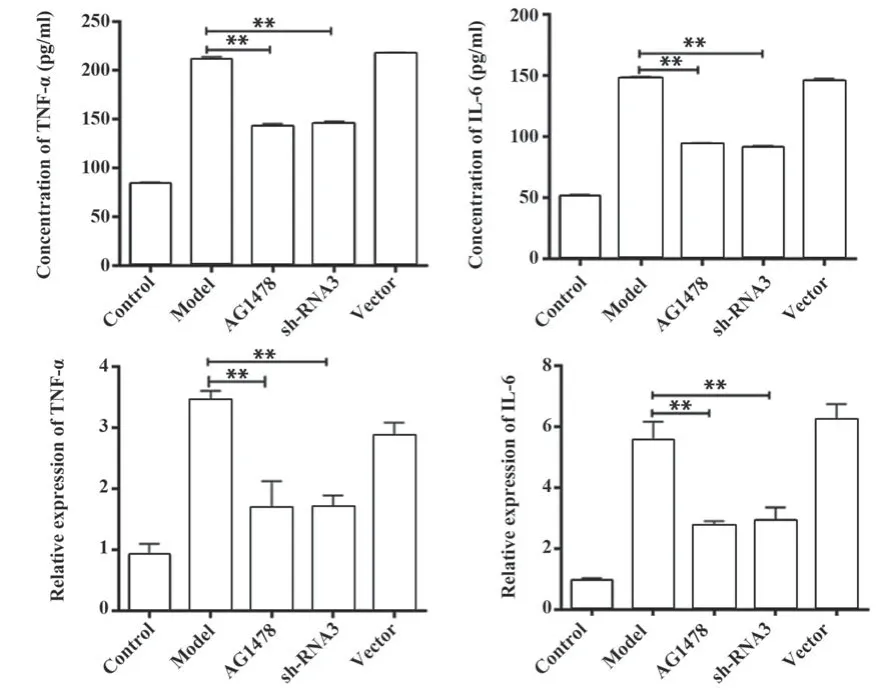
图4 IL-6和TNF-α表达Fig.4 Expressions of IL-6 and TNF-α
2.5 细胞内ROS生成 与模型组比较,经AG1478和shRNA3处理后,细胞内ROS水平显著降低(P<0.01,图5)。

图5 流式细胞术检测ROS生成Fig.5 Flow cytometry detection of ROS production
2.6 Cyt-C释放 与模型组比较,EGFR抑制剂AG1478和shRNA3均能够显著抑制细胞质中Cyt-C表达(P<0.01,图6)。
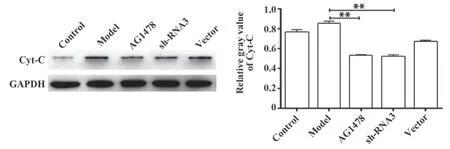
图6 Cyt-C释放Fig.6 Release of Cyt-C
2.7 CHOP、ATF4、p-EIL2α和EIF2α相对表达 与泡沫细胞模型相比,抑制EGFR可显著降低p-EIF2α、CHOP和ATF4表达(P<0.01,图7)。
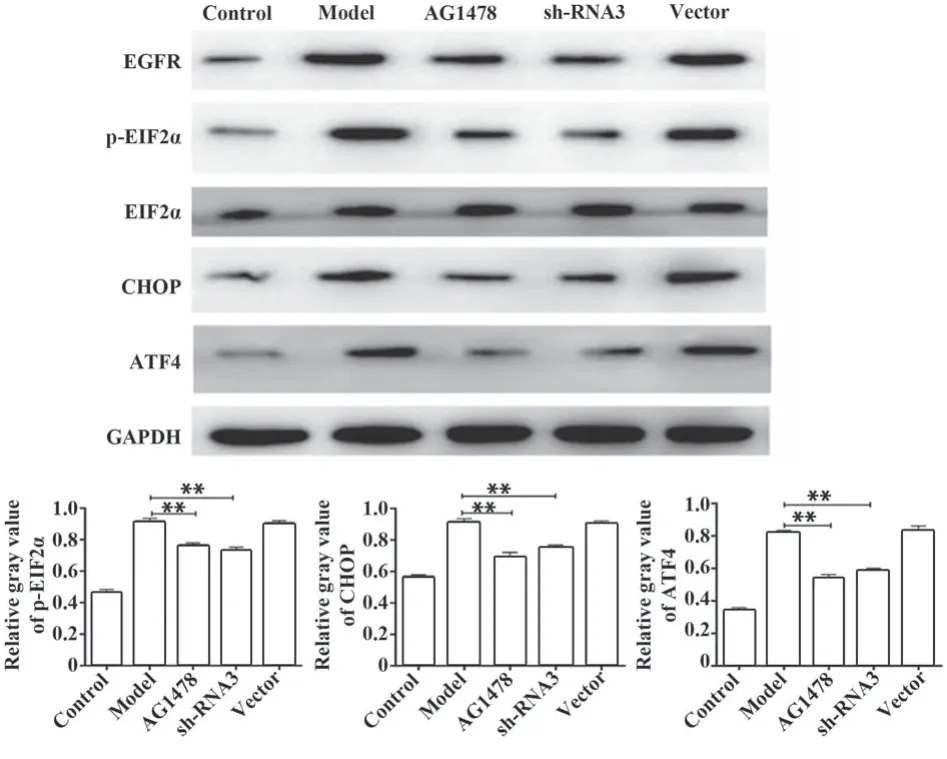
图7 CHOP、ATF4、p-EIF2α、EIF2α表达Fig.7 CHOP, ATF4, p-EIF2α and EIF2α expressions
3 讨论
AS发展与动脉斑块中慢性炎症和氧化应激密切相关。AS作为心血管疾病之一,一般认为多种炎症细胞和炎症因子在其发病过程中起重要作用。其主要特征在于ox-LDL异常、内皮细胞受损和斑块积聚于血管壁、巨噬细胞泡沫细胞形成和平滑肌细胞增殖[8-13]。ox-LDL是AS发展过程中的主要致病因子,能够诱导ROS产生和AS进展相关炎症因子释放[11,14-15]。
EGFR家族及其配体充当调节多个细胞过程的总机,在正常心脏发育中至关重要,其激活与AS、新生内膜增生和心脏重塑有关[16]。EGFR经常在许多类型人类恶性肿瘤中过表达[17]。本实验通过成功建立泡沫细胞模型,研究EGFR与AS的关系,EGFR抑制剂AG1478或EGFR shRNA均能抑制EGFR表达,且抑制EGFR表达能够显著降低泡沫细胞对ox-LDL的提取。ox-LDL在AS过程中具有重要功能,诱导ROS过量产生、黏附分子释放和内皮细胞损伤途径,并与炎症密切相关[15,18]。内皮细胞损伤和内皮功能障碍被认为是AS过程的第一步[19]。氧化应激在心血管疾病进展中起关键作用,尤其是ROS非常普遍地伴随AS典型症状发展[20]。过量ROS产生会直接破坏细胞膜、蛋白质和DNA[21]。研究证明,氧化应激通过增强炎症促进动脉壁结构重塑[22]。证明ROS参与AS发展,并表明EGFR参与ROS产生。已有报道证明ROS生成与EGFR-PI3K-AKT/ERK信号通路相关[23-24]。本实验通过EGFR抑制剂AG1478或EGFR shRNA降低了ROS产生。
炎症已被证明在AS斑块发生和发展中起重要作用。早期AS的原因为内皮损伤、脂质代谢异常和血流动力学损伤。IL-6是一种多效细胞因子,涉及固有和适应性免疫系统,用于调节急性期反应和慢性炎症[25]。冠心病患者血液中发现IL-6水平显著高于健康者,且病情越严重,体内炎症指数越高[26]。斑块破裂情况下,IL-6显著增加,IL-6可能是预测AS斑块易损性的潜在标志物[27]。TNF-α作为一种促炎细胞因子,在AS相关炎症中起重要作用,抑制TNF-α产生可能对AS抗炎治疗具有重要意义。本实验中,抑制EGFR能够显著降低泡沫细胞中ROS生成以及炎症因子IL-6、TNF-α表达。
研究表明,ROS诱导线粒体膜渗透变化,促进Cyt-C释放[28]。本研究中,抑制EGFR表达能够显著降低泡沫细胞细胞质中Cyt-C表达。病理条件(如内质网功能受损)导致内质网应激,促进巨噬细胞源性泡沫细胞形成,并在AS发展和进展中发挥重要作用[29]。本实验中抑制EGFR可显著降低内质网应激途径相关p-EIF2α、CHOP和ATF4蛋白表达。
综上,本实验采用泡沫细胞模型,通过加入EGFR抑制剂,发现能够降低炎症因子、氧化应激和内质网应激,从而减轻AS,为AS临床治疗提供了新思路。

