五味子乙素通过TLR4/NF-κB信号通路对急性胰腺炎大鼠肺部损伤的影响
黄夏冰 王馨苑 李娟 陈一萍 农焦 黄德庆 (.广西中医药大学第一附属医院急诊科,南宁 500;.广西中医药大学发展规划处,南宁 500;.广西中医药大学第一附属医院儿科,南宁 500;.广西中医药大学第一附属医院教学部,南宁 500)
急性胰腺炎(acute pancreatitis,AP)是一种急性腹部急危重症,病情进展迅速且凶险,可诱发胰腺及全身炎症,其中肺脏是最常被累及的器官,导致的急性严重肺损伤是造成AP患者死亡的主要原因,尽早防治可有效提升患者生存率[1-2]。炎症细胞因子过量分泌引发并放大的全身炎症级联反应是导致AP患者急性肺损伤的主要因素,减少血清淀粉酶及炎症因子水平,进行抗炎治疗能够显著减轻AP引发的肺损伤[3-4]。Toll样受体4(Toll-like receptor 4,TLR4)是脂多糖激活炎症级联反应必需的一种信号受体,可促进核转录因子-κB(nuclear transcription factor-κB,NF-κB)蛋白核转移,进而引发机体组织炎症,在AP发生发展过程中发挥关键作用[5]。抑制TLR4/NF-κB通路激活可显著减弱脂多糖诱导的肺组织炎症,改善急性肺损伤,提示TLR4/NF-κB信号是治疗AP后肺损伤的重要靶点[6-7]。五味子乙素是提取自中药北五味子中的一种联苯环辛烯类木脂素,具有明显的抗感染、抗炎与抗氧化活性,可通过抑制氧化应激和炎症反应减轻2型糖尿病大鼠肾损伤,并可抑制NF-κB信号激活,缓解脓毒症诱发的急性肺损伤[8-9]。但五味子乙素能否通过TLR4/NF-κB信号改善AP相关肺部损伤,目前还不清楚。本文通过构建AP肺损伤大鼠模型,对此问题进行探究。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠购于广州启特生物科技有限公司,许可证号:SYXK(粤)2021-0245。在屏障环境下分笼饲养,每笼5~6只,大鼠自由饮水、进食,饲养室温度为23~25 ℃,相对湿度为55%~60%,照明以12 h/12 h明暗交替进行。本研究获得武汉华联科生物技术有限公司伦理委员会审批通过,批件号:HLK-2022107496。
1.1.2 主要试剂与仪器 五味子乙素(规格:HPLC≥98%,20 mg,货号:S19861-20 mg)购于上海吉至生化科技有限公司;牛磺胆酸钠(纯度:HPLC≥98%,货号:ST8040)、兔SP检测试剂盒(货号:SP0021)购于北京索莱宝科技有限公司;兔源MYD88一抗、大鼠IL-6 ELASA试剂盒、大鼠IL-18 ELASA试剂盒、兔源GAPDH一抗、兔源NF-κB p65一抗、兔源PCNA一抗、羊抗兔二抗(货号:ab219413、ab234570、ab213909、ab9485、ab16502、ab92552、ab150077)购于美国Abcam公司;HE染色试剂盒、兔源TLR4一抗、RIPA裂解液、BCA蛋白测定试剂盒、兔源p-NFκB p65一抗(货号:C0105、AF8187、P0013K、P0011、AF5875)购于上海碧云天公司。
小动物无创肺功能仪购于上海玉研科学仪器有限公司;全自动生化分析仪(型号:AU 2700)购于日本Olympus公司;血气分析仪(型号:RAPIDPoint 500)购于德国Siemens公司;全波长酶标仪(型号:SLFAD)购于美国Bio Tek公司;生物组织包埋机(型号:YD-6D)购于浙江省金华市益迪医药设备厂;组织石蜡切片机(型号:1015)购于德国LEICA公司;正置显微镜(型号:ECLIPSE 80i)购于日本Nikon公司;组织匀浆机(型号:Precellys 24)购于法国Bertin公司;电子天平(型号:ML204)购于梅特勒-托利多仪器(上海)有限公司;稳压稳流电泳仪(型号:DYY-6B)购于北京六一仪器厂;蛋白转印系统、凝胶成像仪(型号:Trans-Blot Turbo、170-8200)购于美国Bio-Rad公司等。
1.2 方法
1.2.1 建立AP大鼠模型及分组给药 制备AP模型的方法参照文献[10]:将牛磺胆酸钠加入生理盐水中溶解混匀,制备为质量浓度为5%的溶液备用,SD大鼠禁食12 h后,通过腹腔注射剂量为40 mg/kg的3%戊巴比妥钠溶液麻醉,仰卧固定后,腹部备皮、消毒、于正中切开(切口约2 cm),暴露十二指肠后夹闭近肠端和近肝门端胰胆管,向胆胰管内逆行注射1.5 ml/kg的5%牛磺胆酸钠溶液,然后去除动脉夹,按压并封闭穿刺孔,复位肠管后缝合切口,若观察到大鼠胰腺出现水肿、出血症状,且呼吸困难急促,肺部听诊有杂音,表明模型制备成功。经随机数表法分为模型组、五味子乙素组、TLR4过表达载体组、TLR4空载组、五味子乙素+TLR4过表达载体组,每组12只大鼠,再取12只SD大鼠仅翻动肠管不注射5%牛磺胆酸钠,作为假手术组。
将五味子乙素加入生理盐水中溶解混匀,制备为8 mg/ml的药液[9],五味子乙素+TLR4过表达载体组大鼠腹腔注射10 ml/kg五味子乙素药液(1次/d),同时静脉注射0.5 ml腺病毒包装的TLR4过表达载体(1×1011PFU,1次/周)[11];五味子乙素组大鼠腹腔注射10 ml/kg五味子乙素药液(1次/d),同时静脉注射0.5 ml生理盐水(1次/周);TLR4过表达载体组大鼠腹腔注射10 ml/kg生理盐水(1次/d),同时静脉注射0.5 ml腺病毒包装的TLR4过表达载体(1×1011PFU,1次/周);TLR4空载组大鼠腹腔注射10 ml/kg生理盐水(1次/d),同时静脉注射0.5 ml腺病毒包装的TLR4空载体(1×1011PFU,1次/周);模型组和假手术组大鼠腹腔注射10 ml/kg生理盐水(1次/d),同时静脉注射0.5 ml生理盐水(1次/周),共用药2周。
1.2.2 肺功能检测 最后1次药物干预结束后24 h,采用无创肺功能仪测定肺功能指标:吸气阻力(resistance inspiratory,Ri)、每分通气量(minute ventilation,MV)、呼气峰流值(peak expiratory flow,PEF),全身体积描记系统参数:气泵流量2 L/min,传感器放大500倍,采样频率200 Hz,输入校准-50。
1.2.3 标本采集及大鼠动脉血气、腹水量与肺组织W/D检测 肺功能检测结束后,吸入乙醚麻醉大鼠,采集颈动脉血,以血气分析仪测定其中二氧化碳分压(arterialpartial pressure of carbon dioxide,PaCO2)、氧分压(arterial partial pressure of oxygen,PaO2)与氧合指数(oxygenation index,OI),OI计算公式为:OI=PaO2/FiO2(吸氧浓度),因大鼠在本实验中均自由呼吸,FiO2为空气中氧浓度0.21。再次采集颈动脉血1.1 ml,离心收集上清,将其分组标记后保存在-80 ℃条件下;抽取大鼠腹水并测量其体积,然后开胸取出肺脏,左右肺对半剪开,称量右肺湿重,以烤箱烤干后称量其干重,计算湿重/干重(W/D);左肺组织剪下约0.6 g,剪成小碎块,加入RIPA裂解液匀浆、离心、收集上清,BCA试剂盒测定其中蛋白总浓度后,将其分组标记并保存在-80 ℃条件下;其余左肺组织经漂洗、固定、脱水、透明、包埋后切片备用。
1.2.4 肺组织病理形态检测 1.2.3中的肺组织切片取出后,每只大鼠选3张切片,经脱蜡、水化后进行HE染色,脱水、透明、封片、镜下观察,拍照后以显微镜自带的系统分析肺组织的病理改变情况,以如下标准进行Holfbauer评分[12]:肺组织完好,无病理损伤,计0分;25%视野出现水肿、出血、炎症浸润等病理改变,计1分;50%视野出现水肿、出血、炎症浸润等病理改变,计2分;75%视野出现水肿、出血、炎症浸润等病理改变,计3分;全部视野出现水肿、出血、炎症浸润等病理改变,计4分。
1.2.5 血清淀粉酶与炎症细胞因子IL-6、IL-18水平测定 取1.2.3中的血清,冻融后采用ELISA试剂盒测定炎症细胞因子IL-6、IL-18水平,以全自动生化分析仪测定血清淀粉酶水平。
1.2.6 肺组织TLR4/NF-κB信号通路蛋白水平检测 取1.2.3中的肺组织蛋白样品液,冻融后每组取20 μg总蛋白变性后以电泳分离,湿转后以5%脱脂奶粉封闭其非特异位点,将目的蛋白TLR4、PCNA、核内NF-κB p65、GAPDH自膜上剪下后,分别以相应一抗孵育,洗膜后孵育二抗,显影后拍照,以Quantity One软件定量各蛋白灰度值后进行统计分析,最后得到其相对表达量。
1.2.7 肺组织病理形态检测 1.2.3中的肺组织切片取出后,每只大鼠再次选3张切片,同样脱蜡、水化后孵育稀释100倍的兔源TLR4一抗溶液,使用兔SP检测试剂盒孵育二抗后,进行DAB显色、苏木素复染处理,最后封片观察TLR4蛋白着色情况,每张切片随机选6个视野拍照,通过Image J软件分析图片,定量细胞数后计算TLR4阳性细胞比例(%)=TLR4阳性细胞数/总细胞数×100%。
1.3 统计学分析 采用SPSS24.0软件对实验数据进行统计分析,以±s表示,两组间的差异比较采用t检验;多组间差异比较行单因素方差分析,两两进一步比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠肺功能检测结果 与假手术组相比,模型组大鼠MV、PEF显著降低(P<0.05),Ri显著升高(P<0.05)。与模型组、五味子乙素+TLR4过表达载体组分别相比,五味子乙素组大鼠MV、PEF均升高(P<0.05),Ri均降低(P<0.05);TLR4过表达载体组大鼠MV、PEF均降低(P<0.05),Ri均升高(P<0.05)。与模型组相比,TLR4空载组大鼠MV、PEF与Ri差异均无统计学意义(P>0.05)。见表1。
表1 各组大鼠肺功能指标MV、PEF与Ri水平(±s,n=12)Tab.1 Levels of pulmonary function indexes MV, PEF and Ri of rats in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with schisandrin B+TLR4 overexpression vector group, 3)P<0.05.
Groups Sham operation Model Schisandrin B TLR4 overexpression vector TLR4 empty Schisandrin B+TLR4 overexpression vector MV/ml 7.39±0.45 3.28±0.221)6.70±0.712)3)PEF/(ml·s-1)61.47±8.29 34.66±3.951)57.58±8.122)3)Ri/(kPa·s·L-1)26.87±4.43 67.31±8.761)28.72±4.682)3)1.56±0.182)3)9.84±2.432)3)93.16±10.752)3)3.34±0.33 34.95±4.13 67.02±10.81 2.89±0.31 32.52±3.94 65.34±11.06
2.2 各组大鼠动脉血气检测结果 与假手术组相比,模型组大鼠PaO2、OI显著降低(P<0.05),PaCO2显著升高(P<0.05)。与模型组、五味子乙素+TLR4过表达载体组分别相比,五味子乙素组大鼠PaO2、OI均升高(P<0.05),PaCO2均降低(P<0.05);TLR4过表达载体组大鼠PaO2、OI均降低(P<0.05),PaCO2均升高(P<0.05)。与模型组相比,TLR4空载组大鼠PaCO2、PaO2与OI差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠动脉血气相关指标PaCO2、PaO2与OI水平(±s,n=12)Tab.2 Levels of PaCO2, PaO2 and OI in arterial blood gas of rats in each group (±s,n=12)
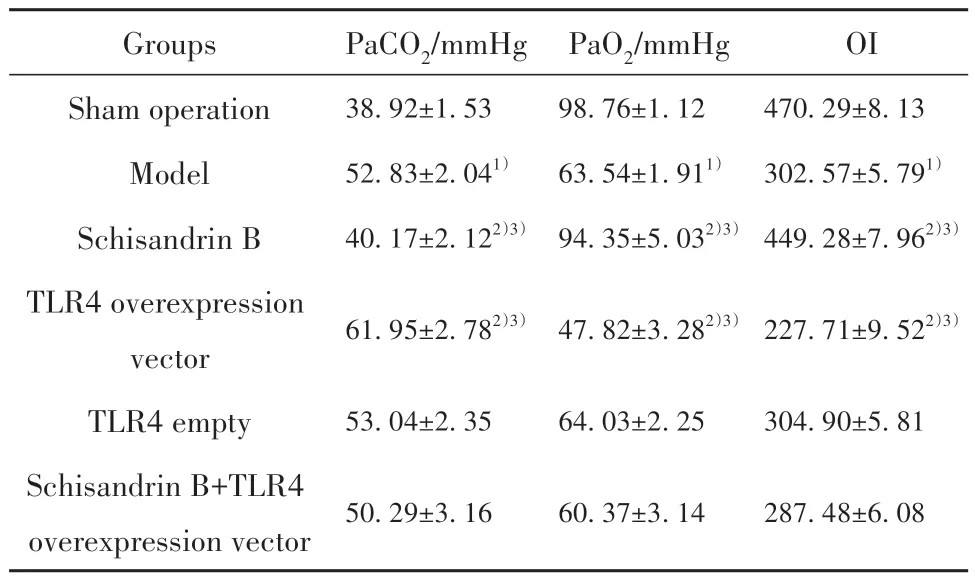
表2 各组大鼠动脉血气相关指标PaCO2、PaO2与OI水平(±s,n=12)Tab.2 Levels of PaCO2, PaO2 and OI in arterial blood gas of rats in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with schisandrin B+TLR4 overexpression vector group, 3)P<0.05.
Groups Sham operation Model Schisandrin B TLR4 overexpression vector TLR4 empty Schisandrin B+TLR4 overexpression vector PaCO2/mmHg 38.92±1.53 52.83±2.041)40.17±2.122)3)PaO2/mmHg 98.76±1.12 63.54±1.911)94.35±5.032)3)OI 470.29±8.13 302.57±5.791)449.28±7.962)3)61.95±2.782)3)47.82±3.282)3)227.71±9.522)3)53.04±2.35 64.03±2.25 304.90±5.81 50.29±3.16 60.37±3.14 287.48±6.08
2.3 各组大鼠腹水量与W/D检测结果 与假手术组相比,模型组大鼠腹水量与W/D显著升高(P<0.05)。与模型组、五味子乙素+TLR4过表达载体组分别相比,五味子乙素组大鼠腹水量与W/D均降低(P<0.05);TLR4过表达载体组大鼠腹水量与W/D均升高(P<0.05)。与模型组相比,TLR4空载组大鼠腹水量与W/D差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠腹水量与W/D(±s,n=12)Tab.3 Ascites volume and W/D of rats in each group(±s, n=12)

表3 各组大鼠腹水量与W/D(±s,n=12)Tab.3 Ascites volume and W/D of rats in each group(±s, n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with schisandrin B+TLR4 overexpression vector group, 3)P<0.05.
Groups Sham operation Model Schisandrin B TLR4 overexpression vector TLR4 empty Schisandrin B+TLR4 overexpression vector Ascites volume/ml 0.35±0.11 10.81±1.341)1.74±0.572)3)14.96±1.862)3)10.32±1.53 W/D 4.26±0.41 6.47±0.731)4.53±0.502)3)8.24±0.642)3)6.59±0.61 9.48±0.95 6.12±0.52
2.4 各组大鼠肺组织病理形态检测结果 假手术组肺组织形态正常完好,无病理损伤,Holfbauer评分为0。模型组大鼠肺泡缩小塌陷,间隔变宽,肺组织出现水肿、出血及炎症细胞大量浸润等病理损伤,Holfbauer评分相较于假手术组显著升高(P<0.05)。与模型组、五味子乙素+TLR4过表达载体组分别相比,五味子乙素组大鼠肺组织上述病理损伤改变程度均减轻,Holfbauer评分均降低(P<0.05);TLR4过表达载体组大鼠肺组织上述病理损伤改变程度均加重,Holfbauer评分均升高(P<0.05)。与模型组相比,TLR4空载组大鼠肺组织上述病理损伤程度无明显改变,Holfbauer评分差异无统计学意义(P>0.05)。见表4、图1。
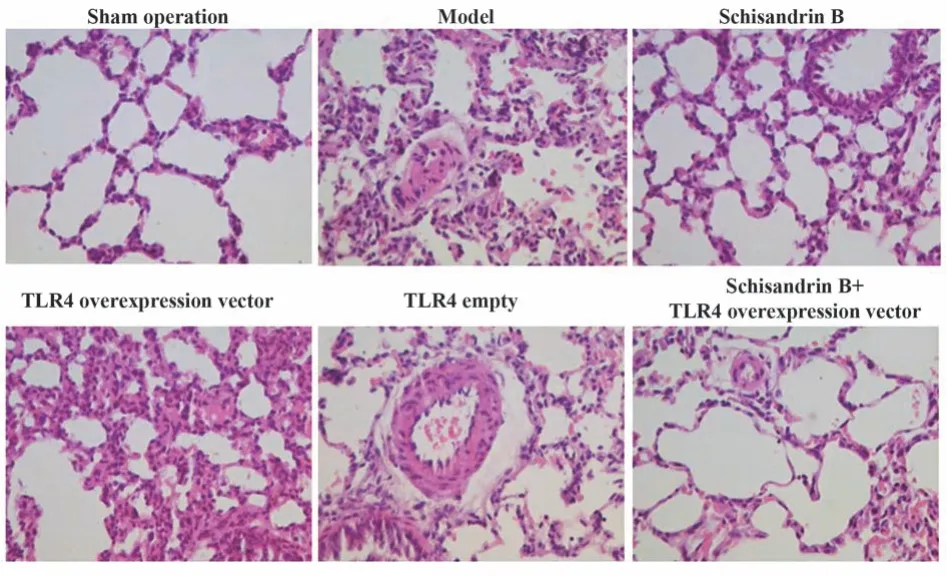
图1 HE染色观察各组大鼠肺组织病理形态(×200)Fig.1 Pathological morphology in lung tissue of rats in each group was observed by HE staining (×200)
表4 各组大鼠肺组织Holfbauer评分(±s,n=12)Tab.4 Holfbauer score of rats lung tissue in each group(±s,n=12)

表4 各组大鼠肺组织Holfbauer评分(±s,n=12)Tab.4 Holfbauer score of rats lung tissue in each group(±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with schisandrin B+TLR4 overexpression vector group, 3)P<0.05.
Groups Sham operation Model Schisandrin B TLR4 overexpression vector TLR4 empty Schisandrin B+TLR4 overexpression vector Holfbauer/point 0 2.67±0.371)0.75±0.242)3)3.67±0.282)3)2.58±0.42 2.25±0.50
2.5 各组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平检测结果 与假手术组相比,模型组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平显著升高(P<0.05)。与模型组、五味子乙素+TLR4过表达载体组分别相比,五味子乙素组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平均降低(P<0.05);TLR4过表达载体组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平均升高(P<0.05)。与模型组相比,TLR4空载组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平(±s,n=12)Tab.5 Levels of serum amylase and inflammatory cytokines IL-6 and IL-18 in each group (±s,n=12)

表5 各组大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平(±s,n=12)Tab.5 Levels of serum amylase and inflammatory cytokines IL-6 and IL-18 in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with schisandrin B+TLR4 overexpression vector group, 3)P<0.05.
Groups Sham operation Model Schisandrin B TLR4 overexpression vector TLR4 empty Schisandrin B+TLR4 overexpression vector Amylase/(U·L-1)1 026.53±50.195 2 934.16±72.841)11 1 057.72±58.732)3)5 3 894.64±91.652)3)16 2 921.92±74.3211 2 901.23±70.5710 IL-6/(ng·L-1)3.24±6.36 4.83±15.621)8.95±5.682)3)IL-18/(μg·L-1)0.39±0.08 1.17±0.131)0.43±0.072)3)8.47±20.142)3)1.85±0.162)3)6.52±16.17 1.19±0.12 9.21±20.13 1.12±0.20
2.6 各组大鼠肺组织TLR4/NF-κB信号通路蛋白表达检测结果 与假手术组相比,模型组大鼠肺组织TLR4阳性细胞比例、TLR4与MYD88蛋白表达、p-NF-κB p65/NF-κB p65水平显著升高(P<0.05)。与模型组、五味子乙素+TLR4过表达载体组分别相比,五味子乙素组大鼠肺组织TLR4阳性细胞比例、TLR4与MYD88蛋白表达、p-NF-κB p65/NF-κB p65水平均降低(P<0.05);TLR4过表达载体组大鼠肺组织TLR4阳性细胞比例、TLR4与MYD88蛋白表达、p-NF-κB p65/NF-κB p65水平均升高(P<0.05)。与模型组相比,TLR4空载组大鼠肺组织TLR4/NF-κB信号通路蛋白表达差异无统计学意义(P>0.05)。见图2、图3、表6。

图2 免疫组化染色检测各组大鼠肺组织TLR4蛋白表达(×200)Fig.2 Expression of TLR4 protein in lung tissue of rats in each group was detected by immunohistochemical staining (×200)
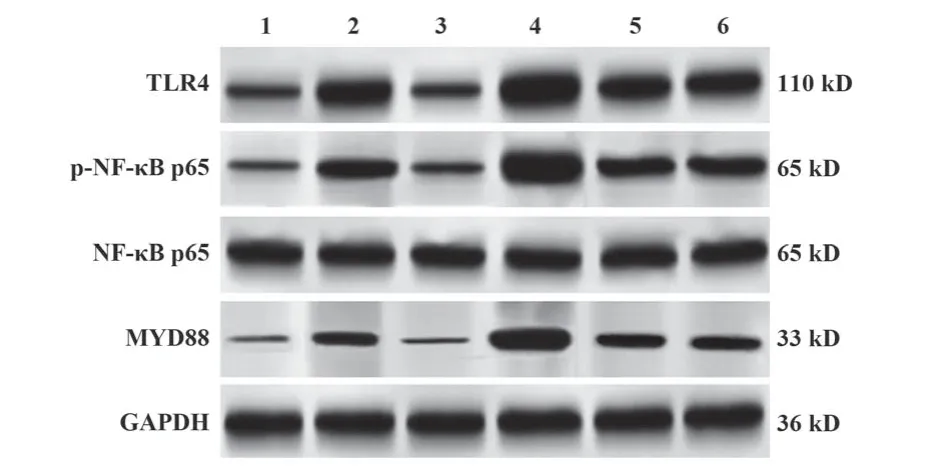
图3 免疫印迹检测各组大鼠肺组织TLR4/NF-κB通路相关蛋白表达Fig.3 TLR4/NF-κB signaling pathway proteins expressions in lung tissue of rats in each group were detected by Western blot
表6 各组大鼠肺组织TLR4/NF-κB信号通路蛋白相对表达(±s,n=12)Tab.6 Relative expressions of TLR4/NF-κB signaling pathway proteins in lung tissue of rats in each group (±s, n=12)

表6 各组大鼠肺组织TLR4/NF-κB信号通路蛋白相对表达(±s,n=12)Tab.6 Relative expressions of TLR4/NF-κB signaling pathway proteins in lung tissue of rats in each group (±s, n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with schisandrin B+TLR4 overexpression vector group, 3)P<0.05.
Groups TLR4/GAPDH Sham operation Model Schisandrin B TLR4 overexpression vector TLR4 empty Schisandrin B+TLR4 overexpression vector 0.54±0.12 1.21±0.181)0.59±0.072)3)1.96±0.252)3)1.19±0.20 MYD88/GAPDH 0.45±0.10 1.18±0.121)0.51±0.082)3)1.83±0.242)3)1.17±0.23 p-NF-κB p65/NF-κB p65 0.48±0.09 1.30±0.231)0.53±0.082)3)2.04±0.172)3)1.32±0.26 1.16±0.19 1.11±0.22 1.25±0.20
3 讨论
AP作为一种常见的急诊科重症疾病,近年来患病人数处于上升趋势,大多数患者会因全身炎症出现急性肺损伤,造成肺功能衰竭,是导致患者住院时间延长甚至死亡的重要因素[12-14]。本研究以胆胰管内逆行注射5%牛磺胆酸钠的方法诱导建立AP模型,结果显示,造模大鼠血清淀粉酶与炎症细胞因子IL-6、IL-18水平明显升高,诱发了全身炎症,造成腹水及肺部水肿,导致肺泡缩小塌陷,间隔变宽,肺组织出现水肿、出血及炎症细胞大量浸润等病理损伤,损害了肺功能,使MV、PEF、PaO2、OI显著降低,Ri、PaCO2显著升高,揭示AP肺损伤模型构建成功。
AP不仅可损害胰腺组织,还可诱发全身炎症,进而造成肺组织损伤,抑制机体炎症是防治AP所致肺损伤的有效方法[15-16]。五味子乙素是一种天然抗炎化合物,可抑制炎症因子表达,减轻脂多糖引起的肺上皮细胞炎症,并可通过提高组织抗氧化活性减轻肺组织氧化应激损伤,延缓肺纤维化[17-18]。本研究以五味子乙素处理AP肺损伤大鼠,可明显降低其血清淀粉酶与炎症细胞因子IL-6、IL-18水平,抑制炎症,减轻肺组织病理损伤改变,缓解腹水与肺组织水肿,提高MV、PEF、PaO2、OI,降低Ri、PaCO2,修复肺功能,表明五味子乙素可显著改善AP引发的肺组织损伤,具有明显的肺保护作用。
TLR4/NF-κB是启动炎症级联反应的重要信号通路,参与介导AP的发病与病情进展过程,下调TLR4蛋白表达可抑制NF-κB蛋白的核转移,减弱氧化应激和炎症,并可抵抗胰腺巨噬细胞炎性激活,缓解AP病理症状,并减轻脂多糖引发的急性肺损伤[7,19-20]。本研究以TLR4过表达载体处理AP大鼠,可提升血清淀粉酶与炎症细胞因子IL-6、IL-18水平,加重肺组织水肿及腹水症状,并促使肺部炎症进展,进一步损害肺功能,表明TLR4/NF-κB通路参与介导AP引发的肺损伤过程,与上述提及的既往研究结果相似,而本研究结果显示五味子乙素可降低AP大鼠肺组织中TLR4阳性细胞比例,下调其TLR4/NF-κB通路蛋白表达,减轻大鼠肺部炎症损伤,表明TLR4/NF-κB通路在五味子乙素对AP引发肺损伤的治疗过程中发挥重要调控作用;另外,当五味子乙素与TLR4过表达载体合用时,TLR4过表达载体可减弱五味子乙素的抗炎作用,并拮抗其对肺部炎症损伤的改善作用,最终逆转五味子乙素的肺功能修复功效,表明五味子乙素改善AP大鼠肺部损伤并修复肺功能是通过下调TLR4/NF-κB信号通路实现的。
综上所述,本研究证实五味子乙素可以下调TLR4蛋白表达,抑制NF-κB磷酸化,抵抗AP引起的肺部炎症,缓解肺损伤,减轻腹水与肺部水肿症状,促使肺功能恢复,下调TLR4/NF-κB信号通路是其起到上述药理功效的作用机制之一,为AP提供了新的治疗思路,并对五味子乙素的临床推广应用做出了一定贡献。