膝关节骨性关节炎并内翻畸形股骨髁软骨退行性变观察研究
陈德胜, 王胤斌, 张晋宁, 杨天翔, 张博文, 郭凤英, 李 燕
(1.宁夏回族自治区人民医院骨科,宁夏医科大学第三临床学院,银川 750002; 2.宁夏医科大学,银川 750004;3.宁夏医科大学基础医学院,银川 750004)
骨性关节炎(osteoarthritis,OA)是一种以关节软骨的变性、破坏及骨质增生为主的伴有关节疼痛、肿胀、畸形及活动障碍的慢性关节疾病,常见于负重关节[1-3]。膝关节骨性关节炎(knee osteoarthritis,KOA)发病率为8.1%[4]。KOA 并内翻畸形是由于关节软骨细胞代谢异常、软骨基质被破坏。关节的软骨结构中的钙化层和软骨下骨的改变在KOA 并内翻畸形发生、发展进程中发挥着重要作用[5-6]。本研究采用组织学及超微结构,观察KOA 并内翻畸形的病理形态学,以期为KOA 并内翻畸形的骨软骨结构改变的机制研究提供实验依据。
1 资料与方法
1.1 一般资料
选取2018 年11 月1 日至2021 年10 月31日就诊于宁夏回族自治区人民医院及宁夏医科大学总医院行人工全膝关节置换术的KOA 并内翻畸形的55 例患者。其中,男性24 例,女性31 例;平均年龄(71.32±6.22)岁。收集患者经人工全膝关节置换术截骨去除的股骨内外髁的骨及关节软骨组织,用4%多聚甲醛固定为标本。将55 例患者的股骨内髁设为观察组,股骨外髁设为对照组。标本的收集均获得患者及家属的知情同意,获得宁夏医科大学总医院(批准号:2020-974)和宁夏回族自治区人民医院[批准号:〔2022〕-LL-018]医学伦理道德委员会批准。
1.2 纳入与排除标准
纳入标准:1)参照《中国骨关节炎诊疗指南(2021 年版)》[7]诊断为膝骨性关节炎的患者;2)年龄50~80 岁,体质量指数(body mass index,BMI)18.0~31.5 kg·m-2;3)单侧人工膝关节置换术均为患者初次手术;4)术前下肢血管超声无深静脉血栓;5)手术实施及病例随访均由同组医师完成。
排除标准:1)患有冠心病、脑血管疾病等手术禁忌证者;2)患有糖尿病、类风湿性关节炎者;3)近期有关节药物注射史、止痛药物服用史,有糖皮质激素治疗史,患有免疫性疾病者。
1.3 方法
1.3.1 手术方法 手术均由同组医师完成。麻醉满意后,采取膝前正中切口,绕髌骨内侧进入关节内入路;股骨侧髓内定位,定位杆入髓点在植入假体前用骨栓封闭,胫骨侧髓外定位,植入膝关节表面置换假体,股骨与胫骨假体均采用骨水泥固定,髌骨关节面予以修整和去神经化,术中关节腔及切口周围“鸡尾酒”麻药局部注射,放置切口引流。用纱布棉垫包扎。
1.3.2 大体形态观察 行人工全膝关节置换术中外翻髌骨,显露后观察股骨内外髁与软骨大体形态变化。采用截骨术去除骨与软骨组织,采用相应的固定液固定,进行形态学观察。
1.3.3 苏木素-伊红(HE)染色 将切片置于37 ℃恒温箱中过夜,分别经过二甲苯Ⅰ、二甲苯Ⅱ各20 min,无水乙醇Ⅰ、无水乙醇Ⅱ和95%、90%、80%、70%乙醇各5 min,水洗,入苏木素染液染色10 min,水洗,1%盐酸乙醇分化3 s 后自来水冲洗,反蓝20 min,伊红染色1 min,分别置于95%乙醇Ⅰ、95%乙醇Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ中脱水透明,风干后用中性树脂封固,于显微镜下观察。
1.3.4 番红O-固绿染色 将组织切片于37 ℃烤箱中过夜,分别经过二甲苯Ⅰ、二甲苯Ⅱ各10 min,无水乙醇Ⅰ、无水乙醇Ⅱ、不同浓度乙醇各5 min 脱蜡,加入新鲜配制的Weigert 染液3~5 min,1%氯化氢乙醇分化20 s,固绿染液内浸染5 min,番红浸染2 min,乙酸溶液漂洗1 min,不同乙醇脱水,风干,二甲苯透明2 min,中性树脂封固,于显微镜下观察。
1.3.5 免疫组织化学染色 切片烤片、脱蜡、冲洗3 次;4 ℃的3% H2O2孵育30 min,消除内源性过氧化物酶,PBS 缓冲液冲洗3 次;然后将切片放入盛有PBS 缓冲液的收纳盒中,置入煮沸的0.01 mol·L-1柠檬酸缓冲液煮15 min,再将收纳盒放入0 ℃冰水混合物中降温30 min,辅助抗原修复;PBS 缓冲液冲洗3 次后,滴加稀释的羊血清封闭20 min,冲洗、擦干后,滴加一抗(兔抗人Osterix 单克隆抗体)孵育,4 ℃过夜。次日PBS 缓冲液冲洗擦干,滴加二抗(山羊抗兔IgG 聚合物)孵育,37 ℃孵育30 min,冲洗后DAB 显色液显色20 s,苏木素复染5 min,蒸馏水冲洗2 次,1%氯化钠乙醇分化20 s,冲洗、脱水、透明后,中性树脂封固。免疫组化结果应用Image Pro Plus 6.0图像分析软件,观察两组软骨细胞中Osterix 的平均光密度(OD)值,并进行对比。
1.3.6 扫描电子显微镜观察 弃去西林瓶中的液体,更换为4 ℃预冷的1%锇酸浸泡,置于4 ℃冰箱保存,2 h 后用0.1 mol·L-1二甲砷酸冲洗3次,不同浓度乙醇4 ℃脱水,不同浓度乙醇室温下脱水,脱水完成后分别经环氧丙烷、等比不完全包埋液和环氧丙烷混合液、2∶1 的不完全包埋液和环氧丙烷混合液渗透;完成渗透后再次加不完全包埋液室温过夜。次日先置入完全包埋液浸泡后,分别经35 ℃、42 ℃、60 ℃温箱温育。最后以临界干燥法抽真空2 周,将干燥样品黏附在金属样品台上,使用喷镀仪真空喷镀5~6 min,于电子显微镜下观察。
1.4 统计学方法
所有数据运用SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 大体形态观察
观察组股骨髁关节面不光滑,色泽灰暗,部分软骨剥脱有软骨下骨外露,股骨髁软骨面缺损明显,呈溃疡状,股骨髁多处外缘可见骨赘形成,软骨下骨可见松质骨硬化灶(图1A);对照组股骨髁软骨面较光滑且平整,未见软骨明显缺失,软骨表面色泽清亮、均匀,呈乳白色,股骨髁边缘清晰,有少量骨赘生成(图1B)。

图1 股骨髁大体外观照
2.2 HE 染色结果
光镜下可见观察组软骨面凹凸不平,软骨细胞排列不规整,潮线紊乱,软骨下骨质部分异常增厚,可见血管翳从潮线通过,关节软骨被侵蚀和破坏,潮线不完整,软骨下骨出现弥漫性局灶增生现象,不同组织分层界线消失(图2A);对照组软骨面较为光滑、平整,软骨着色均匀,软骨细胞数量多,基质丰富,无局灶性增生(图2B)。
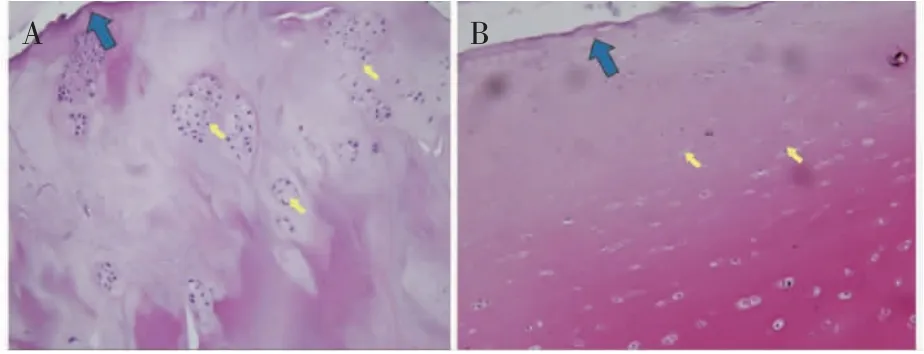
图2 股骨髁HE 染色结果(×20)
2.3 番红O-固绿染色结果
观察组软骨表面存在裂隙,软骨层着色强度不均匀,番红染色在成簇状软骨细胞周围深染,磨损较重的软骨表面有失染现象,软骨基质及细胞数减少,成簇状排列,软骨层与软骨下骨未见明显边界,软骨下方穿插有绿染的骨组织(图3A);对照组软骨面平整,软骨区域着色均匀,无深染或失染现象,细胞核数量较观察组多,排列分散、紊乱,软骨基质丰富,于软骨下骨可见明显分界,软骨无硬化或纤维化表现(图3B)。
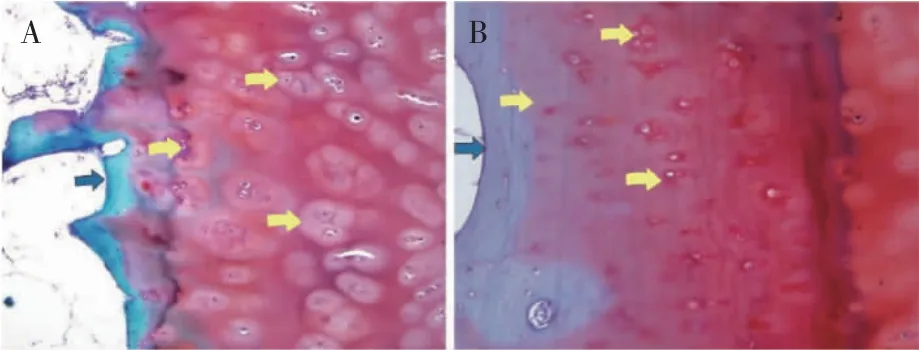
图3 股骨髁番红O-固绿染色结果(×20)
2.4 免疫组织化学染色结果
Osterix 蛋白在胞核中表达,呈棕褐色。观察组软骨细胞中的Osterix 阳性表达少于对照组(图4)。观察组Osterix 蛋白OD 值低于对照组(P<0.01),见表1。
表1 Osterix 免疫组织化学染色结果(±s)

表1 Osterix 免疫组织化学染色结果(±s)
组别Osterix 蛋白OD 值观察组1.156±0.588对照组4.035±1.076 t 值10.161 P 值<0.001
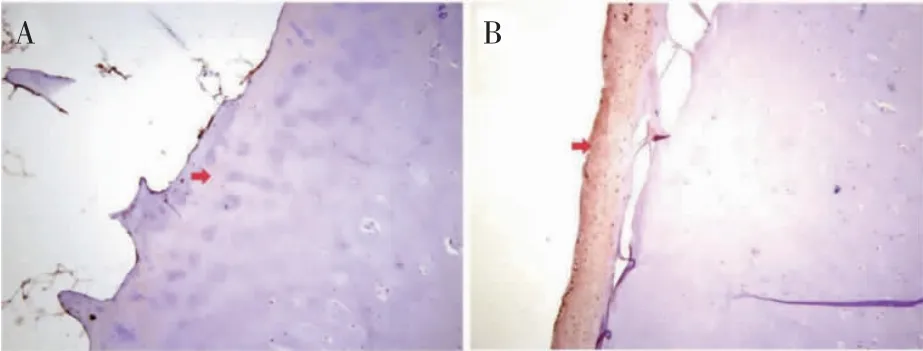
图4 股骨髁Osterix 免疫组织化学染色结果(×20)
2.5 扫描电镜结果
在10 000 倍扫描电子显微镜下可观察到,观察组软骨毁损严重、结构不清,软骨面凹凸不平,存在大量增生凸起及空洞裂隙;对照组表面较为光洁,可见大量软骨细胞凸起及皱褶,软骨间质均匀,见图5。

图5 扫描电子显微镜结果(×5 000)
3 讨论
KOA 是老年人常见的退行性关节疾病。KOA的主要临床表现为膝关节疼痛、肿胀、活动受限,随着年龄的增长以及长期的高运动负荷,会导致关节韧带松弛、关节软骨撞击过度,从而使膝关节出现退变。因此,这种退变最易侵犯和最主要的发病部位是关节软骨,在KOA 终末期可致关节功能障碍甚至残疾[8]。
严重KOA 患者除了出现疼痛和功能障碍外,更多表现为屈曲挛缩并内翻畸形。由于膝关节在活动中膝内侧间室承载的负荷最大,占人体重量的65%~70%[9],膝关节内侧间室高负荷的承载,使膝关节生物力线发生变化,出现不同程度的内侧副韧带及半膜肌腱挛缩;外侧副韧带松弛、内侧半月板和胫骨内侧平台磨损、下沉等,从而使膝关节内侧间室软骨退变磨损、膝关节内翻加重[10]。
正常关节软骨由4 层组成,依次为浅表层、过渡层、辐射层和钙化层,前3 层合并称为透明软骨[11]。软骨基质和软骨细胞共同构成了关节软骨,软骨基质主要由水、胶原纤维和蛋白多糖构成,蛋白多糖存在于胶原纤维之间,属于亲水分子,可产生高度张力,提供关节软骨的弹性和韧性,而水占关节软骨重量的80%,可保持软骨组织的正常形态。关节的软骨下骨由软骨下骨板和骨小梁组成。膝关节软骨尤其是股骨髁软骨的退行性变及生物学特异性可能是KOA 重要的影响因素,关节软骨退行性变与关节软骨下骨塑形改建在KOA 内翻畸形的发生发展中起着非常重要的作用。关节软骨钙化层的病变协同软骨下骨的塑形改建进一步加快了关节软骨退行性变的进程,更有可能是KOA 内翻畸形的始动因素[12]。
本研究通过大体观察、光镜及扫描电镜等对KOA 内翻畸形股骨髁内侧髁与外侧髁的关节软骨进行形态学观察,大体观察结果可以看到股骨内侧髁关节面不光整,并有缺损,色泽灰暗、变黄,软骨下骨外露,股骨髁边缘骨赘多处可见,可能是随着年龄的增长及关节反复活动出现关节磨损,大量关节软骨基质降解,导致KOA 内翻畸形患者关节软骨表面变薄、缺损及粗糙不平。且随着OA 病变发展,关节软骨深层出现裂隙并进一步加深[13]。此外,关节软骨发生色泽上由正常的乳白色半透明状转变为暗黄、浑浊的形态学改变。HE 染色结果显示,KOA 内翻畸形股骨髁内侧髁软骨表面残缺不齐,软骨细胞排列紊乱,呈团状杂乱分布,软骨陷窝及软骨下骨可观察到弥漫性局灶增生改变。提示软骨细胞的代谢、更新是持续存在的,也说明存在软骨细胞再生及软骨基质中的水及蛋白含量异常改变。然而,此改变并不能阻止浅表层软骨退变、缺损和凋亡等病理过程的发生发展[14-16]。通过番红O-固绿染色,可以观察到KOA 内翻畸形股骨髁内侧髁关节软骨基质含量明显减少,嗜碱性番红染色着色不一,嗜酸性固绿染色在关节软骨层接近软骨下骨的部分有着色,说明软骨下骨的基质已发生纤维化改变,这也可能是软骨下骨化的重要原因。推测在KOA 病变的前期,软骨基质的变化可能早于软骨细胞[17],此病理过程由细胞因子、炎性介质、蛋白聚糖酶等多种信号转导通路调控[18-19]。
本研究还观察到,对照组患者的KOA 内翻畸形股骨髁内侧髁软骨组织及软骨下骨中都检测到了大量的Osterix 阳性表达,而观察组的KOA 内翻畸形股骨髁外侧髁软骨组织有少量表达。Osterix 蛋白是一种在骨基质、骨膜和软骨基质高表达的极不稳定转录因子,其稳定性可因多种因素改变,被视为衡量基质蛋白稳定性、成骨活性和转录潜能的标志[18]。通过扫描电镜观察,KOA 内翻畸形股骨髁内侧髁关节软骨缺损严重,结构紊乱,有代偿性增生及软骨缺失后出现的空洞裂隙。从超微结构上观察到,KOA 发展到中、晚期出现严重的内翻畸形,负重关节的股骨内髁与胫骨内侧平台关节软骨面互相磨损、缺失及塌陷等病理改变渐进性加重[6]。
综上所述,本研究通过组织形态学观察KOA内翻畸形两侧的股骨髁关节软骨,通过其病理改变证实了关节软骨钙化层的病变协同软骨下骨的塑形改建在KOA 内翻畸形病情的发生发展中起着重要作用,这为进一步探讨KOA 在中、晚期病变中出现内翻畸形的机制研究提供了实验依据。但本研究还存研究的临床病例有限和缺少分子生物学相关的实验数据、相关指标及具体的组织形态计量学参数等不足,有待今后的临床基础实验中进一步完善。

