经后增殖方含药血清对超排卵大鼠卵巢颗粒细胞GDF9表达及凋亡的调控机制
杨贞, 陈小燕, 江少如, 叶淑珠, 方晓宏, 邓伟民, 郭新宇
(1.揭阳市人民医院,广东揭阳 522000;2.南部战区总医院,广东广州 510010;3.前海人寿广州总医院,广东广州 511325)
本课题组前期通过临床研究证实,益气血法能提高不孕患者体外受精-胚胎移植(IVF-ET)周期中胚胎移植成功率和妊娠率[1-2]。但益气血法具体作用机制尚不完全清楚。颗粒细胞,作为卵泡中数量最多的一种细胞,能通过合成和表达多种激素、生长因子及相关受体,调节卵母细胞及卵泡的发育[3];而颗粒细胞凋亡则可影响该过程,促使卵泡闭锁[4]。作为IVF-ET 周期中的关键环节,控制性超排卵(COH)的应用,能使一个月经周期中卵巢有多个卵泡同时发育。但有研究证实,在COH 中所使用的促性腺激素释放激素激动剂(GnRHa)、促性腺激素(Gn)等,可破坏卵细胞中遗传物质的稳定性,影响核质成熟的同步性,从而抑制卵细胞的发育,降低胚胎质量及妊娠率[5-6]。因此,如何提高卵细胞及胚胎质量一直是生殖医学领域的研究热点之一。基于此,本研究拟通过细胞实验探讨益气血法经后增殖方含药血清对超排卵大鼠卵巢颗粒细胞的调控机制,以期进一步完善益气血法应用于IVF-ET 的理论依据,现将研究结果报道如下。
1 材料与方法
1.1 动物 SPF级雌性SD大鼠27只,鼠龄6~8周,体质量180~220 g,购自南方医科大学实验动物中心,实验动物生产许可证号:SCXK(粤)2021-0041,饲养于中国科学院广州生物医药与健康研究院,实验动物使用许可证号:SYXK(粤)2018-0131。动物实验方案已获得揭阳市人民医院伦理委员会批准,批准编号:201903。实验遵照《关于善待实验动物的指导性意见》(国科发财字[2006] 398 号)。自然光照,大鼠自由饮水和摄食,适应性饲养1周后开始实验,以阴道脱落细胞涂片检查动情周期。
1. 2 药物 经后增殖方(组成:党参15 g、白术12 g、茯苓12 g、甘草6 g、熟地黄12 g、白芍12 g、当归6 g、川芎6 g、菟丝子15 g、鹿角霜20 g、杜仲15 g、山萸肉10 g、川椒3 g),颗粒剂,10 g/袋,由广东一方制药有限公司制备,由南部战区总医院提供,批号:J2001003);醋酸曲普瑞林(GnRHa,瑞士辉凌公司生产,批号:S11775A);孕马血清促性腺激素(PMSG,北京索莱宝公司生产,批号:601Q021);人绒毛膜促性腺激素(HCG,丽珠药业,批号:201202)。
1. 3 试剂与仪器 M199 培养液(美国Hyclone 公司);胎牛血清(美国Hyclone公司);p38丝裂原活化蛋白激酶(MAPK)抑制剂SB203580(美国MCE公司,货号:HY-10256);核转录因子kappaB(NF-κB)抑制剂PDTC(美国MCE 公司,货号:HY-18738);逆转录试剂盒(美国Thermo 公司);荧光定量聚合酶链反应(PCR)检测试剂盒(美国Genecopoeia 公司);辣根过氧化物酶(HRP)标记的GAPDH 优质内参(上海康成生物公司);兔多克隆生长分化因子9(GDF9)抗体(英国Abcam 公司);山羊抗兔IgG(H+L)二抗(美国Southern Biotech 公司);二喹啉甲酸(BCA)法蛋白含量检测试剂盒(南京凯基生物公司);脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)试剂盒(美国Promega 公司)。7500荧光定量PCR仪(美国ABI公司);multiscan MK3 酶标仪(美国Thermo Fisher Scientific 公司);VE180 垂直电泳槽、VE186 转移电泳槽(上海天能公司);BG-Power 600i 型电泳仪(北京百晶生物公司);CKX41倒置光学显微镜(日本Olympus 公司);DMI6000B 倒置荧光显微镜(德国Leica 公司)。
1.4 COH模型及含药血清的制备 将12只雌性大鼠随机分为2组:COH组、COH+中药组。COH模型的建立:阴道涂片为动情周期第3 天时,COH组、COH+中药组的大鼠于每日上午9 时腹腔注射GnRHa 20 μg/kg,给药浓度为20 μg/mL,连续7 d。第7 天同时注射PMSG 400 IU/kg,给药浓度为400 IU/mL,48 h 后注射HCG 1 IU/g,给药浓度为1 000 IU/mL。解剖可见大鼠双侧卵巢有多个优势卵泡,则判断造模成功。中药灌胃:COH 造模第1 天起,COH+中药组大鼠每日上午9 时分别给予经后增殖方4.5 g/kg(相当于3倍临床等效剂量)[7]灌胃,给药浓度0.33 g/mL,连续9 d;COH组大鼠给予等体积生理盐水灌胃。采血:造模第9 天,麻醉大鼠后腹主动脉取血,离心取上清液,56 ℃灭活,同组血清混匀分装,-80 ℃保存,备用。
1. 5 颗粒细胞的制备 15 只雌性大鼠连续观察2 个动情周期均正常。建立COH 模型,在注射HCG 后1.5 h 颈椎脱臼处死。无菌条件下快速取出大鼠双侧卵巢,置入37 ℃、5%CO2过夜预热的M199培养液中,转移至解剖显微镜下37 ℃恒温板上,M199 培养液中洗3 次。解剖显微镜下,用镊子轻轻撕开形态明显的卵泡的卵泡膜,使卵泡内的颗粒细胞释放到培养液中。加入0.1%透明质酸酶消化液,置于CO2孵箱中,5 min 后取出,用移液器轻轻吹打使其分散为单个细胞,加入10%胎牛血清培养液以中和透明质酸酶的作用从而中止消化。经一次性的200目细胞筛过滤后,以1 000 r/min(离心半径16 cm)离心5 min,弃去培养液。M199培养液洗2 次,再次加入适量的M199 培养液重悬颗粒细胞,移液器轻柔抽吸使颗粒细胞重悬。用台盼蓝染色并计数,细胞存活率>85%,再加入含M199培养液调至1×106个/mL。
1.6 颗粒细胞的培养 将颗粒细胞随机种入事先用0.05%L-多聚赖氨酸均匀涂抹过的6孔板中,随机分为5 组:空白血清组、含药血清组、含药血清+SB203580 组、含药血清+PDTC 组、含药血清+SB203580+PDTC 组。每孔2.5 mL,包含M199培养液89%体积,青-链霉素双抗1%体积,大鼠血清10%体积[上述各组分别对应加入空白血清(COH组大鼠血清)、含药血清(COH+中药组大鼠血清)、含药血清+p38MAPK 抑制剂SB203580(按说明书1∶1 000稀释度,即浓度10 μmol/mL,SB203580试剂浓度10 mol/L,添加体积2.5 μL)、含药血清+NF-κB抑制剂PDTC(按说明书1∶1 000稀释度,即浓度10 μmol/mL,PDTC 试剂浓度10 mmol/mL,添加体积2.5 μL)、含药血清+SB203580+PDTC(添加浓度及体积同上)],于CO2孵箱中继续培养24 h后,收集颗粒细胞用于后续检测。
1.7 qRT-PCR 法检测卵巢颗粒细胞中p38MAPK、酪蛋白激酶2(CK2)、核因子κB抑制蛋白α(IκBα)、NF-κB、GDF9 mRNA 的表达 按qPCR 试剂盒说明书进行操作。引物由上海捷瑞生物工程有限公司合成,引物序列见表1。PCR 反应条件为:95 ℃、10 min 预变性;95 ℃、10 s 退火,55 ℃、20 s变性,72 ℃、35 s延伸,40个循环。循环结束后从55 ℃升高到95 ℃获取熔解曲线。以GAPDH进行参照,应用2-ΔΔCt法计算p38MAPK、CK2、IκBα、NF-κB、GDF9 mRNA的相对表达量。

表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
1.8 Western Blot 法检测颗粒细胞中GDF9 蛋白的表达 提取颗粒细胞总蛋白,用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白水平后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白质聚偏氟乙烯(PVDF)膜上转膜,添加兔多克隆GDF9一抗(1∶5 000 稀释度)及山羊抗兔IgG(H+L)二抗(1∶20 000 稀释度),添加发光液,显影,ImageJ 软件处理系统分析目的蛋白及内参GAPDH灰度值。
1.9 TUNEL法检测卵巢颗粒细胞凋亡率 TUNEL检测操作按试剂盒说明书进行,荧光镜下观察,每张封片随机挑选5 个200 倍视野拍照,用ImageJ软件处理系统分析颗粒细胞凋亡率。
1.10 统计方法 采用SPSS 26.0 软件进行统计学分析,计量数据以均数±标准差()表示。方差齐性检验采用Levene 法,多组间比较采用单因素方差分析。组间两两比较采用LSD 检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠卵巢颗粒细胞p38MAPK、CK2、IκBα、NF-κB的mRNA表达比较 含药血清组的p38MAPK表达水平显著低于空白血清组(P<0.05);含药血清组NF-κB mRNA 表达水平低于空白血清组,但差异无统计学意义(P>0.05);含药血清组IκBα、CK2 mRNA 表达水平均显著高于空白血清组(均P<0.05)。见表2。
表2 两组大鼠卵巢颗粒细胞p38MAPK、CK2、IκBα、NF-κB mRNA相对表达水平比较Table 2 Comparison of mRNA relative expressions of p38MAPK,CK2,IκBα and NF-κB in ovarian granulosa cells between the two groups of rats()
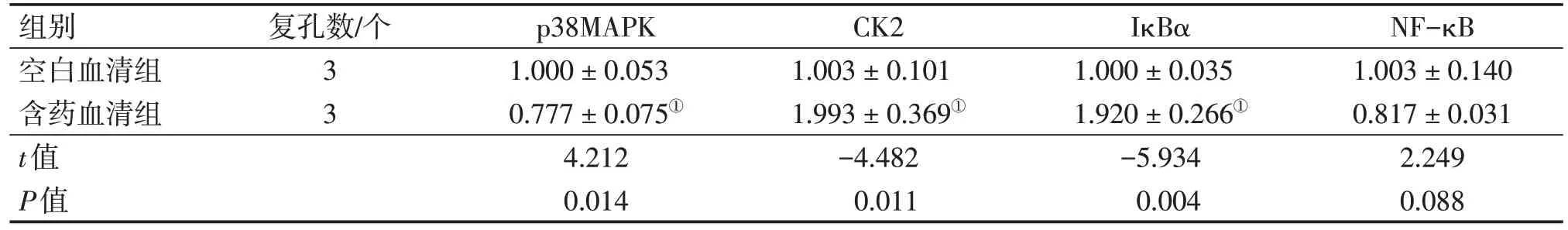
表2 两组大鼠卵巢颗粒细胞p38MAPK、CK2、IκBα、NF-κB mRNA相对表达水平比较Table 2 Comparison of mRNA relative expressions of p38MAPK,CK2,IκBα and NF-κB in ovarian granulosa cells between the two groups of rats()
注:①P<0.05,与空白血清组比较
组别空白血清组含药血清组t值P值NF-κB 1.003±0.140 0.817±0.031 2.249 0.088复孔数/个3 3 p38MAPK 1.000±0.053 0.777±0.075①4.212 0.014 CK2 1.003±0.101 1.993±0.369①-4.482 0.011 IκBα 1.000±0.035 1.920±0.266①-5.934 0.004
2.2 各组大鼠卵巢颗粒细胞GDF9 mRNA 和蛋白表达比较 各组GDF9 mRNA的表达水平:含药血清组>空白血清组>含药血清+PDTC 组>含药血清+SB203580 组>含药血清+SB203580+PDTC 组。其中:含药血清+SB203580组和含药血清+PDTC组比较,空白血清组和含药血清+PDTC 组比较,差异均无统计学意义(P>0.05);其余各组间比较,差异均有统计学意义(P<0.05)。各组GDF9 蛋白的表达水平:含药血清组>含药血清+PDTC 组>含药血清+SB203580 组>空白血清组>含药血清+SB203580+PDTC 组。其中:含药血清+SB203580组与含药血清+PDTC 组比较,差异无统计学意义(P>0.05);其余各组间比较,差异均有统计学意义(P<0.05)。见表3、图1。

图1 各组大鼠卵巢颗粒细胞GDF9蛋白表达的Western Blot条带Figure 1 Western Blot bands of GDF9 protein expression in ovarian granulosa cells in each group of rats
表3 各组大鼠卵巢颗粒细胞GDF9 mRNA和蛋白相对表达水平Table 3 Comparison of mRNA and protein relative expressions of GDF9 in ovarian granulosa cells among various groups of rats()
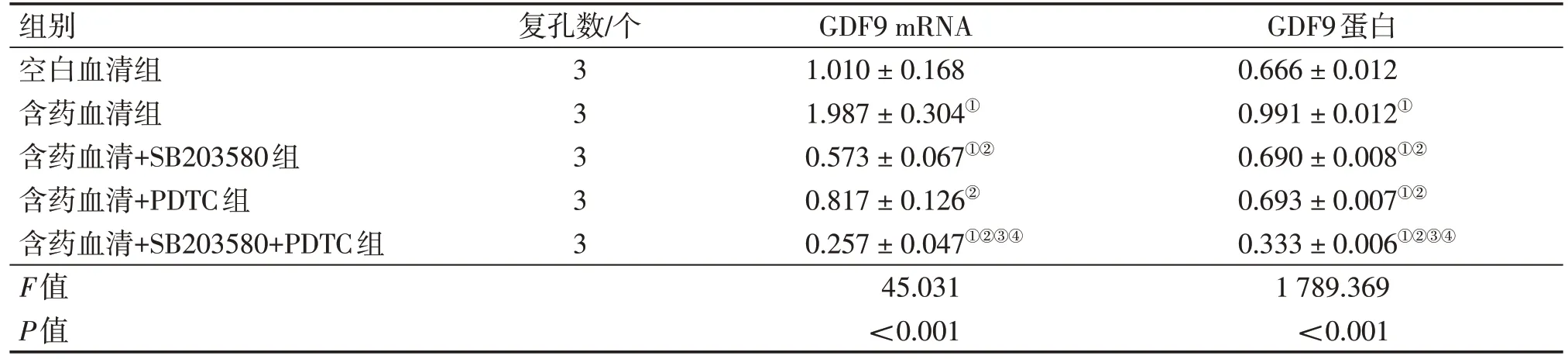
表3 各组大鼠卵巢颗粒细胞GDF9 mRNA和蛋白相对表达水平Table 3 Comparison of mRNA and protein relative expressions of GDF9 in ovarian granulosa cells among various groups of rats()
注:①P<0.05,与空白血清组比较;②P<0.05,与含药血清组比较;③P<0.05,与含药血清+SB203580 组比较;④P<0.05,与含药血清+PDTC组比较
GDF9蛋白0.666±0.012 0.991±0.012①0.690±0.008①②0.693±0.007①②0.333±0.006①②③④1 789.369<0.001组别空白血清组含药血清组含药血清+SB203580组含药血清+PDTC组含药血清+SB203580+PDTC组F值P值复孔数/个3 3 3 3 3 GDF9 mRNA 1.010±0.168 1.987±0.304①0.573±0.067①②0.817±0.126②0.257±0.047①②③④45.031<0.001
2.3 各组大鼠卵巢颗粒细胞凋亡率比较 TUNEL染色后,荧光镜下细胞核呈现蓝色荧光的为正常细胞,呈现绿色荧光的为凋亡细胞。空白血清组呈现绿色荧光的细胞多,中药血清组呈现绿色荧光的细胞少,加入抑制剂后呈现绿色荧光的细胞不同程度增多。各组卵巢颗粒细胞凋亡率:含药血清组<含药血清+PDTC组<含药血清+SB203580组<含药血清+SB203580+PDTC 组<空白血清组。其中:含药血清+SB203580组和含药血清+PDTC组比较,差异无统计学意义(P>0.05);其余各组间比较,差异均有统计学意义(P<0.05)。见表4、图2。
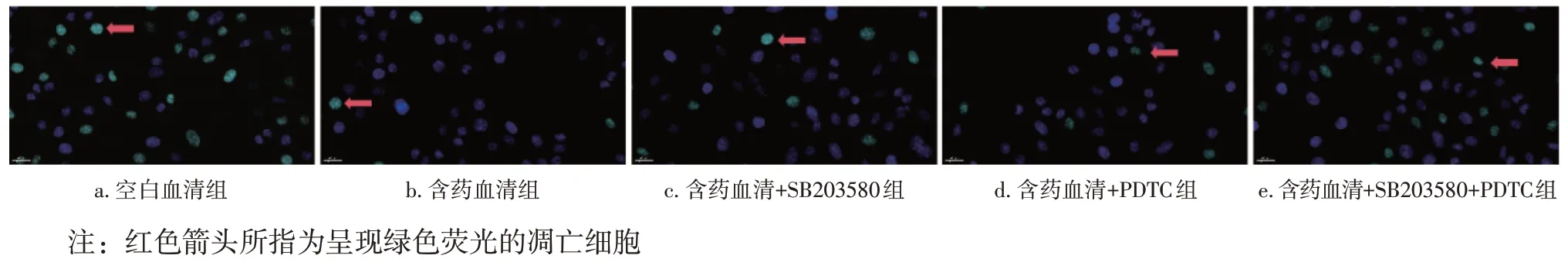
图2 各组大鼠卵巢颗粒细胞凋亡比较(DAPI染色,×200)Figure 2 Comparison of ovarian granulosa cells apoptosis among various groups of rats(DAPI staining,×200)
表4 各组大鼠卵巢颗粒细胞凋亡率比较Table 4 Comparison of the apoptosis index of ovarian granulosa cells among various groups of rats ()
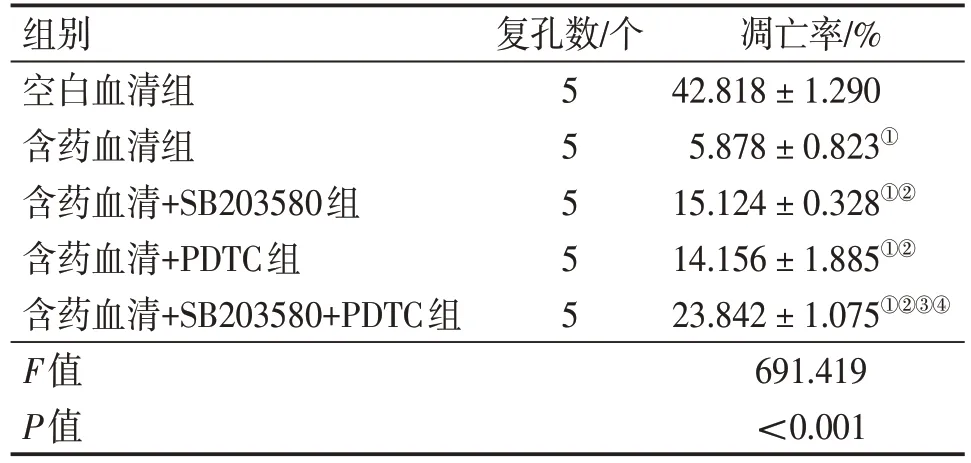
表4 各组大鼠卵巢颗粒细胞凋亡率比较Table 4 Comparison of the apoptosis index of ovarian granulosa cells among various groups of rats ()
注:①P<0.05,与空白血清组比较;②P<0.05,与含药血清组比较;③P<0.05,与含药血清+SB203580 组比较;④P<0.05,与含药血清+PDTC组比较
凋亡率/%42.818±1.290 5.878±0.823①15.124±0.328①②14.156±1.885①②23.842±1.075①②③④691.419<0.001组别空白血清组含药血清组含药血清+SB203580组含药血清+PDTC组含药血清+SB203580+PDTC组F值P值复孔数/个5 5 5 5 5
3 讨论
中医药在体外受精-胚胎移植(IVF-ET)周期中的应用收效明显,已被越来越多的临床医生及患者所接受。中医对不孕的治疗多以益气血、补肝肾为主。本研究所用具有益气血作用的经后增殖方,是由经典方八珍汤(党参、白术、茯苓、甘草、熟地黄、当归、白芍、川芎)加山萸肉、菟丝子、鹿角霜、杜仲、川椒组成。全方补益气血、温肾助阳,契合了不孕症多肝肾气血亏虚的特点。本课题组前期临床研究发现,本方能提高人体内雌激素分泌的水平,促进卵泡发育,提高胚胎的着床潜能及种植率[1-2]。本课题组开展的多项研究证实,益气血法能提高卵母细胞分泌GDF9的水平,并维持Bim低表达水平,促进颗粒细胞的增殖,抑制其凋亡,从而促进卵丘-卵母细胞复合体的发育,提高控制性超排卵(COH)卵泡和胚胎质量[7-11]。因此,在前期的研究基础上,本研究进一步探讨益气血法在调节GDF9分泌及颗粒细胞凋亡过程中的作用机制。
p38MAPK/NF-κB 通路在细胞生长发育及细胞凋亡过程中具有重要的调节作用[12-13]。p38MAPK是丝裂原活化蛋白激酶(MAPKs)家族成员之一。有研究在DNA损伤细胞中发现,活化的p38MAPK能控制多种转录因子mRNA 表达的活性,在细胞因子产生、遗传物质基因转录、基因翻译和细胞生长发育、细胞凋亡过程中均起到重要作用[14-15]。在生殖系统中,睾丸和卵巢中主要有p38δ 亚型的表达[16]。NF-κB是重要的核转录调节因子,参与机体器官发育、组织损伤、免疫应答、细胞凋亡等多种生物学功能的调节[17],在生殖方面,参与卵细胞生长及胚胎发育等过程中与凋亡相关基因的表达和调控[18]。有研究在DNA 损伤的细胞中发现,p38MAPK 能激活CK2,使IκBα 发生磷酸化反应,继而激活NF-κB[14]。
GDF9 是转化生长因子β(TGF-β)超家族成员,是卵母细胞分泌的生长因子。GDF9调控卵细胞中颗粒细胞的增殖、分化,调节卵母细胞的发育、排卵及黄素化[19-20],是卵泡生长发育的重要调节因子。有研究[21]表明,多囊卵巢综合征患者卵巢腔前卵泡中GDF9的表达明显低于正常卵巢,可导致早期卵泡发育异常。而GDF9敲除的新生小鼠始基卵泡池规模几乎不受影响,但始基卵泡消耗快,基因组测序结果提示GDF9与早发性卵巢功能不全相关[22]。
本研究结果显示,经后增殖方含药血清可提高COH大鼠卵巢颗粒细胞GDF9的表达,分别单独阻断p38MAPK和NF-κB通路均能减弱该作用,使GDF9 的表达水平下降,而同时阻断p38MAPK 和NF-κB 通路使COH 大鼠卵巢卵巢颗粒细胞GDF9的表达水平进一步下降,且远低于单独阻断p38MAPK 或NF-κB 通路。经后增殖方含药血清可抑制COH 大鼠卵巢颗粒细胞的凋亡,p38MAPK 或NF-κB 通路的阻断能减弱该作用,使COH 大鼠卵巢颗粒细胞凋亡率增加,而同时阻断p38MAPK 或NF-κB 通路使COH 大鼠卵巢颗粒细胞凋亡率进一步升高,且远高于单独阻断p38MAPK或NF-κB通路。提示益气血法调节GDF9 分泌及颗粒细胞凋亡的机制可能与p38MAPK 通路或/和NF-κB 通路有关。
综上所述,益气血法经后增殖方对COH 大鼠卵巢颗粒细胞GDF9表达的促进作用和对卵巢颗粒细胞凋亡的抑制作用,可能是与p38MAPK通路或/和NF-κB通路双信号通路基因表达有关。

