UV-VIS 法和HPLC法测定医用透明质酸钠敷料中透明质酸钠含量的研究
张丽莹 薄晓文 张婷 孟强 李秋迎
1 山东省医疗器械和药品包装检验研究院 (山东 济南 250101)
2 国家药品监督管理局生物材料器械安全性评价重点实验室 (山东 济南 250101)
3 山东省医疗器械生物学评价重点实验室 (山东 济南 250101)
内容提要: 文章阐述并验证了采用紫外-可见分光光度(UV-VIS)法和高效液相色谱(HPLC)法测定医用透明质酸钠敷料中透明质酸钠含量,并对HPLC法中透明质酸钠酶解过程中的酶解反应时间进行进一步研究。结果显示,HPLC法和UV-VIS法均可以准确高效地测定出不同类型的医用透明质酸钠敷料中透明质酸钠含量,当敷料产品中存在干扰UV-VIS法测定的成分时,应首选HPLC法,可以大幅度提高检测效率和准确度。研究同时发现,在HPLC法中,酶解反应时间对透明质酸钠含量测定结果的准确性起着关键作用,通过对酶解反应时间进行研究,最终确定了不同类型敷料产品的最佳酶解反应时间。
透明质酸是一种高分子黏多糖,最早是在1934 年由Meyer和Palmer[1]从牛眼玻璃体中分离得到。它作为人体生理所必需的物质,广泛地存在于以皮肤真皮为主的多种人体组织、器官中,具有显著独特的润滑和保湿作用[2,3]。由于透明质酸的溶解性和稳定性较差,实际使用时常加入钠质,转化为透明质酸钠。透明质酸钠是一种白色粉末状固体,是由β-D-葡糖醛酸和β-D-N-乙酰氨基葡糖组成的双糖单位反复交替连接而成的非均一性链状天然高分子多糖类物质,它无味、可溶于水、难溶于有机溶剂[4-6]。透明质酸钠不仅拥有透明质酸的高保湿性、高润滑性和高黏弹性,而且还有舒敏修复和抗炎功效,其化学性质更稳定、溶解性更好[7]。透明质酸钠现已被广泛应用于各类医用敷料产品中,在现有的法规文件中,按照医疗器械管理的含透明质酸钠的医用敷料仅限于《分类目录》中管理类别为第三类的“透明质酸钠凝胶(分类编码:14-08-02)”,多利用其物理特性用于术后防粘连[8-10]。由于相关该类产品的使用领域越来越广泛,受用人群也越来越多,所以对该类医用敷料产品的质量检测和把控变得尤为重要。目前,对透明质酸钠含量测定的方法相对成熟,主要包括两种方法:紫外-可见分光光度(Ultraviolet-Visible Spectrophotometry,UV-VIS)法和高效液相色谱(High Performance Liquid Chromatography,HPLC)法。本研究根据医用透明质酸钠敷料的产品特性,首先初步确定了透明质酸钠含量测定的UV-VIS法和HPLC法,同时广泛收集各类医用透明质酸钠敷料产品,最后对两个方法进行了试验验证。
1.实验部分
1.1 UV-VIS法
1.1.1 仪器与试剂
研究起止时间:2023年4月~2023年6月。
仪器:紫外可见分光光度计:UV-2550型,日本岛津公司。超纯水系统:Milli-Q A10型,美国密理博公司。电子天平:德国Mettler Toledo公司。涡旋式混合器:VORTEX-5型,海门市其林贝尔仪器制造有限公司。水浴锅:上海博迅实业有限公司医疗设备厂。
试剂:咔唑(批号:A0373051),Acros Organics。无水乙醇、十水合四硼酸钠、硫酸:均为分析纯,国药集团化学试剂有限公司。葡萄糖酸醛酸(GA)标准品(批号:SLCM5812,纯度:100%,有效期:2025年1月),Sigma。实验用水为超纯水。
1.1.2 溶液配制
0.125%的咔唑乙醇溶液:精密称取0.1250g 咔唑,加100mL无水乙醇溶解,通过超声使其溶解完全。
0.025mol/L的四硼酸钠硫酸溶液:精密称取4.7701g四硼酸钠,加500mL浓硫酸,加盖,正负颠倒摇匀使其溶解完全,低温冷藏保存。
精密称取葡萄糖醛酸(GA)100.16mg于100mL容量瓶中,加纯水溶解并定容至刻度,摇匀,制成1001.6μg/mL的葡萄糖醛酸溶液,作为储备液。
临用前,精密移取储备液5.0mL于100mL容量瓶中,加纯水稀释并定容至刻度,摇匀,制成50.08μg/mL的葡萄糖醛酸标准溶液。分别精密移取该标准溶液0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL 于消解管中,加纯水补充体积至1.0mL,制成浓度为0μg/mL、10.016μg/mL、20.032μg/mL、30.048μg/mL、40.064μg/mL、50.080μg/mL的系列标准溶液。
1.1.3 测定方法
将系列标准溶液各消解管和样品消解管一起置于冰水浴中,缓慢地向每管中加入0.025 mol/L四硼酸钠硫酸5.0mL,涡旋振荡摇匀。置于沸水浴中煮沸10min后取出,放置冰水浴中冷却。然后精密移取0.2mL咔唑乙醇溶液分别加入各消解管内,充分振荡摇匀后,置于沸水浴中加热15min,冷却至室温。用浓度为0μg/mL的消解管作为空白对照,用紫外可见分光光度计,在波长530nm处测定系列标准溶液和样品溶液的吸光度。
用系列标准溶液绘制吸光度与浓度(μg/mL)的标准曲线,将样品溶液的吸光度代入标准曲线计算,得到样品溶液中葡萄糖醛酸的浓度。
1.1.4 样品预处理
精密称取样品适量于适当的容量瓶中,加纯水稀释至刻度,使溶液中透明质酸钠的含量约为50μg/mL,涡旋摇匀,作为样品溶液。精密移取样品溶液1.0mL于消解管中备用。
1.2 HPLC法
1.2.1 仪器与试剂
仪器:高效液相色谱仪:1260型,配PDA检测器,美国安捷伦科技有限公司。电子天平:德国Mettler Toledo公司。涡旋式混合器:VORTEX-5型,海门市其林贝尔仪器制造有限公司。数控超声波清洗器:KQ3200DE型,昆山市超声仪器有限公司。超纯水系统:Milli-Q A10型,美国密理博公司。水浴锅:上海博迅实业有限公司医疗设备厂0.2μm PTFE滤膜,美国Millippre公司。
试剂:磷酸:优级纯,国药集团化学试剂有限公司。二水合磷酸二氢钠、磷酸氢二钠:均为分析纯,国药集团化学试剂有限公司。透明质酸钠对照品:对照品1(批号:22031411,纯度:100%),华熙生物科技股份有限公司;对照品2(纯度:100%),济南磐升生物技术有限公司。透明质酸酶(批号:2204211,纯度:50000 IU/mL),华熙生物科技股份有限公司。实验用水为超纯水。
1.2.2 溶液配制
酶解缓冲液:称取二水合磷酸二氢钠(NaH2PO4·2H2O)2.7450g、无水磷酸氢二钠(Na2HPO4)0.3450g置100mL容量瓶中,加纯水稀释定容至刻度,摇匀,得到0.2mol/L Na2HPO4-NaH2PO4缓冲液。准确量取上述缓冲液12.5~500mL容量瓶中,加纯水稀释至刻度,摇匀,得到稀释40倍后的酶解缓冲液(5mmol/L Na2HPO4-NaH2PO4缓冲液)。
透明质酸酶溶液:准确移取透明质酸酶2.0~25mL的容量瓶中,加酶解缓冲液稀释至刻度,摇匀,得到4000IU/mL透明质酸酶溶液。
1%磷酸:准确量取浓磷酸10.0~1000mL容量瓶中,加纯水稀释至刻度,摇匀,得到1%磷酸。
精密称取透明质酸钠对照品50.05mg于50mL容量瓶中,加酶解缓冲液适量,超声30min,使透明质酸钠对照品充分溶解溶胀,用酶解缓冲定容至刻度,摇匀,制成1001μg/mL的透明质酸钠对照溶液。
1.2.3 色谱条件
色谱柱:MCI GEL CK08EH色谱柱(8×300mm,5μm),三菱化学株式会社;流动相:1%磷酸;流速:0.6mL/min;进样量:20μL;柱温:40°C;检测波长:232nm。
1.2.4 样品预处理
精密称取样品适量于带刻度的塑料离心管中,加入5.0mL酶解缓冲液使样品充分溶解,再加入1.0mL透明质酸钠酶溶液,涡旋混匀,用酶解缓冲溶液补充溶液体积至10mL,使溶液中透明质酸钠浓度约在0.05mg/mL,涡旋混匀,盖盖密封,置于42°C水浴锅中酶解完全后,再煮沸2min使透明质酸钠酶失活,冷却至室温,经0.20μm水性滤膜过滤得到样品溶液。
2.结果与讨论
2.1 UV-VIS法
2.1.1 样品测试结果
用1.1.4项下的样品预处理,采用1.1.3项下的测定方法,对5家生产厂家不同类型的医用透明质酸钠敷料进行含量测试,将测试结果代入公式(1),计算产品中透明质酸钠的含量,样品信息及含量测试结果见表1。

表1.5家生产厂家UV-VIS法测试透明质酸钠含量结果
式中:X1-透明质酸钠含量,单位为mg/mL;2.0675-双糖片断分子量(401.3)与葡萄糖醛酸分子量(194.1)的比值;Ci-由回归方程得到的样品溶液中葡萄糖醛酸(GA)浓度,单位为µg/mL;V-样品稀释倍数;1.01-样品密度,单位为g/mL;S-称取样品重量,单位为g;G-为标示量,单位为mg/mL或mg/g。
2.1.2 讨论
采用UV-VIS法对5家产品中透明质酸钠的含量进行测定,结果显示,这5家产品中透明质酸钠含量测试结果良好,结果均在标示含量规定的范围内。以上结果进一步表明,UV-VIS法准确、可靠、高效,可以适用于不含多元醇和色素等干扰性添加剂的医用透明质酸钠敷料产品中透明质酸钠含量的测定。
2.2 HPLC法
2.2.1 样品测试
广泛收集并选择了具有代表性的含有复杂添加剂的4个不同厂家的医用透明质酸钠敷料产品,对这4批产品用1.2.4项下的样品预处理,采用1.2.3项下的色谱条件进行含量测试,以外标法按照峰面积计算产品中透明质酸钠的含量,将测试结果代入公式(2)或(3),样品信息及含量测试结果见表2,空白酶解液色谱图见图1,透明质酸钠标准溶液色谱图见图2。

表2.4个生产厂家HPLC法测试透明质酸钠含量结果
图1.空白酶解液色谱图
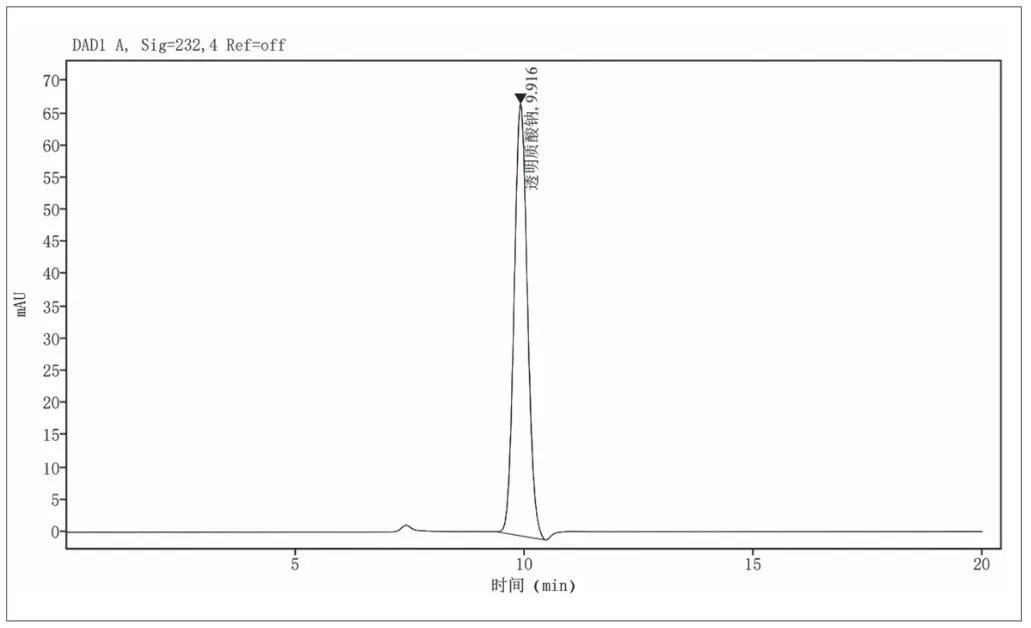
图2.透明质酸钠标准溶液色谱图
式中:X2-透明质酸钠含量,单位为mg/mL 或mg/g;As-样品溶液峰面积;Wr-对照品称样量,单位为mg;Z-对照品纯度;Ar-对照溶液峰面积;ρ-样品密度,单位为g/mL;S-样品称样量,单位为g。
式中:X3-透明质酸钠含量,单位为%;As-样品溶液峰面积;Wr-对照品称样量,单位为mg;Z-对照品纯度;Ar-对照溶液峰面积;S-样品称样量,单位为g。
2.2.2 讨论
采用HPLC法对4家产品中透明质酸钠的含量进行测定,结果显示,这4家产品中透明质酸钠含量测试结果良好,结果均在标示含量规定的范围内。以上结果进一步表明,当医用透明质酸钠敷料中添加多元醇和色素等干扰性添加剂时,HPLC法可以对产品中的透明质酸钠进行准确定量,该法适应性好且高效可靠。
2.2.3 酶解反应时间研究
试验过程中,发现酶解反应时间长短对透明质酸钠酶解结果有至关重要的影响。该研究在最佳酶用量(4000 IU/mL,1.0mL)的基础上对酶解反应时间开展深入探索,对来源不同的4批医用透明质酸钠敷料分别设置了不同的酶解反应时间,即2h、2.5h、3h,采用1.2.3项下的色谱条件进行含量测试,将透明质酸钠含量最大值所对应的酶解反应时间作为最佳酶解反应时间。样品信息及实验结果见表3。

表3.HPLC法中不同酶解反应时间含量测试结果
结果显示,产品F、H、I在酶解反应时间为2h时达到了含量最大值,产品G在酶解反应时间为2.5h时达到了含量最大值,表明不同生产工艺的医用敷料产品在透明质酸钠酶解过程中所需的最佳酶解反应时间不同。因此采用HPLC法测定不同类型敷料中的透明质酸钠含量时,须对最佳酶解反应时间进行研究和验证,以保证测定结果的准确性。
3.小结
随着技术的发展,医用透明质酸钠敷料产品的工艺类型越来越多样化,市面上已存在包括液体敷料、凝胶敷料、敷贴、冻干粉和冻干海绵等形式各异的医用敷料产品。在医用敷料产品中起到主要功效的成分是透明质酸钠,因此它是进行研究的首要对象,完善针对该类产品中透明质酸钠含量快速高效检测方法的建立,关乎全民医疗器械使用安全,对保障人民健康具有重要意义。
现已执行的医疗器械行业标准YY/T 0308-2015《医用透明质酸钠凝胶》和YY/T 0962-2021《整形手术用交联透明质酸钠凝胶》均采用UV-VIS法对透明质酸钠含量进行测定。刘丽君等[11]、李敏等[12]和汤祥忠等[13]也曾采用UV-VIS法对止血材料、滴眼液和乳制品等产品中的透明质酸钠含量进行了测定。UV-VIS法是Bitter和Muir改良的咔唑法,现已广泛应用于食品、药品、化妆品和医疗器械等各个领域中对透明质酸钠含量的测定,但该法还未针对医用透明质酸钠敷料产品进行全面系统的试验验证,因此通用的UV-VIS法成为医用透明质酸钠敷料产品中透明质酸钠含量测定的首选方法[14]。但由于医用敷料产品中的成分往往很复杂,主要成分除了水和透明质酸钠外,也常添加多元醇(丙三醇)和色素等显色成分添加剂来增强其保湿和识别作用,这些添加剂会干扰UV-VIS法中的显色过程,对测定结果产生影响,此时可以选择高效液相色谱(High Performance Liquid Chromatography,HPLC)法对透明质酸钠含量进行测定。张志舟等[15]、陈玉娟等[16]和张莉等[17]曾采用HPLC法对透明质酸钠含量展开了研究,结合现已有的色谱方法,将HPLC法作为医用透明质酸钠敷料产品中透明质酸钠含量测定的另一高效、准确、可行的检测方法。
本研究同时确定了医用透明质酸钠敷料中透明质酸钠含量测定的UV-VIS法和HPLC法,并对两种方法进行了试验验证。验证结果表明UV-VIS法和HPLC法均可用于医用透明质酸钠敷料类产品的透明质酸钠含量测定。但当产品中添加了多元醇、色素等干扰UV-VIS法的添加剂时,应首选HPLC法进行含量测定。另外,在选择HPLC法时,要对透明质酸钠的酶解时间进行控制,选择透明质酸钠能够酶解完全的反应时间作为最终酶解时间,以便高效、准确地测得医用透明质酸钠敷料中透明质酸钠的真实含量。

