Twist调控人胃癌组织中的上皮间质转化和血管生成拟态作用机制研究
于淇?张兆堃?鄂思含?李露露?徐万鹏

摘 要|目的:研究Twist促进VM的形成,丰富和完善了血管生成拟态理论。方法:观察胃癌组织及正常胃组织Twist、EMT标志蛋白(E-cadherin和Vimentin)及VM标记物CD34-PAS的表达情况,分析Twist、EMT标志蛋白与胃癌临床病理特征的相关性,研究VM与EMT标志蛋白的关系,Twist与EMT标志蛋白的关系。进一步验证Twist通过促进胃癌EMT、从而促进VM的形成结果:EMT标志蛋白和VM有统计学差异,Twist及EMT标志蛋白有一定的相关性。结论:Twist可能诱导胃癌细胞EMT的发生,并促进胃癌VM的形成。
关键词|EMT;Twist;侵袭;相关性
Copyright ? 2024 by author (s) and SciScan Publishing Limited
This article is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License. https://creativecommons.org/licenses/by-nc/4.0/
Twist是人类胚胎发育的主要调控因子,其中Twist1基因通过其诱导上皮-间充质转化(EMT)的能力,被证明有利于癌细胞的转移扩散。通过之前的研究表明,很大一部分人类癌症过度表达了Twist1或Twist2基因[1]。胃癌(gastric carcinoma,GC)是一种恶性肿瘤,源于胃黏膜上皮细胞的异常增生。胃癌的流行病学表现在不同地区呈现显著差异,特别是西北和东部沿海地区,发病率比南方地区明显偏高。胃癌通常易发病于50岁以上人群,但随着现代饮食结构的改变、工作压力的增大以及幽门螺杆菌感染等多种因素的影响,胃癌呈年轻化趋势。尽管在发达国家(如欧美等)胃癌的患病率和死亡率呈下降趋势,这与社会经济发展和生活水平提高相关,但在亚洲和拉丁美洲等地,胃癌依然属高发疾病。近年来,胃癌早期诊断率、综合治疗效果、手术切除率以及术后生存率都有所提高[2]。
1 肿瘤血管生成与血管生成拟态
传统的血管生成理论认为,肿瘤的生长依赖于新血管的形成。一旦实体肿瘤的直径超过2mm,就迫切需要引导血管生成,以获取足够的血液供应以维持其持续性生长;否则,肿瘤细胞可能因为缺乏足够的血氧供应而发生坏死[3]。抗血管生成治疗应运而生,但随着抗血管生成药物的广泛应用,有学者发现并没有取得预期的效果。1999年,美国Maniotis等[4]在研究高侵袭性人眼葡萄膜黑色素瘤微循环时发现并命名了一种新的血液供应模式——VM。VM的发现打破了传统认为肿瘤获得血供的唯一途径为内皮血管的理论,解释了具有高侵袭性、高转移性的恶性肿瘤的生物学行为。VM是由肿瘤细胞而不是内皮细胞(内皮细胞标记物CD34阴性)在特定的微环境下通过自身塑形及细胞外基质重塑围成的、内有一层基膜样物质(正常血管壁及VM壁的组成部分标记PAS阳性)的不规则的网格状类血管样管道[5]。三维培养是目前体外实验研究VM的一个相当重要的评价方法[6],基质胶的作用与哺乳动物细胞基底膜类似,是体外研究VM理想的支架来源之一。
2 EMT与血管生成拟态
参与形成VM的肿瘤细胞模拟内皮细胞的功能和表型,而内皮细胞本身属于间质细胞的一种,因而可能发生肿瘤细胞由上皮型向间质型内皮细胞转化,这种现象就是EMT[7]。EMT是一定条件下紧密连接的上皮细胞向连接松散的纺锤体样间质细胞转化的动态病理过程,同时细胞形态发生相应的变化。通过EMT,肿瘤细胞获得了较高的转移和侵袭能力,在肿瘤的发生发展过程中扮演重要角色。
3 材料和方法
3.1 研究对象
收集临床上经手术切除并经病例证实的原发性胃癌石蜡标本,术前未进行化疗、放疗及免疫治疗等肿瘤特异性治疗。搜集患者年龄、肿瘤直径、临床分期、组织学分级、有无淋巴结转移及脉管癌栓形成等资料。另外病理证实胃良性溃疡术后或胃减重手术后正常胃组织标本作为对照研究。患者签署受试者知情同意书,并遵守单位医学伦理委员会的相关规定。
3.2 方法
蛋白免疫组织化学染色:采用S-P免疫组织化学方法检测Twist、E-cadherin、N-cadherin蛋白表達,具体操作如下:
(1)石蜡切片厚度3μm,60~65℃烘烤4小时;
(2)PBS缓冲液冲洗2次,每次5分钟;
(3)组织抗原修护;
(4)PBS缓冲液洗涤3分钟;
(5)每片加50μL过氧化物酶使溶液闭塞,室温孵育10分钟;
(6)PBS冲洗33分钟;
(7)去PBS,每片加无免疫性动物血清50μL,室温孵育10分钟;
(8)PBS冲洗35分钟;
(9)去PBS,每片加液,室温温育;
(10)PBS冲洗33分钟;去PBS,每片加1滴,室温孵育10分钟;PBS冲洗3次,每次3分钟;
(11)去PBS,每片加新鲜DAB1~2次,显色3~10分钟,阳性显色为褐色或黄色;
(12)自来水冲洗,苏木素复染,自来水冲洗10~15分钟;
(13)配制DAB显色试剂,切片梯度酒精脱水干燥,透明化用二甲苯,按“切片脱蜡,水化”程序反向进行,最后中性树胶封固。
CD34-PAS双重染色:
(1)包埋好的标本用石蜡切片机切片,厚度4μm;
(2)切片经烤片处理、二甲苯脱蜡、梯度酒精至水;
(3)将切片放入pH为6.0的0.1mol/L柠檬酸抗原修复液中,进行沸水浴处理,保持20分钟,停止加热后自然冷却20~30分钟。
(4)用0.01mol/LPBS清洗3次,每次3分钟,阻水笔圈画组织,滴加3%的过氧化氢,封闭10分钟,以去除内源性过氧化物酶;
(5)用0.01mol/LPBS洗涤3次,每次3分钟,洗去过氧化氢,甩干PBS,滴加5%的山羊血清室温封闭1小时;
(6)滤纸吸干多余封闭液,根据预实验结果或抗体说明书中的建议浓度,滴加适宜浓度的一抗置湿盒中4℃孵育过夜;
(7)第二天,使用0.01mol/L的PBS进行3分钟的清洗,共进行5次,将一抗去除。将多余的PBS甩去后,滴加二抗,将切片置于室温下的孵育盒中进行30分钟的孵育;
(8)用0.01mol/LPBS清洗5次,每次3分钟,洗去多余的二抗,甩去多余PBS,保持切片濕润的状态下,滴加DAB显色液,显微镜下观察阳性,记录最佳显色时间,其余切片相同时间显色;
(9)水洗多余的DAB(DAB为一类致癌物,水洗后的废液需要加入硫酸-高锰酸钾水溶液中和,可安全排出);
(10)去离子水轻洗玻片,置换掉自来水分,甩干玻片上的水分,滴加高碘酸液,室温处理10分钟,去离子水洗2~3次,每次静置1~2分钟;
(11)甩去玻片上的水分,4℃取出PAS试剂,直接滴染,室温孵育10分钟;注意该步反应需要及时避光;用避光纸盖住即可,不要移动,防止染液流动;
(12)PAS染色时间到后,使用亚硫酸冲洗液清洗玻片3~5次,每次静置1~2分钟;
(13)复染,滴加苏木素染色液,室温3分钟,0.01mol/LPBS洗去多余的染液,3分钟3次;
(14)进行梯度酒精复水处理:先使用80%酒精浸泡5秒,然后95%酒精浸泡10秒,接着使用100%酒精浸泡3分钟,之后再用100%酒精浸泡5分钟。接下来,使用二甲苯Ⅱ进行透明处理5分钟,然后使用二甲苯Ⅰ进行透明处理5分钟(如果未完全透明,可适当延长时间);
(15)中性树胶封片,待树胶干透后,镜检。
结果判定、评分:免疫组化结果的判定采用免疫反应半定量积分法,总分等于染色强度积分乘以阳性细胞比例积分。染色强度积分按照不显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分进行评分;阳性细胞比例积分通过在低倍镜下随机计数10个视野,确保总肿瘤细胞数不低于1000个,计算阳性细胞比例,分别为0分(0%)、1分(1%~10%)、2分(11%~50%)、3分(51%~80%)、4分(>80%)。总分范围为0~12分,定义0~3分为阴性,3分为阳性。CD34-PAS双重染色及VM判定:CD34阳性颗粒在血管内皮细胞浆/膜表达,PAS阳性在血管腔壁基膜表达,呈紫红色或樱桃红色。具体判定标准为:由CD34阴性肿瘤细胞(在HE光镜下确认)围成的内有一层不规则血管状结构的PAS阳性基膜样物质,有时其内可见红细胞,管路周围无出血、坏死及明显炎细胞,判定为VM。其中,CD34和PAS均为正向表达的规则环状物质,被排除为内皮血管。
3.3 统计学方法
本研究采用SPSS22.0软件进行统计分析,以X±S表示计量数据计数数据采用χ2检验,并加以采纳。将检验标准定为α=0.05,在p值小于0.05的情况下,会认为差值存在统计学意义。
4 结果
4.1 人胃癌组织中VM表达情况分析
这项研究在术后对50名胃癌患者实施了蜡块VM表达的组织检测。研究结果显示,的确有VM现象存在于胃癌患者身上。研究发现,50例胃癌患者中,VM表达(+)的患者有。此外,VM阳性表达与统计学上具有一定意义(p<0.05)的肿瘤组织分化较差、临床分期较高、复发转移等有关。
4.2 人胃癌组织中VM蛋白和EMT蛋白表达的相关性分析
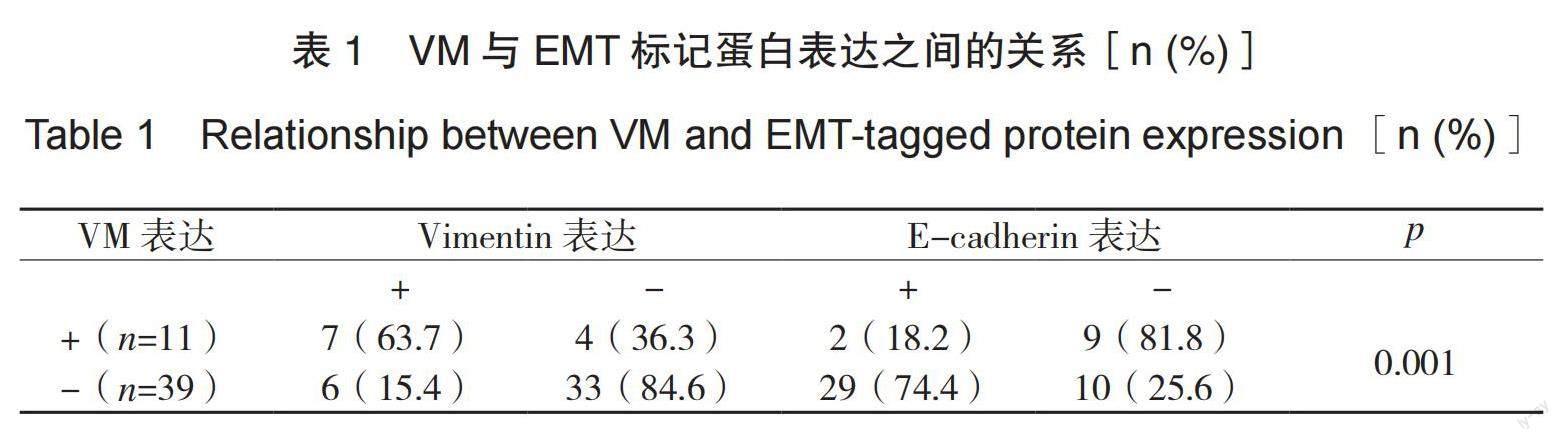
这项研究发现,在11例VM阳性结肠癌组织中,Vimentin的高表达率为63.7%,而E-cadherin的低表达率为18.2%。相比之下,在VM阴性组中,Vimentin的低表达率为15.4%,E-cadherin的低表达率为74.4%(详见表1)。通过统计学分析发现,VM阳性组与阴性组的E-cadherin的胃癌细胞在表达方式(p<0.05)上存在显著差异,具有统计学意义。这表明,在有VM的胃癌组织中,上皮间质转化(EMT)更容易发生在肿瘤细胞中,表达的Vimentin和E-cadherin有相关性。
4.3 Twist和EMT蛋白在胃癌组织中的表达
在50例胃癌组织标本中,Twist蛋白表达阳性的病例数为35例(70.00%),E-cadherin蛋白表达阳性的病例数为19例(38.00%),维门汀蛋白表达阳性的病例数为24例(48.00%)。经统计分析发现,Twist蛋白在表达上(p=0.000)在胃癌组织中差异明显(表2)。
研究的50例胃癌组织标本中,35例显示Twist蛋白表达阳性,其中19例胃癌组织呈现E-cadherin蛋白表达阳性。此外,在15例Twist蛋白呈阴性表达的胃癌组织中,有11例患者出现E-cadherin蛋白呈阴性表达。Spearman等对这两种蛋白的相关性分析表明:Twist蛋白E-cadherin蛋白表达呈正相关系数为0.544,其相关性具有统计学意义(p=0.010)。此外,35例表达Twist蛋白阳性的胃癌组织中,24例显示Vimentin蛋白表达阳性;然而,在15例Twist蛋白呈阴性表达的胃癌组织中,有12例患者出现Vimentin蛋白呈阴性表达。Spearman等对这两种蛋白的相关性分析表明:Twist蛋白Vimentin蛋白表达呈正相关系数为0.362,其相关性具有统计学意义(p=0.010)。
5 讨论
TWIST基因是一种重要的转录因子,已被证明在多种癌症中发挥关键作用,尤其在胃癌的发展中具有显著影响[8],且该研究表明TWIST通过调控细胞黏附、迁移和侵袭相关基因,引导胃癌细胞发生上皮间质转化。上皮-间质转化使癌细胞失去上皮细胞独有的结构,获得间质细胞的特征,从而增强了细胞的迁移和侵袭能力。TWIST还参与了胃癌组织中的易化血管生成拟态,促使血管内皮细胞发生拟态变化,表现出肿瘤相关的血管生成特征[9]。这进一步支持了肿瘤的生长和营养供应。在分子水平上,TWIST通过与其他转录因子和信号通路相互作用,调控了一系列与癌细胞生物学特征相关的基因表达,这包括促进细胞周期的变化、抑制凋亡、增强细胞迁移和侵袭等关键过程[10,11]。TWIST的过度表达与胃癌的临床病理特征、预后及治疗反应密切相关,因此,TWIST基因可能成为胃癌预后评估和治疗靶点的重要标志物[12]。未来的研究可以重点关注以下方向:深入挖掘TWIST在信号通路中的交叉调控机制,阐明其与其他关键因子的相互作用;探讨TWIST在胃癌早期诊断和预测预后中的潜在价值;开展药物筛选研究,寻找能够干预TWIST作用的新型治疗靶点。TWIST作为胃癌发展的关键调控因子,其在诊断、治疗和预后评估方面具有广阔的应用前景。深入研究TWIST的分子机制有望为开发靶向TWIST的治疗药物提供理论基础,为个体化治疗和精准医学奠定基础。TWIST在人胃癌组织中的作用机制复杂而多样,涉及上皮间质转化和易化血管生成拟态等多个方面。未来的研究和应用将有望深化对TWIST在胃癌中的理解,并为相关治疗策略的制定提供有力支持。
綜上所述,TWIST基因在人胃癌组织中通过促进上皮间质转化和易化血管生成拟态等多个机制参与了肿瘤的发展和进展。深入理解TWIST在胃癌中的作用有望为胃癌的治疗提供新的靶点和策略。
参考文献
[1]Ansieau S,Bastid J,Doreau A,et al.Induction of EMT by twist proteins as a collateral effect of tumor-promoting inactivation of premature senescence[J].Cancer Cell,2008,14(1):79-89.
[2]Wang RX,Ou XW,Kang MF,et al.Association of HIF-1α and NDRG2 Expression with EMT in Gastric Cancer Tissues[J].Open Life Sci,2019,14:217-223.
[3]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[4]Maniotis AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol, 1999,155(3):739-752.
[5]Fan YL,Zheng M,Tang YL,et al.A new perspective of vasculogenic mimicry:EMT and cancer stem cells[J].Oncol Lett,2013,6(5):1174-1180.
[6]Lin AY,Ai Z,Lee SC,et al.Comparing vasculogenic mimicry with endothelial cell-lined vessels:techniques for 3D reconstruction and quantitative analysis of tissue components from archival paraffin blocks[J].Appl Immunohistochem Mol Morphol,2007,15(1):113-119.
[7]Creighton CJ,Gibbons DL,Kurie JM.The role of epithelial-mesenchymal transition programming in invasion and metastasis:a clinical perspective[J].Cancer Manag Res,2013,5:187-195.
[8]Xin Y,Ning S,Zhang L,et al.CDC27 Facilitates Gastric Cancer Cell Proliferation,Invasion and Metastasis via Twist-Induced Epithelial-Mesenchymal Transition[J].Cell Physiol Biochem,2018,50(2):501-511.
[9]Zang C,Liu X,Li B,et al.IL-6/STAT3/TWIST inhibition reverses ionizing radiation-induced EMT and radioresistance in esophageal squamous carcinoma[J].Oncotarget,2017,8(7):11228-11238.
[10]Wang J,Wang T,Zhang Y,et al.CPEB1 enhances erastin-induced ferroptosis in gastric cancer cells by suppressing twist1 expression[J].IUBMB Life,2021,73(9):1180-1190.
[11]Yin Y,Li X,Guo Z,et al.MicroRNA?381 regulates the growth of gastric cancer cell by targeting TWIST1[J].Mol Med Rep,2019,20(5):4376-4382.
[12]Yu G,Chen W,Li X,et al.TWIST1-EP300 Expedites Gastric Cancer Cell Resistance to Apatinib by Activating the Expression of COL1A2[J].Anal Cell Pathol,2022.
Investigation of the Mechanisms by which Twist Regulates Epithelial-mesenchymal Transition and
Vasculogenic Mimicry in Human Gastric Cancer Tissues
Yu Qi1 Zhang Zhaokun1 E Sihan1 Li Lulu2 Xu Wanpeng3
1. Weifang Medical University, weifang;
2. The Hospital affiliated with WeiFang Medical College Department of Pathology, weifang;
3. The Hospital affiliated with WeiFang Medical College Gastrointestinal surgery, weifang
Abstract: Objective: The aim of this study was to investigate the role of Twist in promoting Vasculogenic Mimicry, thereby enriching and enhancing the theory of vasculogenic mimicry. Methods: The expression of Twist, Epithelial-mesenchymal Transition markers (E-cadherin and Vimentin), and VM marker CD34-PAS were observed in gastric carcinoma tissues and normal gastric tissues. The correlation between Twist, EMT markers, and clinical pathological features of gastric carcinoma was analyzed. The relationship between VM and EMT markers, as well as Twist and EMT markers, was studied. Furthermore, the involvement of Twist in promoting gastric carcinoma EMT and VM formation was validated. Results: Significant differences were observed in the expression of EMT markers (E-cadherin and Vimentin) and VM marker CD34-PAS. Twist showed a certain correlation with EMT markers. Conclusion: Twist may induce EMT in gastric carcinoma cells and promote the formation of VM in gastric carcinoma. Note The translation provided aims to align with the language style typically used in scientific publications.
Key Words: EMT; Twist; Invasion, Correlation

