桑黄菌丝多糖的提取及氧化还原性分析
刘开莉 梁贵秋 莫炳巧 肖潇 徐雯雯 李安华 陆春霞韦师妮 李小群
摘要 通过对桑黄多糖提取方法进行选取并测定其含量,选出提取率高的多糖提取方法以及最优条件,结果表明超声波辅助酶法较水浴辅助溶剂浸提法和微波辅助提取法得率更高,最佳提取条件为料液比1∶20(g: mL)、超声波提取时间40 min、超声波功率300 W、加酶量0.15%,在此条件下,桑黄菌丝多糖得率为(6.58±0.01)%;通过HPLC外标法对桑黄菌丝多糖进行成分分析,得出桑黄菌丝体多糖主要单糖成分有甘露糖、氨基葡萄糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖、阿拉伯糖、巖藻糖;通过对桑黄菌丝多糖进行氧化还原分析,得出桑黄菌丝多糖均有一定的抗氧化能力,但相较VC,桑黄菌丝多糖的抗氧化能力效果略弱。
关键词 桑黄菌丝;多糖;提取;成分测定;氧化还原性
中图分类号 R284 文献标识码 A
文章编号 0517-6611(2024)04-0157-05
doi:10.3969/j.issn.0517-6611.2024.04.035
开放科学(资源服务)标识码(OSID):
Extraction of Polysaccharide from Mycelia of Sanghuangporus lonicericola and Analysis of Oxidative Reducibility
LIU Kai.li1,2,LIANG Gui.qiu1,2,MO Bing.qiao1,2 et al
(1.Guangxi Silkworm Technology Promotion Station,Nanning,Guangxi 530007;2.Guangxi Key Laboratory of Sericultural Genetic Improvement and Efficient Breeding,Nanning,Guangxi 530007)
Abstract By selecting extraction method and determining the content of polysaccharide of S. lonicericola, the polysaccharide extraction method with high extraction rate and the optimal conditions were selected. The results showed that ultrasonic assisted enzymatic method had a higher yield than water bath assisted solvent extraction method and microwave.assisted extraction method. The optimal extraction conditions were solid.liquid ratio of 1∶20 (g∶mL), ultrasonic extraction time of 40 min, ultrasonic power of 300 W, the enzyme dosage of 0.15%. Under these conditions, the yield of polysaccharide from mycelial of S. lonicericola was (6.58±0.01)%. By HPLC external standard method, the main monosaccharide components of S. lonicericola mycelial polysaccharide were mannose, glucosamine, ribose, rhamnose, glucuronic acid, galacturonic acid, amino galactose, glucose, galactose, xylose, arabinose and fucose. Through oxidation.reduction analysis of S. lonicericola mycelial polysaccharide, it was found that S. lonicericola mycelial polysaccharide had certain antioxidant capacity, but compared to VC, the antioxidant effect of S. lonicericola mycelial polysaccharide was slightly weaker.
Key words S. lonicericola mycelial;Polysaccharide;Extract;Composition determination;Oxidation reduction
基金项目 广西重点研发计划项目(桂科AB21196040);国家现代农业产业技术体系广西创新团队建设项目(nycytxgxcxtd-2021-02-05)。
作者简介 刘开莉(1988—),女,广西玉林人,农艺师,从事蚕桑资源综合利用和食品加工研究。*通信作者,正高级农艺师,硕士,从事蚕桑资源综合利用、食品加工和食品微生物研究。
收稿日期 2023-03-31
桑黄[Sanghuangporus lonicericola (Parmasto) L.W.Zhou & Y. C. Dai]是锈革孔菌科桑黄属真菌,菌盖呈木质状,扁平球形或马蹄形,颜色呈浅肝褐色至暗灰色或黑色,幼期有细微绒毛,后变无毛,有同心环棱,老时常龟裂,无皮壳,菌肉深咖啡色,木质[1]。桑黄可多年生长在树上,主要寄生于桑树,杨树、桦树等树木上也可生长,目前桑黄已实现人工栽培,我国东北、华北等已广泛人工栽培桑黄[2-3]。桑黄始载于《药性论》,其具有抗肿瘤、抗癌、抗氧化等作用,尤其对妇科疾病具有一定的疗效,因此被赋予“桑树黄金”的美誉[4-5]。随着桑黄药用价值的不断被挖掘,桑黄栽培得到越来越重视,同时其活性成分的提取、分离等研究也取得了有效进展。桑黄菌丝提取多糖较子实体提取多糖更为容易,利用价值更高,因此该试验通过对桑黄菌丝多糖提取的方法、成分测定和氧化还原性进行分析,以期为桑黄进一步开发利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试材。桑黄菌种由广西壮族自治区蚕业技术推广站食品加工研究实验室提供。在无菌的环境中,取1 cm3桑黄母种,接入经高压灭菌的100 mL PD培养基中,置于26 ℃、150 r/min的摇床中培养14 d,过滤得到菌丝体,将桑黄菌丝体于60 ℃烘干至质量恒定,粉碎过60目筛,置于封口袋中于冰箱中冷冻备用。
1.1.2 试剂。无水乙醇、苯酚、浓硫酸、无水葡萄糖等,均为分析纯,由生工生物工程(上海)股份有限公司生产。
1.1.3 仪器。全温培养摇床(QHX-250BSH-Ⅲ型);电热恒温鼓风干燥箱(DHG-9245A型);电子分析天平(ME104型);数控超声清洗器(KQ-500B型);冷冻离心机(H1750R);断水自控电热蒸馏水器;粉碎机;酶标仪。
1.2 试验方法
1.2.1 苯酚溶液的制备与标准曲线的绘制。
1.2.1.1
苯酚溶液的制备。称取80 g苯酚(C6H12O6,重蒸馏)于100 mL烧杯中,加水定容至100 mL的棕色容量瓶中,得到80%的苯酚溶液。吸取5 mL苯酚溶液(80%)溶于75 mL 水中,混匀,现用现配,标记为苯酚工作液。
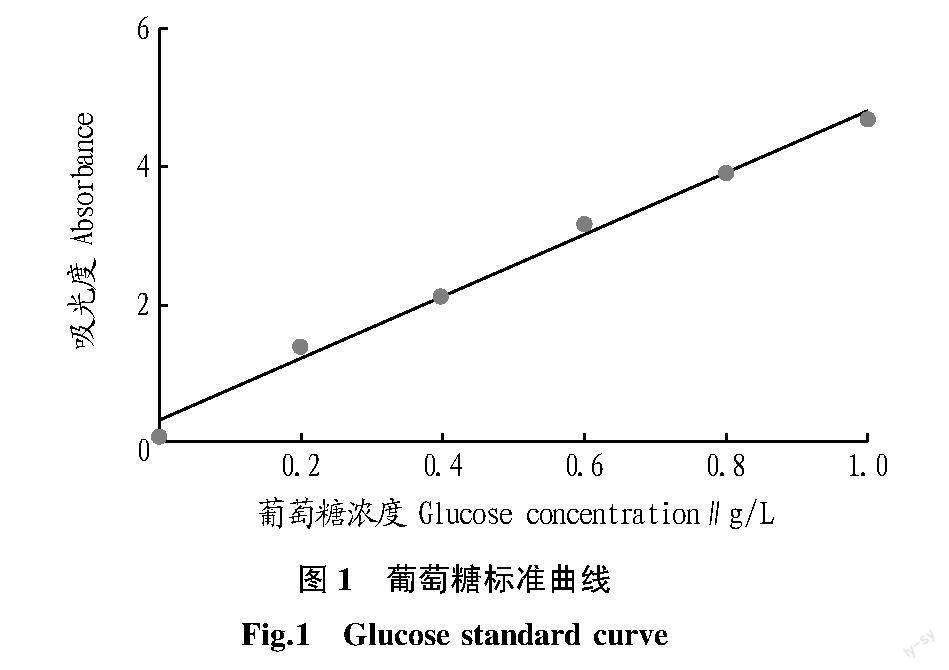
1.2.1.2 标准曲线的绘制。根据中华人民共和国出入境检验检疫行业标准SN/T 4260—2015[6]的苯酚-硫酸法绘制标准曲线。将葡萄糖于105 ℃恒温烘干至恒重,准确称取1.000 g 葡萄糖于100 mL烧杯中加水溶解,定容至1 000 mL容量瓶中,即葡萄糖浓度为1.0 g/L。分别吸取0、0.2、0.4、0.6、0.8、1.0 mL的葡萄糖溶液(1.0 g/L)于具塞刻度试管中,用蒸馏水补至1 mL,向试管中加入1.0 mL苯酚工作液后快速加入5.0 mL浓硫酸,静置10 min,充分摇匀后置于30 ℃水浴中反应20 min,490 nm测量吸光度,绘制标准曲线(图1)。得到回归方程为y=4.481 6x+0.301 4(R2=0.991 7),其中y为吸光度,x为葡萄糖浓度。
1.2.2 桑黄多糖提取方法的选取及含量测定。
1.2.2.1 水浴辅助溶剂浸提法。
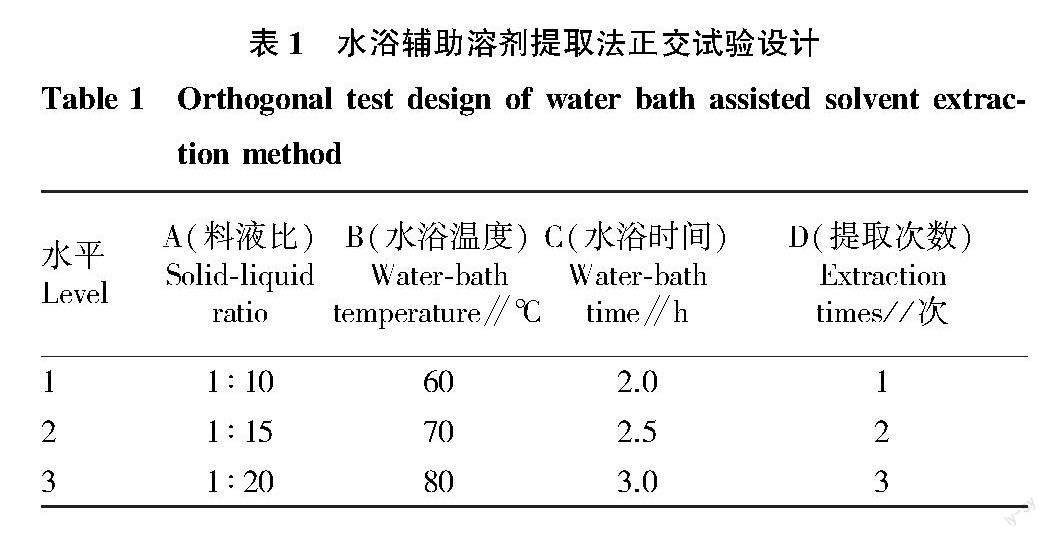
参考李瑞雪等[7]对桑黄菌丝体多糖的研究,根据其单因素试验的结果,该试验以料液比、水浴温度、水浴时间、提取次数为影响多糖提取率的主要因素,每个因素设3个水平,选用L9(34)正交试验设计(表1),每个处理3次重复。
准确称取样品10.00 g,按表1正交试验设计进行多糖提取,合并提取的滤液,加入4倍体积的无水乙醇,摇匀后3 000 r/min離心5 min,弃去上清液,将残渣于30 ℃恒温烘干。称取烘干后的残渣样0.20 g,按照“1.2.1.2”方法测定多糖含量,根据标准曲线计算结果,计算提取率。
1.2.2.2 微波辅助提取法。
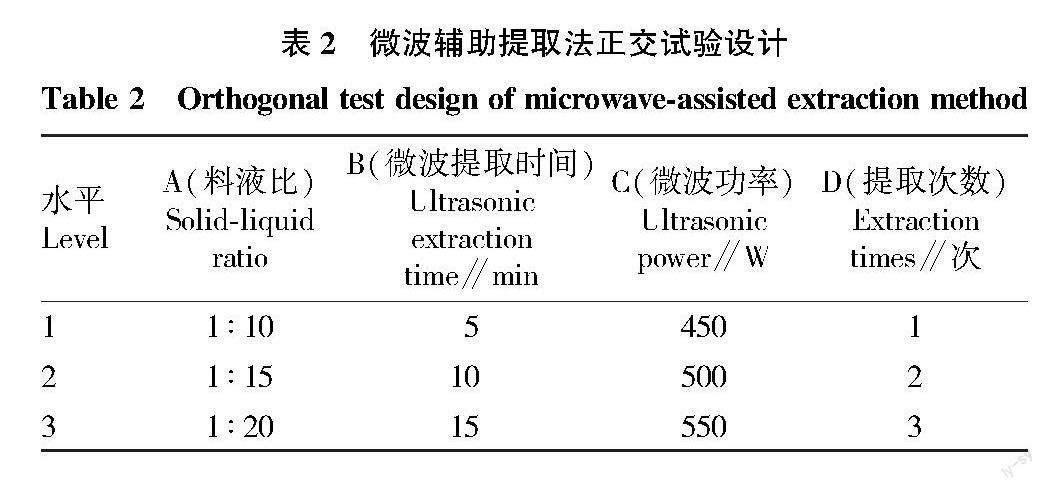
参考秦俊哲等[8]采用微波辅助提取法提取桑黄子实体多糖的研究,该试验以料液比、微波提取时间、微波功率、提取次数为影响多糖提取率的主要因素,每个因素设3个水平,选用L9(34)正交试验设计(表2),每个处理3次重复。
称取样品10.00 g,参照表2正交试验设计进行多糖提取,以下操作步骤同“1.2.2.1”。
1.2.2.3 超声波辅助酶法。
参考时东方等[9]对桑黄菌丝体粗多糖的提取方法研究和程伟等[10]对桑黄多糖超声波协同纤维素酶法提取的工艺优化研究,在其单因素试验的基础上,该试验选用L9(34)正交试验设计(表3),设定4个因素,每个因素3个水平,每个处理3次重复。
称取样品10.00 g,参照表3正交试验设计进行多糖提取,以下操作步骤同“1.2.2.1”。
1.2.3 桑黄菌丝多糖的单糖组成分析。样品由上海微谱化工技术服务有限公司采用HPLC外标法进行测试分析。
1.2.4 桑黄菌丝多糖抗氧化性分析。
取“1.2.2”中通过不同方法提取得到的桑黄菌丝多糖为供试样品,充分混匀后在料液比1∶20、提取温度80 ℃、提取时间2 h、提取2次的条件下处理桑黄菌丝多糖,然后浓缩蒸干得到桑黄菌丝多糖提取物,于-18 ℃保存备用,用于桑黄菌丝多糖的抗氧化性分析。
1.2.4.1 不同浓度桑黄菌丝多糖溶液的配制。准确称取桑黄菌丝多糖提取物1.0 g于100 mL容量瓶中定容,即得10 mg/mL 的母液,4 ℃保存。分别从母液中吸取0.05、0.10、0.15、0.20、0.25、0.50、0.75、1.00、1.25 mL于10 mL容量瓶中定容,即为浓度0.05、0.10、0.15、0.20、0.25、0.50、0.75、1.00、1.25 mg/mL 的样品待测液,现配现用。
1.2.4.2 不同浓度VC溶液的制备。准确称取VC标准品1.0 g于100 mL容量瓶中定容,即得10 mg/mL的VC标准母液,现配现用。分别吸取0.05、0.10、0.15、0.20、0.25、0.50、0.75、1.00、1.25 mL于10 mL容量瓶中定容,即为浓度0.05、0.10、0.15、0.20、0.25、0.50、0.75、1.00、1.25 mg/mL的VC标准溶液,现配现用。
1.2.4.3 羟自由基清除率测定。
取试管先加2.0 mL硫酸亚铁溶液(浓度为2 mmol/L)、2.0 mL过氧化氢溶液(浓度为6 mmol/L),摇匀后加入3.0 mL水杨酸(浓度为6 mmol/L),再充分摇匀,放于37 ℃水浴锅中反应15 min,取一支试管测量其吸光度记A0,分别向余下试管中依次加入0.6 mL样品待测液(或同浓度的VC标准液,做对比试验)和0.4 mL双蒸水,摇匀后37 ℃水浴15 min,在510 nm处测定吸光度Ab,重复3次试验,取平均值[11]。同时以2.0 mL双蒸水代替过氧化氢溶液作空白对照,记Ac。按以下公式计算羟自由基的清除率(P):
P=[1-(Ab-Ac)/A0]×100%
1.2.4.4 超氧阴离子自由基清除率测定。
配制不同浓度的桑黄菌丝多糖样品待测液,操作步骤参照“1.2.4.1”。分别吸取不同浓度待测液0.2 mL于盛有5.7 mL Tris-HCl缓冲溶液(pH=8.20,50 mmol/L)的试管中,在25 ℃水浴中静置10 min,然后加入0.1 mL邻苯三酚溶液(25 ℃,6 mmol/L),用漩涡混匀器迅速充分混匀,用酶标仪测定反应1 min时的吸光度A1,同时用双蒸水代替样品待测液作空白对照测吸光度A2,波长为325 nm[12]。用等浓度的样品待测液作参照测定吸光度A3,以扣除样品本身的颜色对结果的干扰。按以下公式计算超氧阴离子自由基的清除率(P):
P=[1-(A1-A3)/A2]×100%
1.2.4.5 还原力测定。
按照“1.2.4.1”的步骤配制不同浓度的桑黄菌丝多糖待测液,分别吸取2 mL于刻度试管中,加入2 mL 磷酸缓冲液(pH为6.6)和2 mL铁氰化钾溶液(1%),充分混匀,在50 ℃下水浴20 min,加入2 mL三氯乙酸溶液(10%),混匀后取2 mL混合液,加入2 mL去离子水和0.4 mL三氯化铁溶液(0.1%),静置10 min,在700 nm下测定吸光度Ax;用蒸馏水代替样品待测液作空白对照,测定其吸光度Ao;以质量浓度为0.25 mg/mL的VC溶液的吸光度Ay为基准,重复3次试验,取平均值[11]。按照以下公式计算还原力:
还原力=(Ax-Ao)/(Ay-Ao)×100%
2 结果与分析
2.1 不同提取方法桑黃菌丝多糖的含量比较
通过正交设计试验,分别得到不同方法提取桑黄菌丝体多糖的最佳工艺条件,在此条件下测定桑黄菌丝体的多糖得率并加以比较,结果见表4~6。
表4结果表明水浴辅助溶剂浸提法的最佳提取条件为料液比1∶15(g∶mL)、水浴温度80 ℃、水浴时间2.5 h、提取次数2次,在此条件下做重复试验,桑黄菌丝多糖得率为(5.01±0.02)%。表5结果表明微波辅助提取法的最佳提取条件为料液比1∶20、微波提取时间15 min、微波功率550 W、提取次数2次,在此条件下做重复试验,桑黄菌丝多糖得率为(5.67±0.03)%。表6结果表明超声波辅助酶法的最佳提取条件为料液比1∶20、超声波提取时间40 min、超声波功率300 W、加酶量0.15%,在此条件下做重复试验,桑黄菌丝多糖得率为(6.58±0.01)%。
2.2 被测桑黄样品菌丝多糖成分分析
通过HPLC外标法分别对单糖标准品和桑黄菌丝多糖样品进行测试分析,结果如图2所示。图2a为12种单糖标准品呈现的12个主色谱峰,图中显示出峰时间按顺序排列分别为甘露糖、氨基葡萄糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖。图2b显示测试样品中所含单糖的出峰时间,能准确地测定桑黄菌丝多糖中单糖的组成情况。
2.3 桑黄菌丝多糖抗氧化能力测定
2.3.1 桑黄菌丝多糖对羟自由基的清除率。
由图3可知,桑黄菌丝多糖对羟自由基的清除率随浓度的增加而升高,浓度在0.05~0.50 mg/mL时羟自由基清除率上升较快,之后羟自由基清除率上升速度放缓,在1.25 mg/mL时羟自由基清除率达到31.95%。相比VC对照组,VC浓度在0.75 mg/mL时羟自由基清除率达到了99.64%,而桑黄菌丝多糖的羟自由基清除率为29.33%,桑黄菌丝多糖对羟基自由基清除效果并不是很明显。
2.3.2 桑黄菌丝多糖对超氧阴离子自由基的清除率。
由图4可知,桑黄菌丝多糖对超氧阴离子的清除率都随浓度的增加而升高,但升高的速度较缓。桑黄菌丝多糖的浓度在0.05~0.25 mg/mL时超氧阴离子清除率上升较快,之后超氧阴离子清除率上升速度有所减缓,在1.25 mg/mL时超氧阴离子清除率达到32.50%,但对比VC浓度在1.25 mg/mL时的清除率(97.54%),桑黄菌丝多糖对超氧阴离子清除效果明显弱于VC。
2.3.3 桑黄菌丝多糖的还原力。
由图5可知,桑黄菌丝多糖的还原力随浓度的增加而升高。桑黄菌丝多糖的浓度在0.05~0.50和1.00~1.25 mg/mL 时还原力的上升速度较快;浓度在0.50~1.00 mg/mL时还原力上升速度放缓,在1.25 mg/mL 时桑黄菌丝多糖的还原力达到37.03%,而相比VC浓度在0.50 mg/mL时还原力为98.27%,桑黄菌丝多糖的还原力效果略弱于VC。
3 结论与讨论
3.1 不同提取方法桑黄菌丝多糖含量分析
选择合适的多糖提取方法,能充分提高多糖的得率,对活性成分的高效获得和保持有效有重要意义。多糖的提取方法有溶剂浸提法、超声波提取法、微波提取法、酶法和超临界萃取法[13]。目前,试验用得较多的是溶剂浸提法、超声波提取法和微波提取法[14]。该研究通过不同的提取方法,选择适合桑黄多糖的最佳提取方法,并测定桑黄菌丝体和菌液的多糖含量,为桑黄多糖的研究提供理论基础。
窦茜茜等[15]通过热水浸提法得到桑黄子实体多糖提取的最佳工艺条件:料液比1∶15、浸提时间8 h、浸提温度100 ℃、浸提3次,得率为3.26%。徐卫东等[16]利用响应面优化法对桑枝多糖提取条件进行研究,得到最佳提取条件:料液比1∶20、提取温度100 ℃、浸提时间2.5 h、提取2次,桑枝多糖得率为6.15%。李瑞雪等[7]在单因素试验的基础上利用多因素正交试验对桑黄菌丝体中桑黄多糖的提取条件进行研究,得到热水浸提取桑黄多糖的最佳条件:料液比1∶14、提取温度60 ℃、提取时间2.5 h、提取3次,多糖得率为4.97%。对比前人研究,该试验采用料液比1∶15、提取温度80 ℃、提取时间2.5 h、提取2次对桑黄菌丝体进行多糖提取,在此条件下桑黄菌丝多糖得率为(5.01±0.02)%。导致结果的差距可能是提取条件的不同以及桑黄品种之间多糖含量存在差异。
时东方等[9]以桑黄菌丝为原材料,确定了微波辅助提取法的最佳工艺,并通过研究表明微波辅助提取法在提取时间和提取率上优于热水浸提法。秦俊哲等[8]通过对桑黄子实体多糖提取的研究,得出提取多糖的最佳工艺条件:微波处理时间5.1 min、微波功率540 W、提取2次,得率为4.18%。对比前人研究,该试验微波辅助提取法的最佳提取条件为:料液比1∶20、微波提取时间15 min、微波功率550 W、提取次数2次,在此条件下桑黄菌丝多糖得率为(5.67±0.03)%,从试验结果得知微波辅助法在提取时间上有明显优势,且提取率较热水浸提法更优,这与时东方等[9]的观点相同。
长城等[17]通过4种方式对桑黄子实体中多糖工艺的提取进行研究,得出超声波提取法的最佳条件:超声时间25 min、液料比400∶1(mL∶g)、超声功率60 kHz。傅海庆等[18]研究得到桑黄菌丝多糖提取的最佳工艺条件:超声波功率210 W、提取时间60 min、料液比1∶50(g∶mL),提取率为12.78%。对比前人研究,该试验超声波辅助酶法的最佳提取条件为料液比1∶20、超声波提取时间40 min、超声波功率300 W、加酶量0.15%,在此条件下做重复试验,桑黄菌丝多糖得率为(6.58±0.01)%。导致结果的差距可能是提取条件的不同以及桑黄品种之间多糖含量存在差异。
3.2 桑黄样品菌丝多糖成分分析
许谦[19]以桑黄菌丝体为材料,利用硅胶薄层分析的方法分析桑黄多糖的主要组成成分,试验得出桑黄菌丝体多糖的单糖组成初步确定有D-葡萄糖、D-半乳糖、L-阿拉伯糖和D-乳糖。魏静等[20]通过对桑黄菌丝体多糖(P1B)进行结构测定,结果表明P1B為单一组分,分子量为27 365 D,主要由鼠李糖、阿拉伯糖、葡萄糖3种已知单糖和甲基-α-D-吡喃甘露糖苷一种推测成分组成的杂多糖。对比前人研究,该试验结果表明桑黄菌丝体多糖主要单糖成分有甘露糖、氨基葡萄糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,单糖成分基本一致。
3.3 桑黄菌丝多糖抗氧化能力分析
该试验结果表明桑黄菌丝多糖均有一定的抗氧化能力,但相较VC,桑黄菌丝多糖的抗氧化能力效果略弱。应瑞峰等[21]通过比较桑黄子实体与不同阶段桑黄菌丝多糖的抗氧化活性,表明桑黄菌丝体多糖活性会因不同生长期而存在差异。因此,在今后的研究中,遵循桑黄菌丝多糖的变化规律,深入研究桑黄菌丝的培育复壮,培育出活性更强的桑黄菌丝,为桑黄发展提供可靠的理论依据。
参考文献
[1]郭照辉,刘红.桑黄菌的特性及人工栽培技术[J].南方园艺,2013,24(4):54-56.
[2]荣丹,唐梦瑜,么越,等. 桑黄活性物质提取分离及药理作用研究进展[J].中国食用菌,2022,41(6):1-6.
[3]圣明明,王宏媛,冯岳琴,等.药用真菌桑黄研究进展[J].轻工科技,2016,32(12):13-15.
[4]吴声华,戴玉成.药用真菌桑黄的种类解析[J].菌物学报,2020,39(5):781-794.
[5]刘惠知,邵晨霞,吴胜莲,等.桑黄菌的药理及产品开发研究进展[J].食用菌,2013,35(5):1-3.
[6]中华人民共和国国家质量监督检验检疫总局.出口植物源食品中粗多糖的测定 苯酚-硫酸法:SN/T 4260—2015[S].北京:中国标准出版社,2016:1-4.
[7]李瑞雪,王钰婷,夏家凤,等.桑黄菌丝体中多糖提取工艺优化及其体外抗氧化活性分析[J].中国农学通报,2019,35(29):143-150.
[8]秦俊哲,任金玫,殷红.响应面法优化微波辅助提取桑黄子实体多糖的工艺研究[J].陕西科技大学学报(自然科学版),2014,32(4):89-92,96.
[9]时东方,周勇,李雪,等.桑黄菌丝体粗多糖的提取方法研究[J].菌物研究,2008,6(4):226-230,233.
[10]程伟,秦俊哲,杜军国,等.桑黄多糖超声波协同纤维素酶法提取的工艺优化[J].现代食品科技,2012,28(6):662-666.
[11]彭常安,李媛媛.葛花总黄酮的抗氧化作用研究[J].安徽师范大学学报(自然科学版),2012,35(2):163-166.
[12]王勇,庆伟霞,杨玉霞,等.分光光度法测定二氢黄酮化合物对超氧阴离子自由基的清除作用[J].化学研究,2013,24(5):441-443.
[13]张洋洋,吕国英,方立林,等.桑黄主要活性物质的提取方法及药理活性研究进展[J].食药用菌,2021,29(5):404-408.
[14]于秋菊. 桑黄多糖提取、分离、结构解析及药理作用研究进展[J].山东化工,2022,51(13):68-69,72.
[15]窦茜茜,丁建新,张东娜,等.桑黄多糖提取工艺研究[J].解放军药学学报,2007,23(6):423-426.
[16]徐卫东,王佩香,欧阳臻,等.响应曲面法优化桑枝多糖提取工艺[J].中国药房,2011,22(43):4064-4067.
[17]长城,赵俊华,于文杰,等.杨树桑黄多糖提取工艺与测定[J].化学试剂,2021,43(7):973-978.
[18]傅海庆,李吟,傅华英.超声波法提取桑黄菌丝体多糖的研究[J].中国农学通报,2012,28(36):282-286.
[19]许谦.桑黄菌丝多糖的提取及多糖成分分析[J].湖北农业科学,2014,53(18):4405-4407,4410.
[20]魏静,李金凤,丁兴红,等.桑黄菌丝体多糖的分离纯化及其结构表征[J].时珍国医国药,2017,28(3):587-590.
[21]应瑞峰,黄梅桂,王耀松,等.桑黄子实体与桑黄菌丝多糖抗氧化活性研究[J].食品研究与开发,2017,38(21):1-5.

