加减木防己汤联合塞来昔布治疗湿热型急性痛风性关节炎疗效观察*
刘震钢,王旭,张军,戴金颖,王顺意,张侨,孙佳佳
1 唐山市第二医院,河北 唐山 063000; 2 唐山市中医医院,河北 唐山 063000
痛风性关节炎是尿酸盐沉积所致的晶体相关性关节炎[1]。痛风性关节炎随时间的推移表现为急性期、间歇期、痛风石期。急性痛风性关节炎治疗的关键是控制临床症状,同时降低血尿酸,调节血清炎症因子水平,阻滞病情向慢性发展[2-4]。非甾体抗炎药是治疗急性痛风性关节炎的基本用药,非甾体抗炎药不良反应多,部分患者不能耐受,且在降低血尿酸、阻止病情复发方面疗效不佳[5]。急性痛风性关节炎属中医“历节病”“湿热痹”范畴。高尿酸血症的发生与人体水液代谢障碍密切相关。中医认为肺、脾、肾是维持水液代谢正常运行的脏腑;湿邪是人体水液代谢障碍的产物。湿邪留注人体关节,日久郁而化热,导致急性痛风性关节炎[6]。加减木防已汤出自《温病条辨》,用于治疗暑湿痹,暑湿痹即湿热痹。本研究探讨口服塞来昔布联合加减木防己汤治疗痛风性关节炎的疗效和机制,现报道如下。
1 资料与方法
1.1 临床资料将2019年2月至2020年10月唐山市中医医院门诊就诊的135例湿热型急性痛风性关节炎患者按随机数字表法分为观察组、对照1组、对照2组各45例。研究期间对照1组脱落2例(自行退出),剔除2例(数据不全);对照2组脱落1例(依从性差),剔除2例(数据不全);观察组脱落1例(治疗期间口服其他影响疗效药物),剔除1例(数据不全)。3组患者基线资料比较差异无统计学意义(P>0.05),见表1。

表1 3组患者基线资料
1.2 诊断标准
1.2.1 西医诊断标准参照《中国高尿酸血症与痛风诊疗指南(2019)》[7]制定。根据临床症状、X线检查、关节液检查确诊。
1.2.2 中医辨证标准参照《中医病证诊断疗效标准》[8]中痛风的证候分类湿热证制定。
1.3 纳入标准1)符合西医诊断标准和中医辨证标准;2)年龄30~65岁;3)签署知情同意书。
1.4 排除标准1)慢性痛风性关节炎、继发性痛风者;2)合并严重肾功能不全者;3)假性痛风、感染性关节炎、类风湿性关节炎、急性风湿性关节炎、银屑病关节炎、丹毒与蜂窝组织炎症;4)过敏体质、妊娠或哺乳期者。
1.5 脱落及剔除标准1)治疗期间口服其他影响疗效药物者;2)研究期间依从性差,不能按时服药者;3)研究期间出现严重不良事件者;4)治疗结束后电话失访者。
1.6 治疗方法
1.6.1 基础治疗饮食管理:杜绝动物内脏、海鲜饮食,忌烟酒;避免辛辣、生冷食物。饮食宜清淡、易消化为主,每日饮水2000 mL以上。情志管理:由于患者疼痛剧烈,不能自由活动,容易导致焦虑抑郁情绪,每日清晨听取自由欢快歌曲。运动管理:大部分患者由于关节疼痛不能下床活动,建议患者在床上做上肢及颈部运动。每日按摩三阴交及合谷穴10 min。睡眠管理:建议每晚11点之前睡觉,保证睡眠时间在7 h以上。
1.6.2 药物治疗对照1组口服塞来昔布胶囊(江苏恒瑞医院股份有限公司,国药准字H20193349,规格:0.2 g×10粒/盒)0.2 g,每日2次。对照2组在对照1组基础上口服四妙散(炒薏苡仕15 g,黄柏15 g,怀牛膝15 g,麸炒苍术15 g)每日1剂,由医院煎药室煎煮,每剂药煎至400 mL,分2袋装,每次1袋,每日2次。观察组在对照1组基础上口服加减木防己汤(生石膏20 g,防己18 g,生薏苡仕15 g,滑石12 g,炒杏仕10 g,桂枝10 g,通草6 g)。煎煮方法及口服方法同对照1组。3组疗程均为14天。
1.7 观察指标
1.7.1 主要疗效指标治疗前后评价患者临床症状和体征总积分(total symptom score,TSS)[9]。TSS包括关节疼痛、关节肿胀程度、触诊压痛、皮肤红晕程度、痛风石及关节畸形评分。每项评分根据症状有无及轻重,分别记0、1、2、3分。分值范围0~18分。中医证候总评分包括关节疼痛、口渴,尿黄,心烦不安,每项评分根据症状有无及轻重,分别记0、2、4分。中医证候总评分分值范围0~16分。
1.7.2 次要疗效指标 1)治疗前后分别检测血尿酸(blood uric acid,BUA)、血沉(erythrocyte sedimentation rate,ESR)、环氧合酶2(cyclooxygenase,COX-2)水平。ESR检测:抽取患者清晨空腹静脉血5 mL,抗凝后在特有试管留置。COX-2水平检测:抽取患者清晨空腹静脉血5 mL,应用双抗体一步夹心法酶联免疫吸附试验检测。2)肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素4(interleukin-4,IL-4)、IL-8、IL-18、干扰素γ(interferonγ,IFN-γ)检测:分别在治疗前后抽取患者清晨空腹静脉血5 mL,离心分离血清,采用酶联免疫吸附法检测TNF-α(批号:2018YXD015Q)、IL-1β(批号:2018YXD012P)、IL-4(批号:2018YXD013M)、IL-8(批号:2018YXD012F)、IL-18(批号:2018YXD012S)、IFN-γ(批号:2016YXD019P),试剂盒购自上海抚生生物科技有限公司。
1.7.3 安全性评价分别在治疗前后检测血、尿、便常规及肝、肾功能与心电图。记录研究期间出现与药物相关的不良反应。
1.7.4 疗效标准参照《中医病证诊断疗效标准》[8],临床治愈:TSS减少≥90%,BUA、ESR正常;显效:TSS减少70%~89%,BUA正常;有效:TSS减少30%~69%;无效:TSS减少<30%。
1.8 统计学方法采用SPSS 23.0分析数据,计量资料以±s表示,组间两两比较采用LSD-t检验;计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TSS和中医证候积分治疗后观察组TSS和中医证候积分低于对照1、2组(P<0.05),观察组与对照2组低于对照1组(P<0.05)。见表2。
表2 3组患者治疗前后TSS和中医证候积分比较(±s) 分

表2 3组患者治疗前后TSS和中医证候积分比较(±s) 分
注:1)表示与同组治疗前比较,P<0.05;2)表示与对照1组治疗后比较,P<0.05;3)表示与对照2组治疗后比较,P<0.05
中医证候积分14.37±1.58 3.08±0.041)2)3)14.27±1.53 9.12±0.921)3)14.46±1.54 0.63±0.061)2)组别观察组例数43对照1组41对照2组42时间治疗前治疗后治疗前治疗后治疗前治疗后TSS 12.89±1.41 3.80±0.391)2)3)13.06±1.43 8.15±0.861)3)12.97±1.39 6.09±0.631)2)
2.2 血清BUA、ESR及COX-2水平治疗后观察组血清BUA、ESR、COX-2低于对照1、2组(P<0.05),观察组与对照2组低于对照1组(P<0.05)。见表3。
表3 3组患者治疗前后血清BUA、ESR及COX-2水平比较(±s)
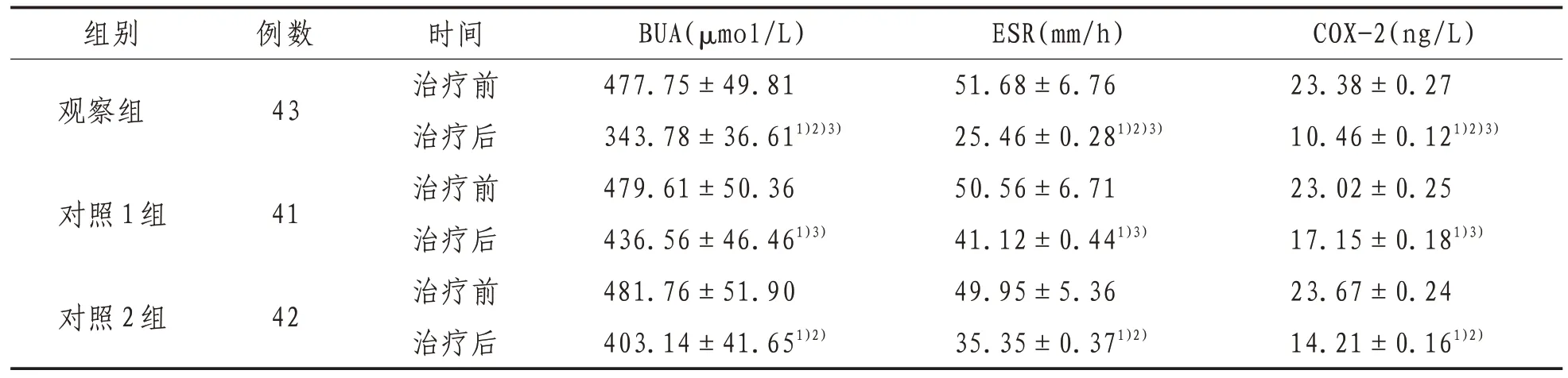
表3 3组患者治疗前后血清BUA、ESR及COX-2水平比较(±s)
注:1)表示与同组治疗前比较,P<0.05;2)表示与对照1组治疗后比较,P<0.05;3)表示与对照2组治疗后比较,P<0.05
组别观察组COX-2(ng/L)23.38±0.27 10.46±0.121)2)3)23.02±0.25 17.15±0.181)3)23.67±0.24 14.21±0.161)2)例数43对照1组41对照2组42时间治疗前治疗后治疗前治疗后治疗前治疗后BUA(μmol/L)477.75±49.81 343.78±36.611)2)3)479.61±50.36 436.56±46.461)3)481.76±51.90 403.14±41.651)2)ESR(mm/h)51.68±6.76 25.46±0.281)2)3)50.56±6.71 41.12±0.441)3)49.95±5.36 35.35±0.371)2)
2.3 血清TNF-α、lL-1β及lL-8水平治疗后观察组患者血清TNF-α、IL-1β、IL-8水平低于对照1、2组(P<0.05),观察组与对照2组低于对照1组(P<0.05)。见表4。
表4 3组患者治疗前后血清TNF-α、lL-1β、lL-8水平比较(±s)ng/L

表4 3组患者治疗前后血清TNF-α、lL-1β、lL-8水平比较(±s)ng/L
注:1)表示与同组治疗前比较,P<0.05;2)表示与对照1组治疗后比较,P<0.05;3)表示与对照2组治疗后比较,P<0.05
IL-8 81.24±9.05 38.57±4.121)2)3)79.58±8.92 78.35±8.463)79.35±8.87 51.36±6.711)2)组别观察组例数43对照1组41对照2组42时间治疗前治疗后治疗前治疗后治疗前治疗后TNF-α 61.24±6.98 33.36±3.551)2)3)59.75±6.27 57.91±5.923)59.94±5.91 41.25±5.311)2)IL-1β 51.93±6.37 28.91±2.981)2)3)49.98±5.92 48.05±5.162)3)50.57±6.24 35.95±4.151)
2.4 血清lL-4、lL-18及lFN-γ水平治疗后观察组患者血清IL-4、IL-18、IFN-γ水平高于对照1、2组(P<0.05),观察组与对照2组高于对照1组(P<0.05)。见表5。
表5 3组患者治疗前后血清lL-4、lL-18、lFN-γ水平比较(±s)ng/L

表5 3组患者治疗前后血清lL-4、lL-18、lFN-γ水平比较(±s)ng/L
注:1)表示与同组治疗前比较,P<0.05;2)表示与对照1组治疗后比较,P<0.05;3)表示与对照2组治疗后比较,P<0.05
IFN-γ 14.94±1.75 33.31±3.601)2)3)14.56±1.68 15.57±1.783)14.06±1.58 27.66±3.061)2)组别观察组例数43对照1组41对照2组42时间治疗前治疗后治疗前治疗后治疗前治疗后IL-4 11.84±1.45 23.39±2.421)2)3)12.05±1.57 12.58±1.273)11.71±1.41 17.15±1.841)2)IL-18 36.41±4.23 84.13±9.031)2)3)36.13±4.21 37.19±4.243)36.76±4.79 66.32±7.831)
2.5 临床疗效总有效率观察组为93.02%(40/43),高于对照1组的73.17%(30/41)(P<0.05)与对照2组的83.33%(35/42)(P<0.05)。见表6。

表6 3组患者临床疗效比较[n(%)]
2.6 安全性及复发率观察组3例(6.98%),对照1组2例(4.88%),对照2组2例(4.76%)出现上腹部疼痛、恶心,未行处理,4日后自行缓解,3组不良反应发生率比较差异无统计学意义(P>0.05)。治疗前后安全性指标检查未见异常变化。随访3个月,对照1组和对照2组复发率分别为31.71%(13/41)与14.29%(6/42),高于观察组的4.65%(2/43)(P<0.05)。
3 讨论
急性痛风性关节炎是由于尿酸钠结晶沉积于关节及其周围组织而导致局部炎性反应的疾病。尿酸钠结晶沉积的发生由尿酸排泄减少和生成过多导致。人体嘌呤代谢异常可导致高尿酸血症,但随着人们生活方式的转变,高嘌呤食物摄入过多是目前导致高尿酸血症的主要因素。沉积于关节滑膜的尿酸钠结晶使内皮细胞中的单核巨噬细胞黏附与渗出增加,导致吞噬尿酸钠微晶的中性粒细胞释放炎性细胞因子。病变关节的红肿热痛是关节内滑膜及其周围组织急性炎症表现,可诱发关节组织炎性反应,反复刺激关节滑膜,引起关节剧烈疼痛及关节灼热肿胀等一系列症状。
目前治疗急性痛风性关节炎的原则为有效控制临床症状的同时减少复发,恢复失衡的嘌呤代谢。现代研究显示秋水仙碱及糖皮质激素虽然可以有效控制急性痛风性关节红肿热痛症状,但其不良反应多,临床应用受限,目前较常用非甾体抗炎药[10]。塞来昔布是选择性环氧化酶抑制剂,广泛应用在关节疾病疼痛中。现代研究显示塞来昔布胶囊可缓解患者急性痛风性关节炎红肿热痛症状,缩短住院时间,相对其他非甾体抗炎药,其消化道不良反应小[11]。
中医认为急性痛风性关节的发病与湿热相关,内外湿邪是其发病的关键因素,热邪由湿郁导致,急性痛风性关节炎的发病与脾、肝、肾3脏密切相关。此三脏是维持水液代谢正常的关键,脾为水液代谢枢纽,肾为水液代谢原动力,肝为筋之本,藏血生筋,统司筋骨关节。痛风性关节炎的发生与肝失疏泄、脾失健运、肾失封藏密切相关。维持三者关系正常运转是中医治疗痛风性关节炎的关键[12]。《温病条辨》载:“暑湿痹者,加减木防己汤主之。”加减木防己汤用于治疗湿热下注导致的关节红肿热痛,疼痛难忍。防己为君药,脾为己土,己土受邪而病,此药可防,故名防己。《医学启源》载其“疗腰以下至足湿热肿盛”,明确了防已的作用部位与急性痛风性关节炎的常见发病部位一致。《长沙药解》载:“防己泄经络之湿淫……关节肿痛之症,悉易防已。”明确了防己可治疗因湿邪侵淫导致的关节肿痛,与急性痛风性关节炎的病症特点一致。现代研究显示防己中的粉防己碱可调节细胞因子,阻止白三烯和前列腺素的产生[13]。急性痛风性关节炎是湿邪阻滞三焦通路的病症,湿邪阻滞三焦,需上、中、下三焦分消走泄,湿邪才有出路。防己主要畅中焦祛湿,杏仕通上焦祛湿,薏苡仕利下焦祛湿。杏仕、薏苡仕共为臣药,辅佐君药防己利湿止痛清热。现代研究显示薏苡仕提取物可改善早期急性炎症反应,其中薏苡仕蛋白可控制促炎因子与抑炎因子分泌[14]。湿热之邪最易耗损元气,而元气耗损不能补以黄芪、人参以防助邪。更不能用黄连、黄芩清热以防精气更伤。滑石秉中土冲和,且具有流走之性,清宣上焦而利下焦,使湿热之邪从小便而出。石膏辛甘寒,质重气轻,泻热除烦。湿热之邪最易伤阴,不能用麦冬、沙参滋阴以防湿邪更盛,而用石膏泻热以存阴。滑石、石膏佐助君、臣药利湿清热止痛,同时防止君、臣药耗损元气、阴精。桂枝温通经脉,使经脉气血各自发挥其功能,并佐制寒药伤阳、凝滞经气。通草性轻浮,有通利而不伤阴之性,可使诸药透达四肢关节,为使药。现代研究显示通草治疗痹症主要发挥其利血气、祛湿、通经络的引经报使作用[15]。
塞来昔布胶囊治疗急性痛风性关节炎,虽然可改善临床症状,但其改善血尿酸及ESR水平疗效不佳。四妙散在改善痛风性关节炎方面清热力不够,未能兼顾湿热耗损阴气方面,因此临床疗效弱于加减木防已汤。
COX-2是前列腺素内氧化酶还原酶,尿酸盐结晶刺激关节滑膜的巨噬细胞、单核细胞,诱导COX-2生成。COX-2可反映炎症损伤程度,可评价药物抗炎效果。本研究显示塞来昔布胶囊可减低患者COX-2水平,而发挥止痛效果,联合应用加减木防已汤疗效优于单纯塞来昔布胶囊,优于塞来昔布胶囊联合四妙散。
关节出现无菌性炎症反应是促炎因子TNF-α、IL-1β、IL-8和抑炎因子IL-4、IL-18、IFN-γ失衡的结果[16],与中医阴阳失衡相似。TNF-α、IL-1β、IL-8均为尿酸盐微结晶刺激关节局部滑膜,由滑膜的单核细胞、巨噬细胞产生,各炎症因子在诱发炎症反应时的作用不同。TNF-α是炎症细胞介质网链中首个炎性细胞,TNF-α与IL-1β相互促发,IL-8对活化的中性与嗜碱性粒细胞具有调节作用,三者相互影响,导致滑膜急性炎症的发生。本研究结果显示,加减木防已汤联合塞来昔布可减低血清TNF-α、IL-1β、IL-8水平及提高血清IL-4、IL-18、IFN-γ水平,其改善幅度高于塞来昔布及塞来昔布联合四妙散(P<0.05)。现代研究显示加减木防已汤可改善急性痛风性关节炎关节疼痛症状,改善关节功能[17],加减木防已汤中的汉防己申素具有调节炎症因子和抑制免疫器官功能的作用,尤其对TNF-α、IL-1β、IL-6、IL-8等有抑制作用[18]。
综上所述,在口服塞来昔布胶囊的基础上口服加减木防已汤可有效改善急性痛风性关节炎患者疼痛、红肿等症状,可有效降低血尿酸、血沉及COX-2水平,在调节炎症因子方面具有优势,而且其不良反应发生率低。但目前研究样本量偏少,今后需进行多中心、大样本的研究以进一步评价加减木防已汤治疗急性痛风性关节的有效性和安全性。

