基于TGF-β1/Smads信号通路探讨大蒜素对2型糖尿病大鼠肾纤维化的影响*
白敏,李晓翠,靳世英,李慧,吴洁
邯郸市中心医院药学部,河北 邯郸 056001
高血糖所致肾纤维化是糖尿病肾病(diabetic nephropathy,DN)的主要病理机制,也是引发肾功能降低和肾脏器质性病变的重要因素之一[1-2]。因此,以抑制肾纤维化为治疗靶点对延缓DN疾病进展至关重要。转化生长因子β1(transforming growth factor-β1,TGF-β1)是一种强致纤维化因子,其下游靶分子Smads能够诱导细胞外基质表达上调,TGF-β1/Smads信号通路在组织纤维化过程中具有重要调控作用[3]。
大蒜素是天然存在于大蒜球茎中的一种具有抗炎、抗氧化等多种药理学作用的二烯丙基三硫化物[4]。其对酒精性肝纤维化、慢性肾衰所致肾纤维化、糖尿病所致心肌纤维化均具有明显抑制作用[5-8],并且能够通过调控TGF-β1/Smads信号通路减轻肺纤维化、心肌纤维化[9-10]。目前,大蒜素对2型糖尿病(type 2 diabetes mellitus,T2DM)所致肾纤维化影响的文献报道尚不多见,本研究旨在探讨大蒜素对T2DM大鼠肾纤维化的影响及其可能的作用机制,现将结果报道如下。
1 材料与方法
1.1 动物50只健康清洁级雄性SD大鼠,7周龄,体质量(230±20)g,购于河北省实验动物中心,动物生产许可证号:SYXK(冀)2018-004,清洁环境饲养1周后开展实验,饲养条件:室温25 ℃,相对湿度(60±5)%,保持12 h光暗循环照明,自由饮食饮水。本实验经医院伦理委员会审查批准[HDZXLL(K)字2020017]。
1.2 药物与试剂大蒜素注射液(徐州莱恩药业有限公司,批号:20200316,规格:2 mL∶30 mg);链脲佐菌素(streptozotocin,STZ,美国Sigma公司,批号:024K1031);24小时尿蛋白(24 hour urine protein,24h UP)、血清尿素氮(blood urea nitrogen,BUN)、肌酐(serum creatinine,SCr)检测试剂盒(深圳迈瑞生物医疗电子股份有限公司,批号分别为:202004012、202005023、202003021);Masson染色试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒(北京索莱宝科技有限公司,批号分别为:G1340、DA1010);TGF-β1、磷酸化Smad2(phospho-Smad2,p-Smad2)、磷酸化Smad3(phospho-Smad3,p-Smad3)、I型胶原蛋白(collagen I,ColI)、Ⅲ型胶原蛋白(collagen Ⅲ,Col Ⅲ)抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗购自北京博奥森生物科技有限公司(批号分别为bs-0086R、bs-2224R、bs-5235R、bs-10423R、bs-0948R、bs-0294P-HRP)。
1.3 主要仪器JPS-5型血糖仪(北京怡成生物电子技术股份有限公司);7600型全自动生化分析仪(日本HITACHI公司);UF-1000i型全自动尿液分析仪(日本希森美康公司);RM2245型石蜡切片机(德国Leica公司);AU640型全自动生化分析仪、CX31型光学显微镜(日本Olympus公司)。
1.4 实验方法
1.4.1 动物分组、模型制备与给药将50只雄性SD大鼠数字编码后按随机数字表法分为正常对照组、模型组和大蒜素低、中、高剂量组,每组10只。
1.4.2 模型制备与给药正常对照组给予常规饲料喂养;其余各组大鼠给予高糖高脂饲料喂养4周后腹腔注射质量浓度为1%的STZ(30 mg/kg),造模成功标准[11]:72 h后检测大鼠空腹血糖≥16.7 mmol/L,尿糖+++或尿糖++++。大蒜素低、中、高剂量组分别腹腔注射质量浓度为1、2、4 mg/mL的大蒜素溶液,正常对照组和模型组腹腔注射生理盐水,各组注射剂量均为5 mL/kg,共干预4周。
1.5 检测指标
1.5.1 空腹血糖水平与体质量检测各组大鼠于末次给药24 h后称量体质量;经尾静脉采空腹血,通过血糖仪测定血糖水平。
1.5.2 肾功能指标检测末次给药后,收集24 h尿液,离心半径10 cm,2000 r/min离心10 min,取上清液,采用磺基水杨酸法测定24h UP;末次给药24 h后经腹主动脉取血,离心半径10 cm,3500 r/min离心10 min,取血清,通过全自动生化分析仪测定血清BUN、SCr含量。
1.5.3 肾组织病理学及纤维化检查、胶原容积分数(collagen volume fraction,CVF)计算脊椎脱臼处死大鼠,取双侧肾组织。左侧肾脏置于10%中性申醛溶液固定72 h,梯度乙醇脱水、二申苯透明、石蜡包埋、4 μm厚度切片后,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色后观察肾组织病理学改变和纤维化状况;Masson染色观察肾组织纤维化状况,蓝色为胶原着色。通过图像分析系统计算CVF,CVF(%)=(胶原面积/视野总面积)×100%。
1.5.4 肾组织蛋白表达检测取右侧肾组织石蜡切片,依次经脱蜡水化、双氧水灭活过氧化氢酶、乙二胺四乙酸修复抗原、山羊血清室温封闭处理后,加一抗TGF-β1(1∶200)、p-Smad2(1∶200)、p-Smad3(1∶200)、ColI(1∶200)、Col Ⅲ(1∶200)4 ℃孵育过夜,PBS冲洗后加HRP标记二抗室温孵育30 min,PBS冲洗后DAB显色,苏木素复染2 min,盐酸乙醇分化后冲洗,脱水、透明处理后中性树胶封片,显微镜下观察(棕褐色为阳性着色),应用Image J软件分析视野内积分吸光度(integral absorbance,IA)和面积,以IA/面积作为目标蛋白表达的半定量结果。
1.6 统计学方法采用SPSS 13.0统计软件分析数据,计量资料以±s表示,使用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 T2DM大鼠空腹血糖水平和体质量变化情况模型组大鼠空腹血糖水平较正常对照组升高(P<0.01),体质量较正常对照组降低(P<0.01);与模型组相比,大蒜素中、高剂量组大鼠空腹血糖水平降低且体质量升高(P<0.05)。见表1。
表1 各组大鼠空腹血糖水平和体质量比较(±s)
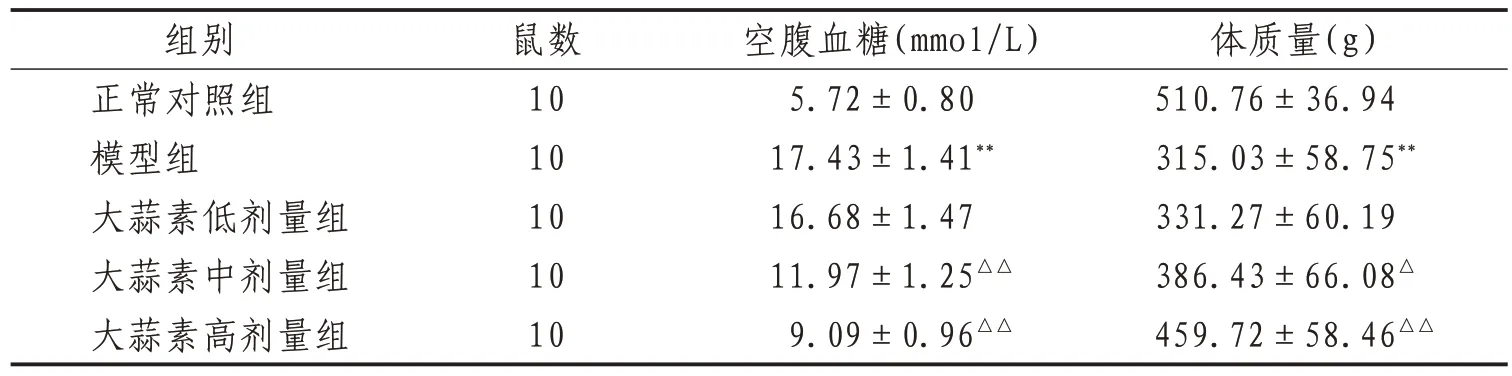
表1 各组大鼠空腹血糖水平和体质量比较(±s)
注:与正常对照组比较,**表示P<0.01;与模型组比较,△表示P<0.05,△△表示P<0.01
体质量(g)510.76±36.94 315.03±58.75**331.27±60.19 386.43±66.08△459.72±58.46△△组别正常对照组模型组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组鼠数10 10 10 10 10空腹血糖(mmol/L)5.72±0.80 17.43±1.41**16.68±1.47 11.97±1.25△△9.09±0.96△△
2.2 T2DM大鼠肾功能变化情况模型组大鼠24h UP和血清BUN、SCr含量较正常对照组升高(P<0.01);与模型组相比,大蒜素中、高剂量组大鼠24h UP和血清BUN、SCr含量降低(P<0.01)。见表2。
表2 各组大鼠24h UP和血清BUN、SCr含量(±s)

表2 各组大鼠24h UP和血清BUN、SCr含量(±s)
注:与正常对照组比较,**表示P<0.01;与模型组比较,△△表示P<0.01
SCr(umol/L)25.96±3.42 52.23±5.79**47.30±5.65 41.02±4.69△△34.67±3.78△△组别正常对照组模型组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组鼠数10 10 10 10 10 24h UP(mg/24h)9.61±1.30 24.89±3.92**22.65±4.08 16.97±3.39△△12.20±2.81△△BUN(mmol/L)5.40±0.97 20.86±3.21**19.45±3.18 14.63±3.01△△9.68±1.92△△
2.3 T2DM大鼠肾组织病变情况正常对照组大鼠肾组织切片着色均匀,形态结构未见异常;模型组大鼠肾组织可见肾小球增大、系膜基质增厚、肾小管上皮细胞空泡变性、炎性细胞浸润等病理学改变;大蒜素低剂量组大鼠肾组织病变与模型组相似,大蒜素中、高剂量组大鼠肾组织病变可见不同程度改善,其中大蒜素高剂量组可见肾小球轻度增大、少量炎性细胞浸润,其效果优于其他组。见图1。

图1 各组大鼠肾组织病理学变化(HE,×400)
2.4 T2DM大鼠肾纤维化情况正常对照组大鼠肾小球和肾间质可见少量胶原;模型组肾组织胶原量较正常对照组明显增多,肾小球和肾间质区胶原呈弥漫性分布;与模型组相比,大蒜素低、中、高剂量组大鼠肾小球和肾间质区胶原呈不同程度减少,以大蒜素高剂量组效果最为显著。CVF计算结果:模型组大鼠肾组织CVF较正常对照组升高(P<0.01);与模型组相比,大蒜素低、中、高剂量组大鼠肾组织CVF降低(P<0.01)。见图2、表3。

图2 各组大鼠肾组织纤维化情况(Masson,×400)
表3 各组大鼠肾组织CVF值(±s)%

表3 各组大鼠肾组织CVF值(±s)%
注:与正常对照组比较,**表示P<0.01;与模型组比较,△△表示P<0.01
CVF 11.98±1.86 67.25±7.48**49.73±6.31△△38.04±4.97△△16.85±2.91△△组别正常对照组模型组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组鼠数10 10 10 10 10
2.5 T2DM大鼠肾组织TGF-β1、p-Smad2、p-Smad3蛋白表达模型组大鼠肾组织TGF-β1、p-Smad2、p-Smad3蛋白表达较正常对照组显著上调(P<0.01);与模型组相比,大蒜素中、高剂量组TGF-β1、p-Smad2、p-Smad3蛋白表达显著下调(P<0.01)。见表4、图3。

图3 各组大鼠肾组织TGF-β1、p-Smad2、p-Smad3蛋白表达(IHC,×400)
表4 各组大鼠肾组织TGF-β1、p-Smad2、p-Smad3、ColI、Col Ⅲ蛋白表达(±s)
注:与正常对照组比较,**表示P<0.01;与模型组比较,△△表示P<0.01
组别正常对照组模型组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组Col Ⅲ0.038±0.007 0.152±0.023**0.146±0.022 0.124±0.017△△0.101±0.015△△鼠数10 10 10 10 10 TGF-β1 0.049±0.006 0.175±0.027**0.151±0.024 0.127±0.018△△0.086±0.013△△p-Smad2 0.073±0.010 0.182±0.029**0.156±0.024 0.114±0.015△△0.080±0.011△△p-Smad3 0.055±0.007 0.127±0.021**0.118±0.019 0.101±0.014△△0.089±0.012△△Col I 0.031±0.005 0.206±0.032**0.179±0.028 0.143±0.021△△0.092±0.014△△
2.6 T2DM大鼠肾组织ColI、ColⅢ蛋白表达模型组大鼠肾组织ColI、Col Ⅲ蛋白表达较正常对照组上调(P<0.01);与模型组相比,大蒜素中、高剂量组ColI、Col Ⅲ蛋白表达下调(P<0.01)。见表4、图4。
3 讨论
糖尿病是一种具有高发病率的慢性代谢性疾病,DN约占糖尿病患者的30%~50%,DN发病隐匿,多数患者确诊时已处于终末期肾病[12-13]。DN早期即可见肾小球和肾间质进行性纤维化,是导致肾功能持续恶化的关键因素[14]。因此,抑制肾组织纤维化是延缓DN疾病进展的关键。
T2DM属中医“消渴”范畴,其病机为气阴两虚、脾肾阳虚、瘀血浊毒内停[15-16]。大蒜素是大蒜球茎的活性成分,目前临床上主要用于深部真菌和细菌感染的治疗,药理学研究发现大蒜素具有良好的抗纤维化作用[5-7]。本研究发现,大蒜素治疗4周能够明显降低T2DM大鼠空腹血糖水平、提高体质量,改善肾功能指标(降低24h UP水平和血清BUN、SCr含量),并改善T2DM大鼠肾组织病变和肾组织纤维化。
TGF-β1是一种纤维化诱导因子,能够通过调控细胞外基质相关基因转录表达而加速组织纤维化。Smads为TGF-β1下游靶分子,被TGF-β1诱导磷酸化(p-Smads)后能够诱导细胞外基质生成增多。黄秀等[17]研究发现TGF-β1/Smads信号通路在肾纤维化过程中发挥着关键作用。本研究发现,大蒜素治疗4周能够显著下调DM大鼠肾组织TGF-β1、p-Smad2、p-Smad3和Col I、Col Ⅲ蛋白表达。
综上所述,大蒜素对T2DM大鼠肾组织纤维化具有抑制作用,其机制可能与调控TGF-β/Smad信号通路,进而抑制细胞外基质生成有关。

