药品生产企业偏差管理的现状分析与对策
胡俊 李茜 王凌 俞娟 聂希霖 胡菁
人用药品注册技术要求国际协调会(International conference on harmonization of technical requirements for registration of pharmaceuticals for human use,ICH)Q7 首次给出了偏差的定义,它指偏离已批准的指令或规定标准[1]。我国《药品生产质量管理规范》(2010年修订)[2]第十章第二百五十条第五节虽然没有给出偏差的具体定义,但也给出了相关的阐释,即“任何偏差生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录”。偏差管理在药品全生命周期质量管理过程中是不可或缺的重要内容,它是一种发现问题、分析问题、解决问题并促进质量体系持续改进的强有力手段;同时也是药品生产企业质量体系要素执行的难点。国内外药政监管机构均对药品生产企业建立偏差管理程序和标准有相应的要求,进行现场检查时也会重点关注企业偏差的识别上报、调查评估以及纠正和预防措施的制订和实施跟踪等情况[3]。文章总结分析药品生产企业偏差管理存在的现状和问题,分析问题产生的根本原因,并提出相应的对策,以期为药品生产企业的偏差管理工作提供参考,同时也为药品监管检查工作中对偏差管理的高效检查提供借鉴。
1 偏差管理存在的问题与分析
1.1 偏差识别与上报流程存在逻辑问题,偏差描述不符合要求
企业人员发现偏差时,应立即通过口头或电话方等方式报告给相应的负责人及质量保证部门,并采取应急处理措施。偏差上报时需记录发生的时间、地点、人员、工序/过程、偏离的标准以及相应的紧急处理措施,这些信息首先应客观准确地记载在相应的生产记录中,再根据企业制订的偏差管理程序发起偏差处理流程。在实践过程中,可能因为企业人员对偏差识别和上报的流程理解不充分、培训不足,导致偏差上报与处理存在逻辑问题,如在批生产记录中对相应偏差的描述过于简单,未记载偏差发生的具体内容,仅描述为“详情见偏差报告”,忽视了生产记录与偏差报告内容的先后逻辑关系问题。
1.2 偏差调查评估不够充分,导致未识别根本原因
企业开展偏差调查时若较少使用有效的偏差调查工具,在处理过程中常以时间轴作为主线,仅以“流水账”的方式进行回顾性描述,缺乏有效的调查过程,会导致支持调查结论的数据不充分或不合理。如发生一次性储液袋破损漏液的偏差,对导致漏液的原因分析不够充分,识别的可能原因为转运过程中发生碰撞事件导致袋体破损漏液,但相应的调查证据不足,没有进行确证性研究等。
根据《药品GMP 指南》[4]推荐的做法,企业应使用质量风险管理工具开展偏差根源调查[5-7]。常见根源分析工具包含头脑风暴法、故障树分析法、鱼骨图分析法、5 Why法等。较少使用或没有选择适宜的调查工具时,可能导致调查评估不充分,表现为调查不深入,未对导致偏差现象产生的各种可能相关因素进行调查。如世界卫生组织(World Health Organization,WHO)对我国某生物制品生产企业进行现场检查,查看1 例因溶氧含量异常造成产品不合格的偏差记录,企业分析偏差发生的直接原因为溶氧电极故障导致溶氧含量低于标准,但未确定根本原因,也未评估影响,没有对过往涉及生产批次的影响进行充分评估。
偏差调查评估不充分通常关联纠正和预防措施不完善等审计缺陷,采取纠正措施目的是消除不合格的原因,采取预防措施目的是为消除潜在不合格或其他潜在风险,应对缺陷时考虑对关联偏差进行全面充分的调查,确定根本原因并制订适宜的纠正和预防措施,这不仅是减少审计缺陷的重要技巧,也是企业防止重复偏差发生的有力手段[8]。
1.3 偏差涉及产品/物料的质量,影响评估不充分
《药品生产质量管理规范》[2]明确指示任何偏差都应当评估其对产品或物料质量的潜在影响。偏差处理程序中,除调查根本原因外,另一个着重点在于对涉及产品/物料质量的影响性评估。确认偏差的根本原因后,基于已收集的相关证据材料,需对偏差的影响范围和严重程度做出评估,偏差调查过程中汇总分析的相关数据用于支撑偏差评估的结论。评估需考虑经调查确认直接涉及偏差的产品/物料的质量影响和其他批次产品/物料的质量影响(如前后生产批次或已放行或已上市销售批次的影响)。必要时需进行文献查阅和实验研究,或结合已开展的相关验证,采纳其数据或结论,来确认对产品/物料的质量影响。通常可结合额外检验和稳定性考察进一步确证对涉及产品质量的影响。《药品生产质量管理规范》[2]明确指示对于重大偏差,其评估还应着重考虑是否需对涉及产品进行额外检验,如果对涉及产品效期有影响,还需进行长期稳定性考察。
企业通常只对调查结果的影响进行简要分析,风险评估结论的说服力不够,或将调查结论与影响性评估混为一谈。偏差的评估流于表面化、形式化,较少评估对质量管理体系的影响,如对验证状态的影响、对注册文件的影响、对质量协议和其他已批准程序的影响。《药品GMP 指南》[4]中明确指示,调查偏差的根本原因和进行偏差的影响性评估均可选择风险分析方法,因此导致影响性评估不具体、不深入、不系统的根源还是在于质量风险管理工具运用不够。
2 偏差管理提升的对策
2.1 通过完善培训体系以及组建主题专家团队开展偏差根本原因调查
通过质量大讲堂、质量月活动以及建立企业内各层级偏差处理培训等机制,持续提升企业人员识别偏差、准确描述偏差的能力,这不仅是良好偏差管理的基础,也是科学分析偏差原因的前提。
识别偏差产生的根本原因是偏差处理中最重要的环节,充分彻底的调查是进行系统性影响评估和制订适宜有效的纠正和预防措施的基础。为了提高偏差调查的科学性,应组建跨职能主题专家团队并使用有效的分析工具进行根本原因调查。主题专家团队通常由企业里具备相应资质和能力的各领域负责人组成,必要时可需求企业外部资源的支持。
企业跨职能主题专家团队运用鱼骨图分析、故障树分析等方法开展偏差处理,取得了良好效果。问题产生的特性通常受到多种可能因素的影响,将这些可能因素采用关联性整理而成层次分明、条理清晰的形式,类似于“鱼骨”,鱼骨图分析法是发现问题根本原因的分析方法,其简洁实用、直观精炼,有利于全面分析探讨问题产生的根源。如使用鱼骨图法对投诉类偏差(产品使用过程中发现单支预灌封注射剂破损)进行调查,从该批次产品生产、储运及发运等多方面展开分析。见图1。列出所有潜在的影响因素并逐一展开调查,最终分析得出不排除该支注射剂在使用过程中由于碰撞或其他误操作导致破损的可能性,对客户进行回复后满意。
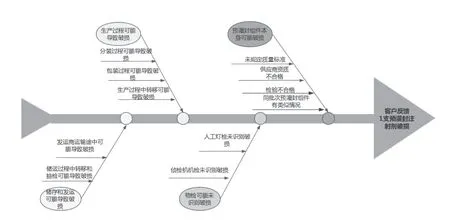
图1 鱼骨图法分析单支预灌封注射剂破损的原因
故障树采用由上往下的演绎式失效分析,用来查找系统失效的原因,并且探求合理方式降低风险,在化工制药等高风险企业应用广泛。疫苗作为一种特殊药品,其生产、贮存及运输等环节均对冷链有特殊要求[9]。某疫苗生产企业对2~8 ℃冷库超温的偏差采用故障树分析法展开调查。见图2。主题专家对该冷库现场超温故障进行检修,结合该冷库维护维修情况的历史回顾数据,并对该冷库近期运行的状况进行趋势分析,认为该偏差是由冷库制冷机组偶发故障引起的制冷系统异常,从而导致冷库温度超标。
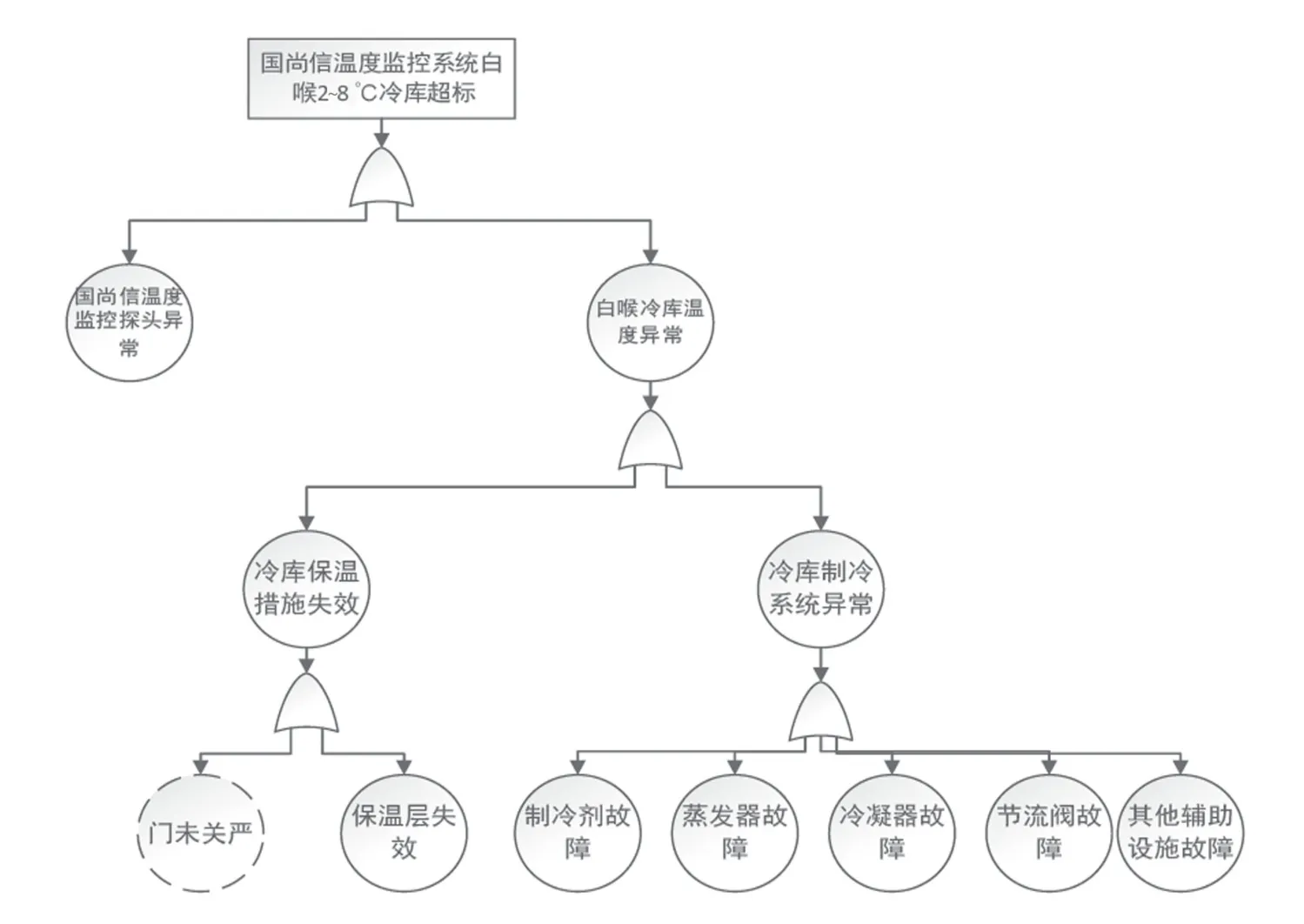
图2 故障树分析法调查2 ~8 ℃冷库超温的原因
对上述偏差调查的实例进行总结,得出只有采用有效的调查工具,才能深入挖掘导致偏差发生的各种可能相关因素,从而找出导致偏差发生的根本原因。
2.2 通过根本原因分析工具和思维导图工具挖掘人员行为差错偏差根源
人员行为差错表现为计划开展的活动偏离预期的目标,或操作超出工艺流程要求范围,或要求进行的活动出现缺失等情况。当偏差原因被初步判断为是人员行为差错所造成时,应对相关管理流程、设备、系统等方面可能存在的设计缺陷及漏洞进一步确认,以确保潜在风险未被忽视[10]。人为错误往往并非孤立事件,更可能源于体系管理上的缺陷或漏洞,若通过深入调查,可能会被识别为设备管理、工艺流程、操作程序或管理系统等根源类设计不足。应重点调查这类人员行为差错偏差的根源,简单判断为“人员行为差错”并不可取,不利于质量体系自我纠错和持续改进。
ISPE-PDA《Guide to Improving Quality Culture in Pharmaceutical Manufacturing Facilities》[11]指南中关于人为错误引发的偏差,推荐了具有指导意义的根源分析工具和方法。见表1。
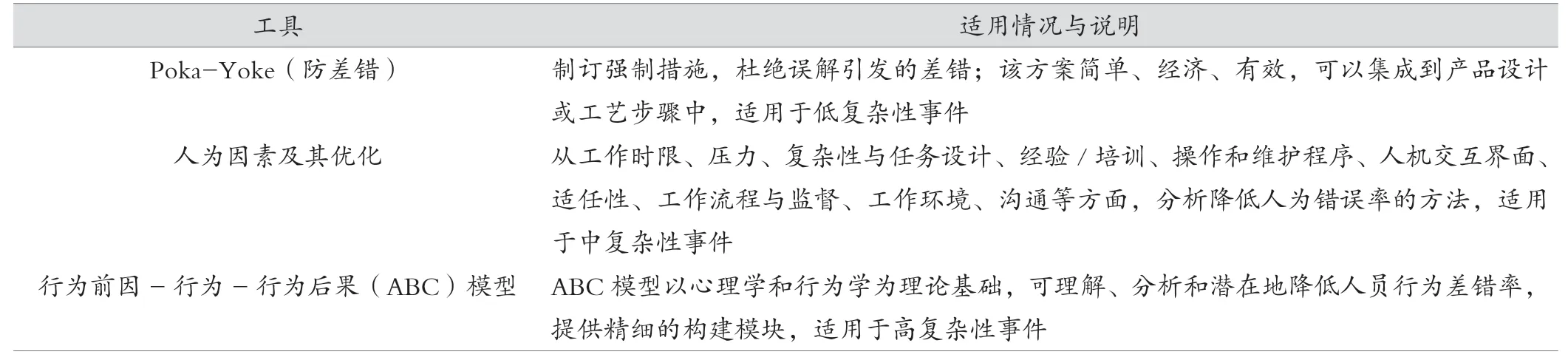
表1 人员行为差错分析方法
除上述工具外,还可以采用思维导图工具对导致人员/行为类错误进行分析。见图3。
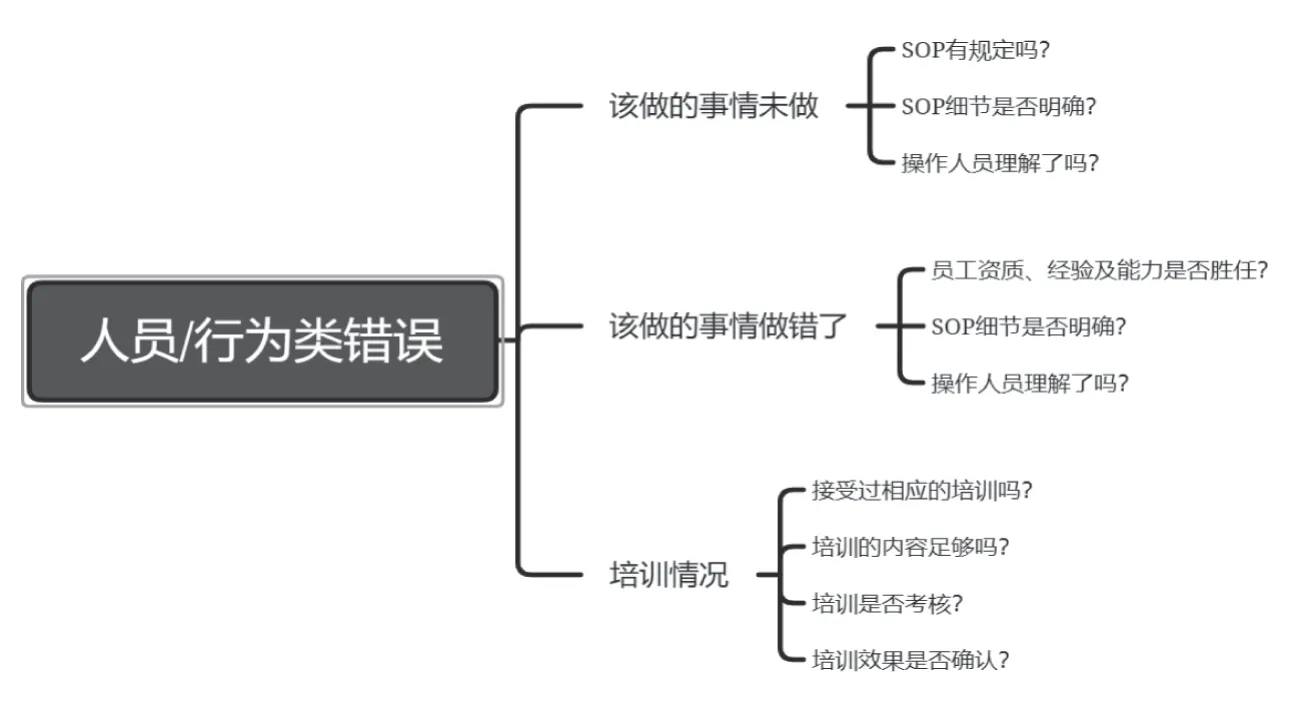
图3 思维导图对导致人为错误的根本原因进行调查
影响人为差错的因素包括但不限于标准作业流程规定不清晰、岗位职责不清晰、培训不全面或未确认培训效果、人员资质和能力与工作内容不匹配、人机交互环境布局设计不合理及工作监管、管理层级保障不够等。只有基于根本原因分析结果制订有效的纠正和预防措施,才能从根本上减少体系管理上的漏洞进而降低人员行为差错的发生率。
2.3 运用质量风险管理工具系统科学开展偏差影响性评估
针对偏差调查所识别出的风险点,推荐使用失效模式与影响分析(failure mode and effects analysis,FMEA)工具进行分析。结合相关文献,在防止差错方面采用行动优先级(action priority,AP)值的高、中、低水平对行动优先级进行确认[12]。在评估系统性方面,既要考量涉及产品/物料质量,还需评估对质量体系的影响。在与产品/物料放行关联性方面,放行前应确认相关偏差的处理情况。
近年来,WHO 对国内药品生产企业开展过的现场检查缺陷中,“质量控制与质量保证”部分所列问题较多,尤以“偏差管理与纠正措施和预防措施(corrective action and preventive action,CAPA)”问题相对集中,表现为“偏差及CAPA 管理文件规定不完善,偏差识别上报能力不足,偏差调查评估不充分、分级不合理,CAPA 措施不合理、未跟踪执行情况,台账记录不合理”等[13-14]。偏差重复发生率、偏差调查按时完成率以及CAPA 有效率均可以作为体现药品生产企业质量管理水平的重要指标,企业管理层应重视偏差管理工作,支持建立良好的偏差管理程序并保证偏差管理体系规范运行,这不仅是顺应药品监管的要求,也是企业提高自身质量管理水平,体现控制药品质量安全能力的有力手段。

