904L不锈钢在含Cl-和F-溶液中的耐蚀性能研究
向 攀,杨 飞,唐小英,李仁刚,罗 宏,3
(1.四川轻化工大学材料科学与工程学院,四川 自贡 643000;2.四川大西洋焊接材料股份有限公司,四川 自贡 643000;3.材料腐蚀与防护四川省重点实验室,四川 自贡 643000)
引言
904L 不锈钢因其具有低含碳量以及高镍和高铬含量而比普通不锈钢更具耐蚀性,因而在化工、排污、管道等领域广泛应用[1-3]。但在不同的工作环境中,尤其是在含有侵蚀性阴离子的介质中(Cl-、),不锈钢同样会遭到腐蚀[4-5]。研究表明,不锈钢的点蚀与溶液中卤离子的种类和浓度密切相关,至于卤离子种类对点蚀的影响,目前认为存在Cl->Br->I-的顺序[6],而这也在Tzaneva 等[7]研究中得到了印证。此外,在脱硫处理、污水排放等行业中,904L 奥氏体不锈钢所接触的除了Cl-外还可能同时含有F-介质[8-10]。Zou 等[11]通过实验发现Cl-优先与不锈钢中的Cu 原子发生反应,钝化膜中Cr和Ni的含量较高,而F-与形成钝化膜的含氧粒子吸附竞争并参与钝化膜的组成,导致钝化膜中Cr和Ni的含量降低,耐点蚀性能下降。
本文通过研究904L 不锈钢在不同温度、不同Cl-浓度和F-浓度的溶液中的腐蚀行为,分析904L不锈钢在Cl-和F-中的腐蚀机制。
1 实验方法
实验材料为904L 不锈钢,其化学组成与含量见表1。

表1 904L不锈钢化学组成与含量 wt%
904L 不锈钢试样尺寸为10 mm×10 mm ×2 mm,使用600#、800#、1200#、1500#、2000#金相砂纸依次打磨、抛光至镜面,并经去离子水清洗、丙酮除油、无水乙醇清洗后风干,工作电极面积为1 cm2,实验条件是常温、常压、未除氧。
试验设计3 个因素,即Cl-浓度、F-浓度和温度。每个因素包含3 个水平值,选择点蚀电位Eb为试验指标,分析上述3因素对904L不锈钢耐蚀性的影响。根据国标GB/T 17899—1999 规定,以阳极极化曲线上电流密度为100 μA/cm2时对应的最正电位来表示点蚀电位[12]。测试选用三电极体系,工作电极(WE)为待测904L不锈钢试样;参比电极(RE)为饱和甘汞电极(SCE),辅助电极(CE)为铂电极。EIS 测试完成时,等待一段时间待试样表面稳定后进行动态极化曲线的测试。EIS数据使用Zview软件拟合处理。
在动电位极化曲线测试完成后,清洗试样,利用ZEISS Gemini1 扫描电镜(SEM)观察904L 不锈钢的腐蚀形貌,用Buker D2 PHASE X-射线衍射仪(XRD)分析样品的产物组成。
2 结果与讨论
2.1 不同影响因素结果分析
不同因素影响因子的测试结果见表2,即Cl-浓度、F-浓度和温度,每个因素包含3 个水平值,最后取其平均值作为点蚀电位,考察上述3 个因素对904L不锈钢耐蚀性的影响。
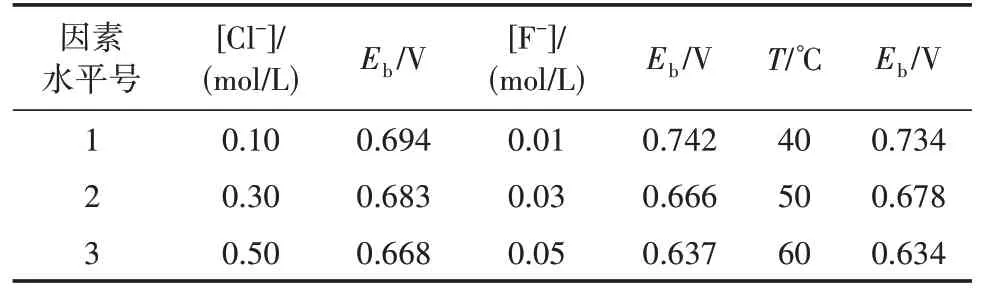
表2 不同因素影响因子的测试结果
不同影响因子点蚀电位Eb随水平变化的趋势如图1所示,由图可知,F-浓度的增大和温度的提高会明显降低904L 不锈钢的耐点蚀性能,而Cl-浓度的增大对904L不锈钢耐点蚀性能的影响相对较小。

图1 各因子Eb随水平变化趋势
一般认为不锈钢的钝化膜组分是Fe、Cr和Ni元素的氧化物及氢氧化物,研究表明[13],F-倾向于与904L 不锈钢中Ni 原子结合形成NiF2,而Cl-则会选择性溶解904L 不锈钢中Cu 原子。因此,F-的存在使得形成钝化膜的有益元素减少,而有限的Cl-在消耗完Cu 原子之前不会导致这种结果。同时NiF2为致密性较差沉淀层,沉淀层内部具有类似网状的结构,与Cr2O3、NiO 混合组成钝化膜,由于NiF2呈现不溶性且致密性较差,所以NiF2既阻碍了钝化膜的再次生成,又不具备保护性,因而904L 不锈钢在F-中的耐蚀性较差。相比之下,Cl-与Cu原子作用生成可溶性Cu2+而溶解于溶液中,所以并不妨碍钝化膜的再次生成,因而出现了上述Cl-水平改变但904L不锈钢的耐蚀性几乎不受影响的结果[14]。另外,绝大多数化学反应或者电化学反应都会随着温度的升高而加剧,且不锈钢的点蚀本质上也是电化学反应。因此,温度升高会加剧904L不锈钢在溶液中的腐蚀。
由于Cl-浓度改变对904L 不锈钢的耐蚀性没有产生太大的影响,温度对于电化学反应总是呈现促进作用,因此后文主要分析904L不锈钢在不同F-浓度溶液中的腐蚀影响。为减小Cl-对实验的影响,均在最低实验浓度0.10 mol/L Cl-浓度下进行实验;为减小温度对实验的影响,实验温度为室温(25 ℃)。
2.2 电化学阻抗分析
在开路电位下测得了904L不锈钢在含0.10 mol/L Cl-的不同浓度F-溶液中的电化学阻抗谱,并用等效电路对其进行拟合(图2)。其中Rs代表溶液电阻,Rp代表极化电阻。904L 不锈钢在含有0.10 mol/L Cl-的5种不同浓度F-中的Nyquist图如图3所示。

图2 电化学阻抗谱对应的等效电路
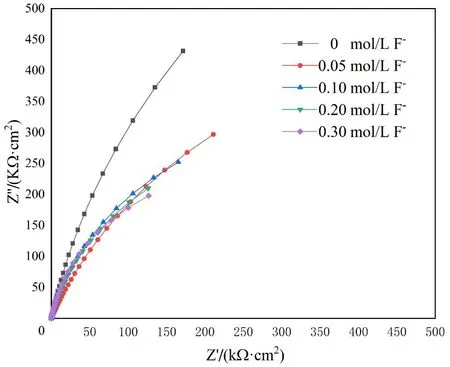
图3 904L不锈钢在含0.1 mol/L Cl-的不同浓度F-下的Nyquist图
由图3 可知,当F-浓度在0.10~0.30 mol/L 之间变化时,904L 不锈钢在0.10 mol/L Cl-中的容抗弧半径总体上呈现减小的趋势,耐蚀性变差。然而,相比于未加F-时,当F-浓度为0.05 mol/L 时的容抗弧半径出现大幅度减小现象,说明F-加入使得电化学过程的电荷转移加快。
904L不锈钢在含0.10 mol/L Cl-的5种不同浓度F-下的电化学阻抗谱拟合参数见表3。比较表3 中实验数据可知,随着F-浓度上升,极化电阻Rp呈下降的趋势,这是因为随着F-浓度上升,F-在试样表面富集,导致钝化膜的电导率增加,膜的生成与溶解平衡被打破,反应加剧[11]。此外,由于F-和Cl-的电负性相同,随着F-的加入,原本吸附在不锈钢表面的Cl-因为排斥作用导致局部集中而浓度升高,Cl-对钝化膜的击穿加强,因而点蚀作用进一步加强[15]。值得注意的是,当F-浓度从0 增加至0.05 mol/L 时,极化电阻Rp从2233 kΩ·cm2下降到1246 kΩ·cm2,下降比率为44.2%。这表明随着F-的加入,904L 不锈钢在0.10 mol/L Cl-溶液中的耐蚀性大幅下降;随着F-浓度的增大(从0.05 mol/L 增加至0.30 mol/L),极化电阻Rp从1246 kΩ·cm2下降至559 kΩ·cm2,下降比率为55.1%。另外,随着F-浓度的进一步升高,极化电阻Rp的下降比率减小,904L不锈钢在0.10 mol/L Cl-溶液中的腐蚀变缓。

表3 电化学阻抗谱参数
2.3 动电位极化分析
图4所示为904L不锈钢在含0.10 mol/L Cl-的不同浓度F-溶液中的动电位极化曲线。
图4 904L不锈钢在含0.1 mol/L Cl-的不同浓度F-下的动电位极化曲线
由图4 可知,当外加电位从-0.3 V 左右变化到+0.2 V 左右时,904L 不锈钢的阳极电流密度迅速增加,代表904L不锈钢的腐蚀进入活化区。这是因为阳极极化作用加速了904L 不锈钢的溶解[16]。在电位为(+0.2~+0.6) V 的范围内,阳极电流密度出现上升缓慢甚至下降的现象。此时,904L 不锈钢的腐蚀从活化区进入钝化区。这是因为904L 不锈钢的组成元素含有较高的Ni 和Cr,随着电极电位的正移,Ni和Cr逐渐被氧化为Ni2+和Cr3+并与溶液中的含氧粒子结合形成钝化膜。然而,钝化区的宽度较窄,且钝化电流密度在不断变化。这是由于溶液中存在Cl-和F-,会与形成钝化膜的阴离子竞争而导致钝化膜不稳定。
随着电位的进一步提高,阳极电流密度出现突越的现象,这是由于形成904L不锈钢的钝化膜被击穿所导致的。击穿时的电位被称为点蚀电位Eb,高于这个电位会导致点蚀的稳定发展。图5 所示为904L 不锈钢在0.10 mol/L Cl-溶液中Eb随F-浓度变化趋势。从图5 可以看出,当未加F-时,904L 不锈钢在0.10 mol/L Cl-溶液中拥有较高的点蚀电位Eb。当在0.10 mol/L Cl-溶液中加入0.05 mol/L F-溶液时,904L不锈钢在溶液中的点蚀电位Eb发生骤降,表明F-的加入使得904L 不锈钢在溶液中的耐点蚀性能明显下降。然而,当0.10 mol/L Cl-溶液中的F-浓度继续增加时,904L不锈钢在溶液中的点蚀电位Eb下降缓慢。这表明高浓度的F-对904l 不锈钢的点蚀增加的趋势减缓。

图5 点蚀电位随F-浓度的变化趋势
在904L 不锈钢中,较高浓度的Cl-除了能与Cu原子反应,与Cr 原子也存在化学溶解。另一方面,由于F-水解特性,导致F-的加入会使溶液的pH 值升高[17],因此,随着F-浓度的上升,溶液中的OH-浓度增大,对904L不锈钢的点蚀表现出抑制作用。另外,根据点蚀的自催化特性,点蚀在形成凹坑后,由于金属离子的水解作用而使得坑内的H+浓度持续增大,不锈钢的腐蚀被促进。为了维持凹坑电中性,坑外的侵蚀性离子向坑内迁移与金属离子形成络合物,阻止钝化膜被破坏。F-与H+具有很高的成键倾向,形成热力学稳定的HF。所以,F-的存在使得坑内H+浓度下降,点蚀的自催化特性被破坏而得以抑制[18]。
2.4 腐蚀形貌分析
利用扫描电子显微镜对试样进行观察,以验证电化学测试的结果。图6 所示为904L 不锈钢在含0.10 mol/L Cl-的不同浓度F-溶液中的腐蚀形貌。由图6 可知,在没有加入F-时,904L 不锈钢的点蚀坑半径极小,为亚稳态点蚀(图6(a))。当F-浓度为0.05 mol/L 时,904L 不锈钢出现明显的点蚀坑(图6(b))。随着F-浓度继续增大,点蚀坑的半径和数量随之增加,F-对904L不锈钢的侵蚀进一步加强(图6(c)和图6(d))。当F-浓度为0.30 mol/L 时,出现了大量的点蚀坑,但坑半径却有所减小(图6(e))。这是因为F-浓度增加到0.30 mol/L 时,904L 不锈钢表面的F-浓度上升,导致多处钝化膜遭受F-的穿透而形成蚀坑。同时,较高F-浓度意味着较多的F-随着钝化膜的击穿而迁移至蚀坑内与H+结合进而使点蚀自催化特性被破坏,点蚀的发展受到限制,因此点蚀坑的尺寸较小。

图6 904L不锈钢在含0.1 mol/L Cl-的不同浓度F-溶液中的腐蚀形貌
2.5 XRD分析
图7 所示为904L 不锈钢在含0.10 mol/L Cl-的0.30 mol/L F-溶液中浸泡48 h 后的XRD 图谱。根据研究表明[19-20],Cr 原子和Ni 原子会以氧化物和氢氧化物的形式形成钝化膜。因此,904L 不锈钢高铬和高镍含量是其具有优异耐蚀性的主要原因。然而,浸泡在F-溶液中的904L 不锈钢发生反应而生成了NiF2相,意味着形成钝化膜的有益元素Ni 被F-消耗,导致组成钝化膜的NiO含量减少。除此之外,由于NiF2溶解性较差,因而与钝化膜的其他成分共同组成混合膜,并且由于NiF2多孔不致密性,所以此时的混合膜保护性较差。故F-的加入会使904L 不锈钢的耐点蚀性能降低。XRD 测试结果佐证了上述对电化学的分析,进一步验证了F-浓度对904L不锈钢的侵蚀机理。

图7 904L不锈钢在含0.1 mol/L Cl-的0.30 mol/L F-溶液中浸泡48 h后的XRD图谱
2.6 模型建立
基于上述分析结果,建立了一种模型。首先存在于溶液中的Cl-通过吸附作用使钝化膜的溶解速率加快,导致钝化膜生成—溶解平衡被打破,形成活化点。Cl-通过活化点进一步向基体迁移而阻碍钝化膜的再修复。同时,F-通过高电场的作用渗透至钝化膜,亦或者是引起钝化膜表面电致收缩力而使钝化膜发生破裂,从而进入钝化膜内层。膜内的F-与NiO 和Cr2O3发生反应生成NiF2和CrF3沉积层,沉积层与钝化膜混合组成沉积层钝化膜。由于沉积层的致密性较差,因此复合钝化膜不再具有保护性。另一方面,溶液中的F-结合H+发生水解而使溶液中的OH-溶度增大,游离的OH-与Cl-产生吸附竞争而组成钝化膜。此外,通过活化点进入点蚀坑内F-也发生水解反应消耗坑内的H+,导致点蚀的自催化特性被破坏,点蚀坑的发展得到抑制。
随着F-浓度的增加,钝化膜外层的F-密度增大,上述侵蚀过程增强,复合钝化膜中NiF2和CrF3比例上升,钝化膜的保护性能持续下降。同时,溶液中F-浓度上升也会加强其水解反应使OH-浓度持续增大,OH-与基体溶解的金属离子形成氢氧化物而使钝化膜得以被修复。因此,F-溶度的增大对904L 不锈钢的点蚀既有促进作用又有抑制作用。定义ηF为F-对点蚀的影响;ηO为水解产生的OH-对点蚀的影响。由于F-对点蚀表现出促进作用,OH-对点蚀表现出抑制作用,因此规定:ηF>0,ηO<0。在本实验中,904L 不锈钢在F-浓度为0~0.30 mol/L范围内,点蚀电位Eb呈现持续下降的趋势,因此有|ηF|>|ηO|,即F-对904L 不锈钢点蚀的综合影响表现为促进作用。
3 结论
1)低浓度的F-和温度变化对904L 不锈钢的点蚀电位Eb有显著影响,而低浓度的Cl-浓度变化对904L不锈钢的点蚀电位Eb几乎没有影响。
2)当F-浓度从0增加至0.05 mol/L变化时,极化电阻Rp从2233 kΩ·cm2下降到1246 kΩ·cm2,表明F-浓度的上升会增加904L 不锈钢在Cl-溶液中的点蚀倾向;随着F-浓度继续增大(从0.05 mol/L 增加至0.30 mol/L),极化电阻Rp从1246 kΩ·cm2下降至559 kΩ·cm2,表明F-浓度继续升高时904L不锈钢点蚀倾向逐渐增加,但增加趋势逐渐减缓。
3)随着F-浓度升高,904L 不锈钢在F-和Cl-溶液中所形成的点蚀坑的数量增加,但在最高浓度F-溶液中的点蚀坑尺寸有所减小。
4)F-会以NiF2的形式形成钝化膜,导致钝化膜的修复变得困难且致密性降低,是904L不锈钢耐点蚀性能下降的重要原因。

