红花注射液生物活性测定法的建立与评价研究
刘金辉,梁耀月,田颖颖,赵新月,李依林,吕英楠,刘闯,左泽平,王志斌,(.北京中医药大学 中药学院,北京 00029;2.北京同仁堂股份有限公司科学研究所,北京 00079;.康龙化成(北京)生物技术有限公司,北京 0076)
质量的稳定可控是确保中药安全有效的前提[1]。目前,中药质量控制手段仍以化学手段检测指标性成分为主[2]。然而,中药疗效涉及多个代谢和信号途径,由多组分、多靶点、多环节共同发挥作用[3-6]。中药的药效是综合生物效应的体现,中药注射剂更是如此,进入体内后发挥药效物质众多,单一的化学成分控制并不能全面反映药效,现有的中药质控模式并不能完全保证中药的有效性。因此,亟须建立一种能够体现临床疗效的质控新模式,通过量化中药有效性反应并从整体控制中药的质量。近年来,生物活性测定已经引起广泛关注和认可[7],该方法从中药临床疗效的角度反映其质量,可用于有效成分不清、组分繁多、结构复杂、常规方法不能有效鉴定,但具有明确的生物活性的中药的评估。
红花注射液有显著的抗血栓作用,部颁标准中红花注射液是以羟基红花黄色素A、总黄酮(以山柰酚计)来评价其质量是否合格。已有研究对红花注射液中的化学成分进行全面表征,并研究其进入体内后的代谢产物,结果发现除指标性成分外,还有其他具有抗血小板聚集的成分及其代谢产物[8-9],由此可见,仅仅依赖这些指标性成分难以表征其有效性。所以,本研究以抗血小板聚集作用为红花注射液生物活性测定的指标,在现有的红花注射液质量控制的模式上作为补充方法,并通过试验系、量效关系及方法学研究建立红花注射液生物活性测定方法,为其生物活性测定奠定了基础,推动更加全面的红花注射液的质量控制,本研究对于补充优化红花注射液的质量控制方法具有重要意义。
1 材料
1.1 动物
SPF级日本大耳白兔,1.8~2.2 kg [北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2019-0006,合格证号为1103231911000416]。
1.2 试药
生理盐水(石家庄四药有限公司,批号:1809013205),血小板聚集功能检测试剂盒[花生四烯酸(AA)激活的比浊法,批号:401034]、血小板聚集功能检测试剂盒[二磷酸腺苷(ADP)激活的比浊法,批号:20190109B]、一次性测试杯、AG 400半自动血小板聚集仪(山东泰利康信生物科技有限公司),全自动血液分析仪(ADVIA 2120I西门子股份公司),红花注射液标准品(雅安三九药业有限公司,批号:19030100504);红花注射液供试品共4个厂家9个批次,详见表1。

表1 红花注射液供试品厂家批号信息Tab 1 Batch number of test material manufacturers of Safflower injection
2 方法与结果
2.1 血浆制备
采取家兔颈总动脉血,加3.2%枸橼酸钠抗凝(采血量∶抗凝剂=9∶1),160 g离心10 min,吸取上层富血小板血浆(PRP),剩余血样以3500 g离心10 min,吸取贫血小板血浆(PPP)。用全自动血液分析仪测定PRP和PPP中的初始血小板数量。后续实验用PPP稀释调整PRP数量。
2.2 血小板聚集率测定
取PPP 290 µL,添加生理盐水10 µL,依次添加不同含量的样品液10 µL,用其进行仪器调零。再取PRP 290 µL,依次添加不同含量的样品液10µL,37℃孵育180 s,并加入适量体积的血小板凝聚为诱导剂,读取在300 s内的最大凝聚量,得出聚集曲线。血小板测定在采血后4 h内完成。
2.3 试验系考察
2.3.1 红花注射液对不同诱导剂致血小板聚集作用的影响 将ADP配制成600 µmol·L-1的溶液,在血小板聚集试验中ADP终浓度分别为20、10、5、2.5 µmol·L-1。将AA配制成5 g·L-1的溶液,在血小板聚集试验中AA终质量浓度为250 µg·mL-1。按照“2.2”项下血小板聚集率测定方法,考察不同诱导剂对血小板聚集作用的影响,结果如表2所示,与正常对照组相比,红花注射液对ADP和AA致家兔体外血小板聚集均有明显的抑制作用(P<0.01);红花注射液对ADP致血小板聚集具有更为显著的抑制作用,因此选取ADP作为血小板聚集诱导剂。
表2 红花注射液对不同诱导剂致家兔体外血小板聚集作用的影响(±s,n=7)Tab 2 Effect of Safflower injection on the platelet aggregation in rabbits in vitro caused by different inducers (±s,n=7)

表2 红花注射液对不同诱导剂致家兔体外血小板聚集作用的影响(±s,n=7)Tab 2 Effect of Safflower injection on the platelet aggregation in rabbits in vitro caused by different inducers (±s,n=7)
注:与正常对照组比较,**P<0.01。Note:Compared with the normal control group,**P<0.01.
ADPAA血小板聚集率/%组别抑制率/%正常对照组43.92±2.23—76.19±4.49—红花注射液 16.96±2.33**61.38 59.16±2.71**22.35抑制率/%血小板聚集率/%
2.3.2 血小板数量和诱导剂ADP浓度对家兔体外血小板聚集率的影响 将不同数量血小板(100×109、200×109、300×109、400×109、500×109、600×109、700×109个·L-1)加入不同浓度的血小板激动剂ADP(20、10、5、2.5 µmol·L-1),所得到的血小板聚集率结果见图1。从图1可以看出,当ADP浓度为10 µmol·L-1时,血小板数量大于300×109个·L-1时,血小板聚集率达到平台期;但血小板数量在700×109个·L-1时,血小板聚集率稍有下降。当ADP浓度为5 µmol·L-1时,血小板数量大于400×109个·L-1时,血小板聚集率达到平台期,且血小板聚集率曲线波动变化平缓,因此选用ADP浓度为5 µmol·L-1。为后期避免加入药液体积和ADP的体积对血小板数量的影响,因此选用血小板的数量为500×109个·L-1。
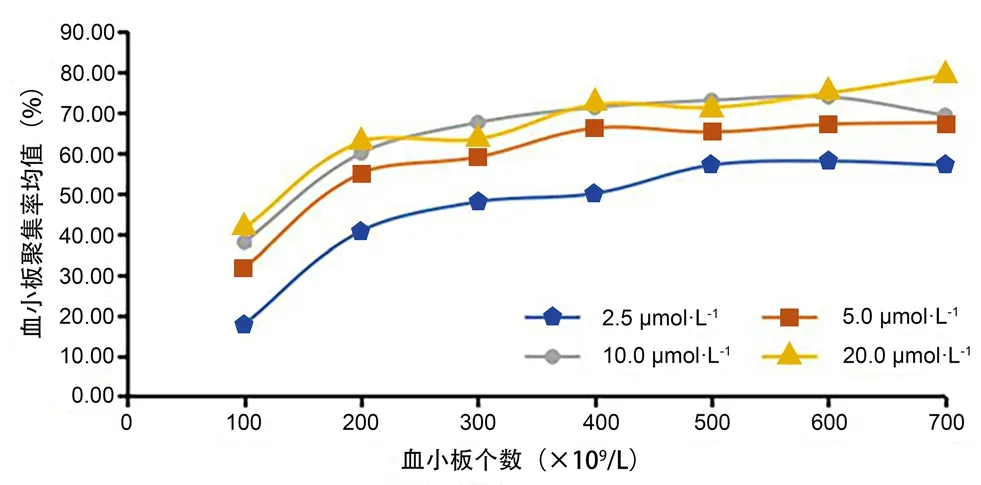
图1 血小板数量和诱导剂ADP浓度对血小板聚集率的影响Fig 1 Effect of platelet count and inducer ADP concentration on platelet aggregation rate
2.4 剂间比考察
按照生物活性测定法中量反应平行线测定法对于标准品与供试品的高低剂间比例的要求(1∶0.8)~(1∶0.5),红花注射液标准品分别按剂间比1∶0.8、1∶0.7、1∶0.6、1∶0.5进行配制,用生理盐水分别稀释成浓度为80.0%、64.0%、51.2%、41.0%、32.8%、26.2%、21.0%、16.8%、13.4%、10.7%、8.6%(剂间比1∶0.8);70.0%、49.0%、34.3%、24.0%、16.8%、11.8%、8.2%(剂间比1∶0.7);60.0%、36.0%、21.6%、13.0%、7.8%(剂间比1∶0.6);50.0%、25.0%、12.5%、6.3%(剂间比1∶0.5),备用。
分别考察在1∶0.8、1∶0.7、1∶0.6、1∶0.5不同剂间比的量效关系,每个浓度点平行测定3次,以红花注射液浓度为X轴,血小板抑制率均值为Y轴作量效关系曲线图,结果如图2所示,红花注射液剂间比为1∶0.5时,随着红花注射液浓度的上升,血小板聚集抑制率呈上升趋势,红花注射液的浓度与血小板聚集抑制率的量效关系更为显著且3次测定的平行性良好。
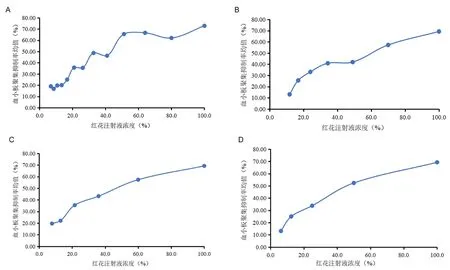
图2 红花注射液标准品(不同剂间比)的量效关系考察结果Fig 2 Quantitative and qualitative relationship of Safflower injection standard(different inter-dose ratios)
2.5 量效学考察结果
取配制好的红花注射液,分别测定含药兔血浆在5 min内的血小板最大聚集率,平行测定3次,考察量效关系。综合评判量效关系检测结果,选取剂间比为1∶0.5(6.3%、12.5%、25%、50%、100%)测定,平行测定3次。结果显示,随着红花注射液浓度的上升,血小板聚集抑制率呈上升趋势,且量效关系较好。以红花注射液浓度为X轴,血小板聚集抑制率均值为Y轴作量效关系曲线图,如图3所示,结果显示3次测定的平行性良好,每次测定的结果均显示良好量效关系。
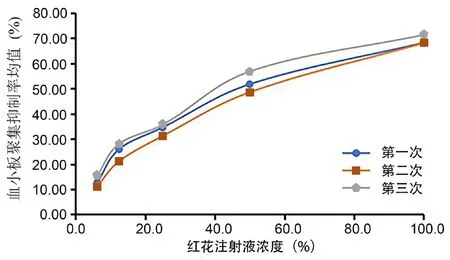
图3 三次测定的量效关系考察结果Fig 3 Examination results of the quantitative and qualitative relationships of the three measurements
2.6 测定方法的确定
利用量反应平行线(3.3)法[10]进行后续试验。按照量反应平行线(3.3)测定法中要求对数剂量(x)和反应或反应的特定函数(y)呈直线关系,因此需要考察线性关系。红花注射液选取100%、50%、25% 3个浓度剂量,以红花注射液浓度对数值为X轴,体外血小板聚集抑制率的对数值为Y轴作图,标示线性方程和相关系数,结果如图4所示,红花注射液在100%、50%、25% 3个浓度剂量时,血小板聚集抑制率的对数值与红花注射液浓度对数值线性关系较好,3次测定结果的线性回归方程的相关系数分别为 0.9887、0.9941、0.9624,均在0.9以上,因此可以采用量反应平行线(3.3)法测定效价。
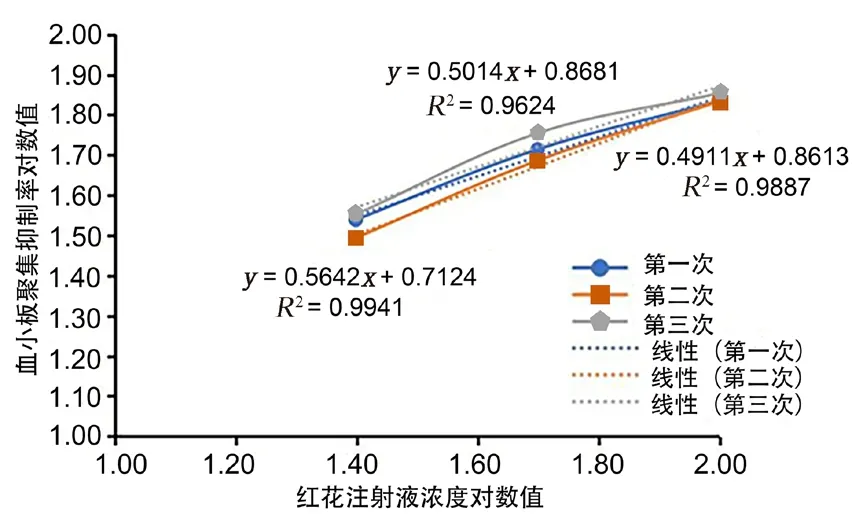
图4 线性考察结果Fig 4 Linear investigation
2.7 方法学考察
2.7.1 效价测定与可靠性 标准品与供试品按剂间比1∶0.5分别配制高(SH)、中(SM)、低(SL)3个浓度,即100%、50%和25%。每一浓度平行测定3次,相应的血小板聚集抑制率如表3所示。

表3 标准品及供试品的血小板聚集抑制率(%,n=3)Tab 3 Platelet aggregation inhibition rate of the standard and the test material (%,n=3)
以浓度为100%的红花注射液标准品血小板聚集抑制率1%为1个效价单位(U),1 mL的效价(U·mL-1)=X×(1/0.01),X为红花注射液血小板聚集抑制率的数值。据效价定义,测定的标准品效价为75.94×(1/0.01)=7594 U·mL-1,测定供试品(批号:19040101001)的效价为8478.5 U·mL-1,可信限率(FL)为15.421%,可信限范围在7288~9903 U·mL-1。采用量反应平行线(3.3)测定法进行供试品的效价测定,并进行可靠性检验,结果如表4所示,供试品间差异无统计学意义(P>0.05),说明两组的效价无显著性差异,表示供试品的标示量基本正确。变异来源中的回归应非常显著(P<0.01),偏离平行、二次曲线、反向二次曲线均应无显著性意义,表示两条直线基本平行并符合直线关系。在本实验中,回归项非常显著(P<0.01),其余三项均无显著性意义(P>0.05),符合要求。剂间差异应有显著性意义,表示试验剂量安排合理,本试验中剂间差异显著(P<0.01),满足要求。以上结果表明测定供试品红花注射液的效价准确,FL<20%,说明方法可靠。
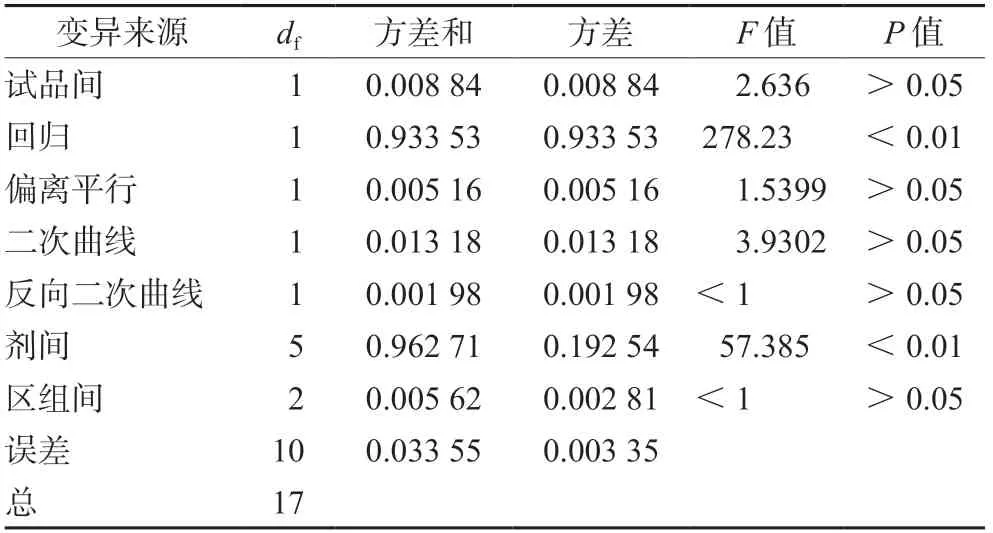
表4 供试品的可靠性检验结果Tab 4 Reliability of the test material
2.7.2 重复性 在相同条件下,取待测批次的红花注射液重复测定6次,分别测得6次效价和可信限率并进行可靠性检验,计算结果的平均值和相对标准偏差(RSD),6次测定的效价为(7697.32±321.38)U·mL-1,RSD为4.175%,小于10%;FL平均值16.47%,小于20%,说明该方法测定的效价重复性良好。
2.7.3 中间精密度 在相同条件下,不同人员取待测批次的红花注射液进行的生物活性效价测定,每个人员重复测定3次并进行可靠性检验。不同的实验人员测得的结果均通过可靠性检验,效价的RSD为3.613%,小于10%,FL平均值10.88%,小于20%,说明不同实验人员对测定结果的影响不大,中间精密度良好。
2.7.4 方法适用性 在方法适用性的考察中,选取了4个厂家8个批次的红花注射液,测定结果见图5,表5,不同批次的红花注射液测得的效价不同,FL均<20%,检定结果精密度良好。可靠性考察显示,不同批次间差异无统计学意义(P>0.05),表明供试品的效价测定值基本准确,且供试品的效价与标准品无明显差异,偏离平行和反向二次曲线统计所得结果差异均无统计学意义(P>0.05),变异来源中的回归显著(P<0.01),表明标准品和供试品是两条平行直线。本实验中,不同剂量间所测结果差异具有统计学意义(P<0.01),表明实验剂量设置合理,且供试品效价测定方法稳定可靠。
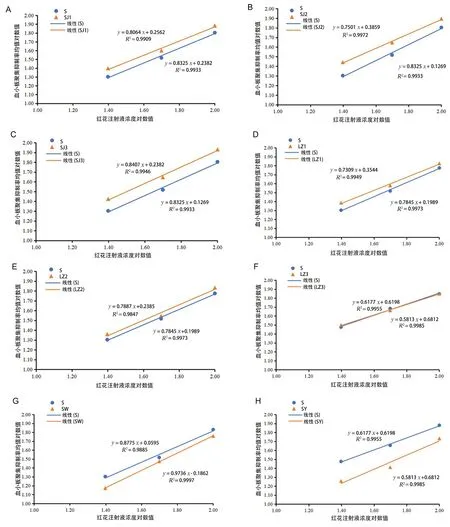
图5 不同厂家不同批次的红花注射液线性考察结果Fig 5 Linearity of different batches of Safflower Injection from different manufacturers
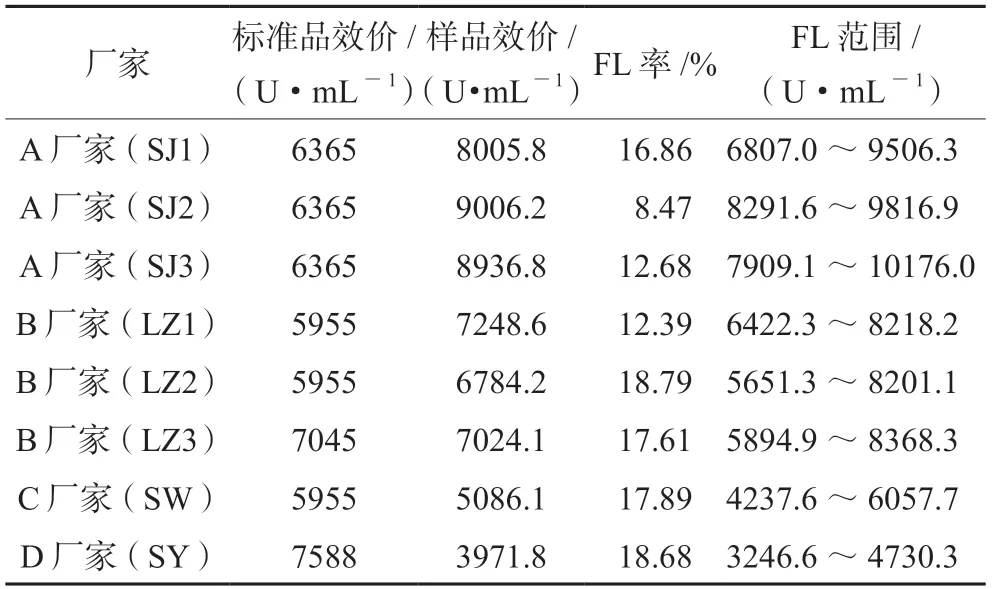
表5 不同厂家不同批次红花注射液效价结果Tab 5 Summary of potency of different batches of Safflower injection from different manufacturers
2.8 统计分析
应用SAS 9.4(序列号:647652)软件处理数据,各组数据以±s表示,组间比较采用Dunnett’st检验和单因素方差分析(One-Way ANOVA)法。采用《中国药典》生物检定统计程序BS2000进行可靠性检验,并计算各组供试品的效价和FL。
3 讨论
可控的质量评价标准是我国科技工业发展和中医药现代化、国际化的国家战略,随着科学技术的发展和现代技术的应用,特别是中医药的创新,中医药的质量和质量标准的研究不断提高[11-12]。当前,基于化学方法的中药注射剂质量控制已被广泛采用。中药注射剂化学成分的复杂性给当前以色谱和光谱技术为基础的化学方法识别所有化合物造成了很大的困难[13]。此外,由于化学方法提供的化学信息与体内整体活性之间的联系还未证实,化学信息无法完全保证中药注射剂安全有效[14-15]。因此,用化学方法控制中药注射剂的质量存在一定的缺陷。近年来,利用生物测定方法控制复方中草药的质量受到了广泛的关注[16]。尽管生物测定不能提供化学信息,但它们具有提供生物制品直接生物活性甚至临床安全性和有效性信息的优势[17]。受这些事实的启发,我们认为将生物测定法引入中药注射剂的质量控制体系,有利于提高中药注射剂的质量标准[18-19]。目前,生物评价逐渐成为中药质量控制的发展方向之一,被2020年版《中国药典》收录[20],为控制中药有效性提供了新的思路。
红花注射液是临床上的常用品种,主要功效是活血化瘀。在最新的红花注射液质量标准中,新增了羟基红花黄色素A、总黄酮(以山柰酚计)的含量测定,并新增成品的指纹图谱(相似度≥0.85)[21]。但经文献调研,红花注射液中的山柰酚-3-O-β-芸香糖苷、绿原酸、咖啡酸、山柰酚-3-O-β-槐糖苷等成分均有不同程度的抗血小板聚集作用,而药典中规定检测的山柰酚却表现出较低的抗血小板聚集活性[22]。这说明,目前红花注射液的质量控制方法尚处于单纯的化学控制阶段,含量测定项目仍不足以整体控制其质量,难以全面保证有效性,加之进入体内后代谢产物繁多,发挥药效的物质形式并不明确,指纹图谱相似度考察也仅是对于成分的整体控制,缺乏直接与有效性关联的指标。因此,有必要在现有中药质量控制模式的基础上引入生物活性测定方法,对红花注射液的质量进行综合评价。
鉴于红花注射液对血小板聚集具有良好的抑制作用,本研究以血小板聚集抑制率来定义效价,测定红花注射液标准品的效价为7594 U·mL-1,对不同诱导剂的种类(ADP和AA)、血小板的数量及不同的剂间比进行研究,综合评判各项结果,选择最适宜的条件建立方法并进行后期验证。研究显示所建立的方法量效关系明显,线性关系良好,测定的效价可靠,能够较好地用于红花注射液质量评价。本研究发现,不同厂家不同批次的红花注射液虽然同质,理化检验结果均符合药典规定的标准,但通过生物活性测定方法测得的效价却各不相同,说明不同厂家不同批次间的红花注射液抑制血小板聚集的生物活性存在差异,从而进一步说明单纯依靠化学指标并不能全面反映药品的有效性,而应该基于临床药效控制其有效性。本研究中基于“药效”建立的生物活性测定方法能够衡量不同厂家不同批次样品间抑制血小板聚集的活性,可以作为红花注射液质量评价方法的补充。后期可以采用更多厂家更多批次的红花注射液运用此方法来进一步验证本研究的适用性。
本方法的建立有望在一定程度上作为现行红花注射液质量控制方法的补充,为生物活性测定法在中药质量控制方面的发展提供一定借鉴意义,进而可以为中药注射液标准品的确立和方法学的发展开创新的思路,为中药质量控制模式及质量评价方法的建立提供新的研究思路,推动中药国际化进程。