龙眼肉多糖对Aβ诱导耐受的小胶质细胞吞噬功能的影响及其机制
赵晨阳,崔鹤蓉,岳德琼,张晗,李昶,李红艳*(.辽宁中医药大学,辽宁 大连 6600;.北京中医药大学,北京 0009)
阿尔茨海默病(Alzheimer’s disease,AD)是一种进行性发展的神经退行性疾病,β-淀粉样蛋白(Aβ)过度累积和清除不足是AD发生发展的始动因素[1]。小胶质细胞是中枢神经系统的固有免疫细胞[2],能够感知识别Aβ并将其吞噬在自身溶酶体中从而限制它们在大脑中扩散[3],有效抑制AD的自然病程,该过程依赖于mTOR/HIF-1α途径[2],并伴有PI3K/Akt/mTOR信号通路的激活[4]。但长期暴露于Aβ环境中,小胶质细胞会出现能量代谢障碍并逐渐减少免疫应答而发展为慢性耐受[2],导致Aβ大量沉积,造成大量神经元死亡和神经炎症反应,最终导致AD发生[5]。
龙眼肉系无患子科植物龙眼(Dimocarpus longanLour.)的假种皮,龙眼肉多糖(longan aril polysaccharides,LAPs)是其主要有效成分之一。现代研究表明,LAPs能抑制脂多糖(LPS)诱导的炎症介质产生和相关基因表达[6],促进巨噬细胞的吞噬功能和炎症因子释放水平[7-9]。本研究基于文献报道和前期研究结果,体外建立Aβ诱导耐受的小胶质细胞(BV2)模型,探讨LAPs对Aβ耐受BV2细胞吞噬能力的影响,并结合课题组前期研究结果[10]及小胶质细胞免疫应答反应与PI3K/Akt/mTOR/HIF-1α信号通路的相关性[2,4],通过Western blot技术和荧光Aβ吞噬实验等分析LAPs改善BV2细胞吞噬功能的作用机制,为深入探究LAPs的抗AD作用奠定基础。
1 材料
1.1 细胞及培养
小鼠小胶质细胞BV2(协和细胞库),使用含10%胎牛血清与1%双抗的高糖DMEM培养基于37℃、5%CO2培养箱中培养。
1.2 试药
龙眼肉(货号:2206001,河北润滑药业);Aβ1-42(批号:P210727-GB20601,上海捷妮泰生物科技);Alexa Fluor 488荧光标记Aβ1-42(批号:2156636,Anaspec);DMEM高糖培养基(批号:8121526)、胰蛋白酶(批号:2277231)(Gibco);胎牛血清(批号:18070505,四季青);双抗(批号:J200044,Hyclone);抗GAPDH抗体(批号:3561122204)、抗AKT抗体(批号:55500009442)、抗P-AKT(S473)抗体(批号:5500011663)、抗HIF-1α抗体(批号:5500016723)、抗PI3K抗体(批号:3560538002)、HRP山羊抗兔IgG(H+L)(批号:9300014001)(ABclonal);线粒体膜电位JC-1检测试剂盒(批号:20210712)、雷帕霉素(批号:427W021)、BAY87-2243(批号:709B021)(索莱宝)。
1.3 仪器
万分之一电子分析天平(Ohaus);旋转蒸发仪(上海申生科技有限公司);调温电热套(北京市永光明医疗仪器有限公司);CO2培养箱(Nuaire);酶标仪(Mindray);荧光倒置显微镜(Nikon);电泳仪、半干式蛋白转膜仪(Bio-Rad);全自动化学发光/凝胶成像分析系统(Tanon)。
2 方法与结果
2.1 龙眼肉多糖的制备
称取200 g去核龙眼肉,剪碎,置于10 L圆底烧瓶中,加入10倍量纯水浸泡2 h后,于加热套中加热提取,220 V加热至沸腾后,转至50 V保持微沸1 h,冷却后四层纱布过滤,收集滤液,同法煎煮3次,合并滤液,70℃蒸发浓缩至200 mL得龙眼肉水煎液,采用“慢加快搅”的方式向其中加入95%乙醇至乙醇终浓度为80%以上,充分搅拌后,静置12 h以上,5000 r·min-1离心10 min,收集沉淀,60℃干燥至恒重即得LAPs。根据公式:LAPs收率(%)=LAPs称重质量(g)/龙眼肉质量(200 g)×100%,计算得LAPs收率约为25.51%;依据文献[11],采用苯酚-硫酸法测得其多糖含量为(56.25±1.25)%。
2.2 Aβ耐受BV2细胞模型的建立
模型建立方法参考文献[2]并进行适当修改。取对数生长期的BV2细胞,无菌接种于96孔细胞培养板,常规培养12 h后,随机分为对照组及Aβ2、4、8 μmol·L-1组。除对照组外,各组分别采用2、4、8 μmol·L-1Aβ处理细胞48 h,对照组加入终体积相同的培养基。48 h后各组更换新鲜培养基常规培养24 h,再加入2 μmol·L-1Aβ诱导细胞激活,依据MTT法进行细胞增殖实验,确定诱导BV2细胞耐受的Aβ最佳浓度,建立BV2细胞耐受模型。结果表明,随着Aβ浓度增加,细胞增殖率逐渐降低,8 μmol·L-1Aβ已出现明显细胞毒性(见图1A,P<0.05)。故选用2和4 μmol·L-1Aβ进行进一步实验,即在Aβ处理细胞48 h+24 h后,加入2 μmol·L-1Aβ再次处理细胞,观察细胞增殖情况,结果表明,2 μmol·L-1Aβ组再次加入Aβ时(Aβ2+2组),细胞较2 μmol·L-1Aβ组进一步增殖(见图1B,P<0.05),提示细胞尚未耐受;4 μmol·L-1Aβ组再次加入Aβ时(Aβ4+2组)细胞增殖较4 μmol·L-1Aβ组显著降低(见图1C,P<0.01),表明再次经Aβ处理时细胞并未继续活化增殖,且因Aβ的再次加入而出现增殖率下降,提示在4 μmol·L-1Aβ处理细胞48 h+24 h后,BV2细胞已达到耐受状态,以此条件建立Aβ耐受的BV2细胞模型,作为模型组。

图1 MTT法筛选Aβ耐受BV2细胞模型的造模条件Fig 1 Modeling conditions of immune-tolerant BV2 cell models by MTT method
2.3 MTT法检测细胞增殖
取对数生长期的BV2细胞,接种于96孔细胞培养板,12 h后随机分为对照组、模型组和LAPs组(0.1、0.2、0.4、0.8、1.6 mg·mL-1)。除对照组外,其余各组均加入终浓度4 μmol·L-1Aβ培养48 h后常规培养24 h建立细胞耐受模型。除对照组外,各组每孔加入2 μmol·L-1Aβ处理24 h诱导细胞激活,LAPs组在加入2 μmol·L-1Aβ前分别加入终浓度0.1、0.2、0.4、0.8、1.6 mg·mL-1的LAPs预处理细胞2 h,MTT法检测细胞增殖水平,选取细胞增殖率较高的浓度作为LAPs最佳给药浓度。结果表明,与对照组比较,模型组细胞增殖率显著提高(P<0.05)(见图2)。与模型组比较,当LAPs质量浓度为0.1 mg·mL-1时,细胞增殖率显著降低(P<0.01);LAPs浓度为0.2、0.4 mg·mL-1时,细胞增殖差异无统计学意义;LAPs质量浓度为0.8、1.6 mg·mL-1时,细胞增殖率显著提高(P<0.05)。结果提示,LAPs可能因使用剂量不同,对BV2细胞活化有着双向调节作用,低浓度(0.2、0.4 mg·mL-1)可能具有抑制BV2细胞激活的作用,高浓度(0.8、1.6 mg·mL-1)则能促进Aβ诱导耐受的BV2细胞增殖。

图2 MTT检测不同浓度LAPs对Aβ诱导耐受的BV2细胞增殖的影响Fig 2 Effect of different concentrations of LAPs on the proliferation of Aβ-induced tolerant BV2 cells by MTT method
2.4 JC-1试剂盒检测线粒体膜电位
取对数生长期的BV2细胞以1×105个·mL-1接种于6孔细胞培养板中,随机分为对照组,模型组,LAPs 0.8、1.6 mg·mL-1组。除对照组外,其余各组均加入终浓度4 μmol·L-1Aβ培养48 h后常规培养24 h建立细胞耐受模型;各组每孔均加入2 μmol·L-1Aβ1-42再次处理细胞24 h,对照组加入等体积培养基。按照试剂盒说明书,每孔加入1 mL JC-1染色工作液,置于细胞培养箱中37℃孵育20 min。孵育结束后弃去上清液,使用JC-1染色缓冲液洗涤2次后于倒置荧光显微镜下观察,Image J软件分析各组细胞红、绿色荧光强度,计算红/绿荧光强度比,比较各组细胞线粒体膜电位变化。由图3可见,与对照组比较,模型组细胞红/绿荧光比值显著降低(P<0.01);与模型组比较,LAPs组细胞红/绿荧光比值提高(P<0.01)。结果提示,模型组细胞线粒体受损,膜电位下降或丧失;LAPs能提高Aβ诱导耐受的BV2细胞线粒体膜电位水平。
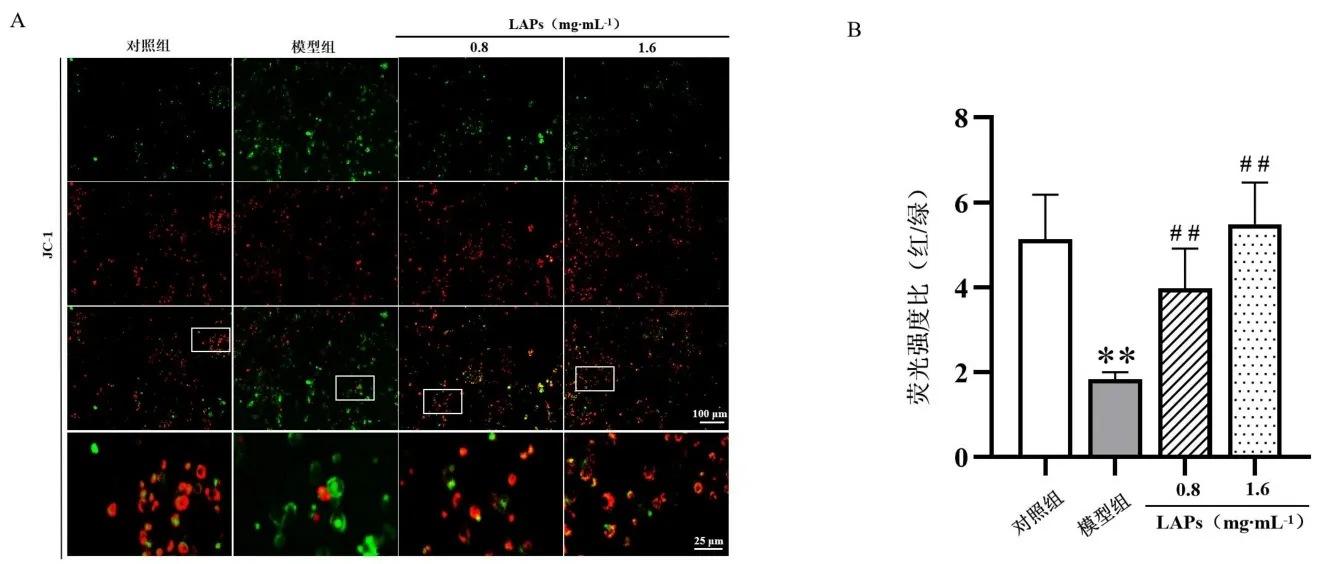
图3 LAPs对BV2细胞线粒体膜电位的影响Fig 3 Effect of LAPs on mitochondrial membrane potential in BV2 cells
2.5 荧光显微镜检测细胞吞噬功能
取对数生长期的BV2细胞,接种于96孔细胞培养板,细胞分组及处理同“2.4”项下。在LAPs预处理细胞2 h后,除对照组外,其余各组均加入终浓度4 μmol·L-1Aβ培养48 h后常规培养24 h建立细胞耐受模型;各孔细胞均加入2 μmol·L-1荧光标记Aβ1-42再次处理24 h,对照组加入等体积培养基。24 h后弃去各孔培养基,用PBS小心润洗后,于倒置荧光显微镜下观察,Image J软件分析荧光强度,计算细胞荧光吞噬率。细胞荧光吞噬率(%)=实验组荧光强度/对照组荧光强度×100%。结果表明,与对照组比较,模型组细胞荧光吞噬率显著降低(P<0.05);与模型组比较,LAPs组细胞荧光吞噬率显著升高(P<0.05,P<0.01),其中LAPs 0.8 mg·mL-1组荧光吞噬率尚未达到正常细胞水平(P<0.05),LAPs 1.6 mg·mL-1组细胞荧光吞噬率显著高于对照组细胞(P<0.05)(见图4A、B)。

图4 LAPs对BV2细胞吞噬荧光Aβ的影响Fig 4 Effect of LAPs on the phagocytosis of fluorescent Aβ in BV2 cells
2.6 Western blot技术检测PI3K/Akt/mTOR/HIF-1α信号通路相关蛋白表达
取对数生长期的BV2细胞以5×105个·mL-1接种于细胞培养瓶中,细胞分组及处理同“2.4”项下。收集各组BV2细胞,用预冷PBS洗涤3次,根据说明书按比例加入裂解液,冰上裂解,吸取上清液进行BCA蛋白含量检测。取等量蛋白,经SDS-PAGE凝胶电泳后,电转至NC膜上,使用5%脱脂奶粉封闭2 h,洗涤;加入一抗(抗PI3K、Akt、p-Akt、HIF-1α以及GAPDH抗体,1∶500),4℃孵育过夜,洗涤;加入二抗(HRP标记山羊抗兔抗体,1∶3000),室温孵育2 h,洗涤;采用ECL化学发光,用Image J软件分析条带灰度值。由图5可见,与对照组比较,模型组除PI3K蛋白表达减少外,Akt、p-Akt和HIF-1α蛋白表达均增加(P<0.01);与模型组比较,LAPs(0.8、1.6 mg·mL-1)组的PI3K、Akt、p-Akt和HIF-1α蛋白的表达水平均提高(P<0.05,P<0.01)。

图5 LAPs对BV2细胞PI3K/Akt/mTOR/HIF-1α信号通路蛋白表达的影响Fig 5 Effect of LAPs on the expression of PI3K/Akt/mTOR/HIF-1α pathway proteins in BV2 cells
2.7 抑制剂BAY、Rapa对LAPs给药后的BV2细胞吞噬功能的影响
取对数生长期的BV2细胞,接种于96孔细胞培养板,12 h后随机分为对照组、模型组、LAPs组(0.8、1.6 mg·mL-1)和抑制剂组(LAPs+BAY、LAPs+Rapa),抑制剂组在LAPs给药前根据文献[2]分别加入HIF-1α抑制剂BAY87-2243(10 μmol·L-1)和mTOR抑制剂Rapa(30 nmol·L-1)。除对照组外,其余各组均加入终浓度4 μmol·L-1Aβ培养48 h后常规培养24 h建立细胞耐受模型;各孔细胞均加入2 μmol·L-1荧光标记Aβ1-42再次处理24 h,对照组加入等体积培养基。24 h后弃去各孔培养基,用PBS小心润洗后,于倒置荧光显微镜下观察,Image J软件分析荧光强度。由图6可见,与对照组比较,模型组细胞胞内绿色荧光减少(P<0.01);与模型组比较,LAPs组细胞胞内绿色荧光增多(P<0.01);与LAPs组比较,BAY及Rapa组细胞胞内绿色荧光均降低(P<0.05,P<0.01)。

图6 BAY和Rapa对LAPs给药的BV2细胞吞噬荧光Aβ的影响Fig 6 Effect of BAY and Rapa on the phagocytosis of fluorescent Aβ in BV2 cells administered with LAPs
2.8 统计学分析
采用SPSS 19.0和GraphPad Prism 8.0进行统计分析,实验数据采用均数±标准差(±s),组间比较采用单因素方差分析和t检验,P<0.05表示差异有统计学意义。
3 讨论
近年来研究表明,Aβ沉积可诱导小胶质细胞的增殖,使其从静止态转变为活化态,最终促使活化的小胶质细胞吞噬Aβ能力增强[12]。活化的小胶质细胞聚集在Aβ周围,不断吞噬Aβ斑块以延缓AD的发生发展[13-14]。但因Aβ具有线粒体毒性,长期的Aβ环境使小胶质细胞线粒体严重受损[2,15],细胞能量代谢障碍,而出现免疫耐受,对Aβ的吞噬能力下降[16]。本文以Aβ慢性处理诱导BV2细胞耐受,结果表明,耐受的BV2细胞虽然仍表现出一定水平的增殖,但其吞噬能力和线粒体膜电位均下降,再次加入Aβ后细胞增殖率明显降低,提示耐受的BV2细胞功能受损或已发生早期凋亡。经LAPs干预后,耐受的BV2细胞增殖能力、线粒体膜电位水平及吞噬功能均提高,提示LAPs能够逆转Aβ诱导的BV2细胞耐受,在一定程度上恢复BV2细胞的吞噬功能。因免疫耐受的小胶质细胞存在PI3K/Akt/mTOR及mTOR/HIF-1α信号通路抑制[2,4],本研究通过Western blot技术检测PI3K/Akt/mTOR/HIF-1α信号通路关键蛋白的表达情况,并观察抑制剂BAY和Rapa对LAPs提高BV2吞噬功能的阻断作用。结果表明,LAPs能显著提高信号通路关键蛋白的表达,Rapa和BAY显著降低了LAPs的作用,提示激活PI3K/Akt/mTOR/HIF-1α信号通路是LAPs影响BV2细胞吞噬功能的可能作用机制,但Rapa和BAY的加入均未能完全阻断LAPs的作用,因此课题组认为LAPs可能存在多个作用靶点,或存在多种作用途径。
本研究为基于调控小胶质细胞免疫应答反应探讨LAPs抗AD的作用机制提供了依据,后续将基于体外实验开展LAPs抑制AD进程的体内作用与机制研究,以全面阐释LAPs的抗AD作用。