藜麦麸皮黄酒和普通黄酒的品质比较
姜学敏,张 虹,2,高 慧,蔡雨情,赵 雷, ,薛 鹏,2,
(1.潍坊医学院公共卫生学院,山东潍坊 261053;2.潍坊医学院公共卫生检测检验中心,山东潍坊 261053)
黄酒与葡萄酒、啤酒并称世界三大古酿造酒[1]。黄酒是用粮食为原料加酒曲酿制而成。酒曲主要分为米曲和麦曲,其中麦曲包括生麦曲和熟麦曲。长久以来,中国南方地区的黄酒多以当地盛产的稻米为原料,加以米曲或麦曲酿制而成,尤以绍兴地区的黄酒最为出名。而中国北方地区的黄酒多以黍米、高粱等谷物为原料,加以麦曲酿制而成,其中山东地区使用陈伏曲酿造的即墨老酒以其“红褐透明、微苦焦香、后味深长、盈盅不溢”的独特风格而闻名[2]。陈伏曲是选用优质小麦在三伏天自然发酵而成的生麦曲,它也常为中医所用,被誉为“神曲”[3]。不同于葡萄酒和啤酒,我国将黄酒应用于中药由来已久,《长沙药解》中就提到黄酒具有“辛温升发,温血脉而消寒涩”之功效,尤其适于妇女和老年人饮用。
黄酒中除了含有丰富的营养物质,还含有许多活性成分,如多肽、多糖、有机酸、多酚等[4-7]。另外,黄酒余韵悠长的风味特点来自于酒体中丰富的挥发性风味物质。研究发现大多数的风味来源于黄酒中的醇类物质和酯类物质,例如苯乙醇、异戊醇、异丁醇、乙酸苯乙酯等[8-10]。除此之外,刘少璞等[11]采用全二维气相色谱-飞行时间质谱技术检测到黄酒中也含有挥发性酸类物质,其含量占总挥发性物质总量的6.0%。总体来说,大多数研究集中在挥发性风味物质的检测上,但是对于非挥发性的物质检测报道较少。在酿酒原材料的选择上,基本以粮食的籽粒为主,包括糯米、小麦、高粱等,也有学者采用藜麦籽粒为原料进行发酵,得到风味口感较好的藜麦黄酒以及藜麦啤酒[12-13];另外,黄月等[14]采用青稞麸皮作为原材料进行酿酒,结果表明青稞麸皮的加入对黄酒风味的形成有积极意义。但由于麸皮常被用来当作饲料,所以对于麸皮酿酒的研究少之又少,更没有利用藜麦麸皮酿酒的先例。而研究表明,藜麦麸皮富含多种营养成分以及植物化学物质[15-16],包括黄酮[17]、皂苷[18-19]等,而这些物质具有良好的生物活性[20-23]。如果可以将其引入到黄酒当中,不仅会增加黄酒的营养价值,也能提高藜麦麸皮的利用率。
目前来说,利用藜麦制成的产品主要包括藜麦啤酒、藜麦面包、藜麦植物蛋白饮料、藜麦功能性酸奶[24-26]等,而对于利用藜麦麸皮制成的产品却始终处于起步阶段。因此,为了填补藜麦麸皮黄酒产业的空白,也为了提升藜麦麸皮的实用性和经济性,本研究将以自制陈伏曲作为发酵曲,用高梁和豌豆作为原料,藜麦麸皮作为辅料酿造黄酒。采用液相色谱-质谱联用技术(High-Performance Liquid Chromatography-Mass Spectrometer,HPLC-MS)和气相色谱-质谱联用技术(Gas Chromatography-Mass Spectrometer,GC-MS)对普通黄酒以及藜麦麸皮黄酒中的非挥发性化合物和挥发性风味物质进行分析比较,测定两种黄酒的抗氧化活性,探究加入藜麦麸皮对黄酒风味、潜在活性的影响,也为高值化利用藜麦麸皮提供实践及理论依据。
1 材料与方法
1.1 材料与仪器
藜麦麸皮 内蒙古益稷生物科技有限公司;高粱、豌豆 市售;陈伏曲 自制,于夏季伏天,取用普通小麦,将其碾碎,加水拌湿,制成约200 g 的圆饼状曲块,用特殊草叶包裹,置于麦秆中保存约1 个月,期间温度保持在35 ℃,湿度70%,即成陈伏曲;碳酸氢钠、氯化钠、三氯乙酸、铁氰化钾、磷酸二氢钠、磷酸氢二钠、三氯化铁、氯化亚铁、维生素C、硫酸亚铁、水杨酸、过氧化氢均为分析纯,无水乙醇、无水甲醇、乙腈均为色谱纯 国药集团化学试剂有限公司;酪氨酸酶(ACT=25 KU/mg)上海麦克林生化科技有限公司;左旋多巴(L-Dopa)Sigma 公司;酒样标准品 滕州中科谱分析仪器有限公司;实验中的用水未经特殊说明均为超纯水。
Shimadzu GC 2030 气相色谱仪、Shimadzu GCMS TQ8050NX 气相色谱质谱仪 日本岛津公司;Ulti-MateTM3000 液相色谱质谱联用仪 美国Thermo Fisher Scientific 公司;Agilent GTA 120 原子吸收分光光度计 美国安捷伦科技公司;SpectraMax M2 多功能酶标仪 美谷分子仪器(上海)有限公司;PALLcascade 超纯水制备机 济南东岱科学器材有限公司;HH-4 型数显恒温水浴锅 常州国华电器有限公司。
1.2 实验方法
1.2.1 藜麦麸皮黄酒酿造工艺流程及技术要点 藜麦麸皮黄酒酿造工艺流程见图1。将高粱用等体积的2 g/mL 碳酸氢钠水溶液室温密封浸泡48 h 去除种皮中大部分单宁以减少苦涩味,75 ℃下以2 倍体积水浸泡24 h。同时取等质量豌豆,2 倍体积水浸泡24 h,随后将两者混合,加入2 倍体积水,600 W加热至100 ℃后转小火300 W 煮至完全糊化,呈糜状,室温冷却至65 ℃备用。将陈伏曲块稍加焙炒出曲香后研成粉末,与煮糜后的原料和高温灭菌后的藜麦麸皮混合搅拌均匀,藜麦麸皮的添加量为5%(w/w),同时以未加藜麦麸皮的作为对照,陈伏曲粉末的加入量为0.5%(w/w)。在30 ℃,湿度为70%的条件下主发酵7 d,28 ℃后发酵5 d。发酵结束后,在4 ℃条件下,8000 r/min 离心15 min,分离出酒糟,获得的上清液即为黄酒原液。

图1 黄酒酿造工艺流程图Fig.1 Flow chart of Huangjiu brewing process
1.2.2 实验分组 利用高粱与豌豆发酵的普通黄酒记为SP,利用高粱、豌豆与藜麦麸皮发酵的藜麦麸皮黄酒记为SPQ,每组设置三个平行样品,分别记为SP1、SP2、SP3 和SPQ1、SPQ2、SPQ3。
1.2.3 黄酒的理化指标及可能污染物测定
1.2.3.1 总糖 按照国标GB/T 13662-2018《黄酒》中的方法测定。
1.2.3.2 可溶性固形物 按照国标GB/T 13662-2018《黄酒》中的105 ℃恒重法测定。总固形物含量减去总糖含量即为可溶性固形物的含量。
1.2.3.3 酒精度 按照国标GB 5009.225-2016《酒中乙醇浓度的测定》中的气相色谱法进行测定。
1.2.3.4 总皂苷 色谱条件[27]:C18色谱柱(YMC ODS-Pack,4.6 mm×250 mm,5 μm),柱温:25 ℃;检测波长:202 nm;流动相A:超纯水;流动相B:乙腈;流速:1.0 mL/min;梯度洗脱(流动相B):0.01 min 10%;5 min 10%,10 min 15%,15 min 20%,25 min 22%,35 min 28%,45 min 35%,50 min 40%,55 min 45%,60 min 60%,65 min 85%,70 min 10%。
首先,将齐墩果酸型皂苷标准品精确配制成不同浓度的溶液,分别过0.45 μm 滤膜后进样20 μL 于高效液相色谱中,以标准品浓度X(μg/mL)为横坐标,峰面积Y 为纵坐标绘制标准曲线,得到标准曲线回归方程为Y=4992.7321X+848412.1171(R2=0.9998)。然后,吸取200 μL 酒样,加入800 μL 乙醇充分混匀,3000 r/min 离心15 min,将上清液过0.45 μm滤膜,准确进样20 μL,将出峰面积代入标准曲线回归方程计算总皂苷含量[27]。
1.2.3.5 总酚酸 参照Xiao 等[28]的研究方法稍作改动后测定。准确称取10 mg 没食子酸对照品配制成不同浓度的对照液。各取2 mL 标准液,准确加入0.5 mL 福林酚试剂,摇匀后再加入2 mL10%的碳酸钠溶液,定容至10 mL,75 ℃水浴10 min,冷却至室温后750 nm 下测定吸光度值,制作标准曲线。取2 mL 酒样按照上述方法进行吸光度值的测定,利用标准曲线计算总酚酸的含量。
1.2.3.6 重金属离子 按照国标GB 2762-2017《食品中污染物限量》中石墨炉原子吸收光谱法进行测定。
1.2.3.7 黄曲霉毒素B1 根据国标GB 5009.22-2016《食品中黄曲霉毒素B 族和G 族的测定》进行测定。
1.2.4 黄酒中的非挥发性有机化合物测定 样品处理:取300 μL 黄酒与700 μL 乙腈混匀,然后4 ℃,12000 r/min 离心15 min,取上清液用超纯水稀释10 倍,过0.45 μm 滤膜,于液相小瓶中备用。
色谱柱条件[29]:Waters Acquity UPLC BEH Amide 柱(2.1 mm×100 mm,1.7 μm);柱温:30 ℃;进样量:20 μL;流动相A:0.1%乙酸铵水溶液;流动相B:乙腈;梯度洗脱(流动相B):0~5 min 1%,5~15 min 1%~40%,15~25 min 40%~1%,25~30 min 1%。
质谱条件[30]:电喷雾离子源(ESI);离子源电压:3.2 kV;载气体积流量:40 L/min;离子源温度:320℃;裂解电压:300 V;数据采集范围:100~1500 m/z;采用Full MS-ddMS 模式在正负离子模式下扫描。
1.2.5 黄酒中的挥发性物质测定 直接进样样品处理:取1 mL 酒样,加入2 mL 乙醇,然后4 ℃,12000 r/min 离心15 min,上清液过0.45 μm 滤膜,放置于20 mL 气相小瓶中备用,进样量为4 μL。顶空进样样品处理:取1 mL 酒样,加入0.5 g 氯化钠,放置于20 mL 气相小瓶中备用,进样量为1000 μL。
根据王洪燕等[31]的方法确定色谱柱条件为CPWax 57 CB 毛细管柱(50 mm×0.25 mm,0.2 μm);进样口温度:190 ℃;分流比:19:1;柱温:38 ℃;载气:99.999%氦气;色谱柱流量:2 mL/min;程序升温:38 ℃保持3 min,4 ℃/min 升至46 ℃,8 ℃/min 升至70 ℃,10 ℃/min 升 至150 ℃,15 ℃/min 升 至190 ℃保持10 min,10 ℃/min 升至200 ℃保持2 min。质谱条件为电子电离源;离子源温度:200 ℃;接口温度:195 ℃;溶剂延迟:3 min;采用Q3 Scan扫描方式。
定量方法:采用峰面积归一化法计算挥发性物质的相对含量。采用外标法进行测定,将白酒标准样品(30 种白酒混标)用20%的乙醇溶液稀释100 倍,取2 mL 于气相小瓶中,按照上述直接进样方法进行测定,以标准样品中测得物质的峰面积为标准计算酒样当中对应物质的含量。
1.2.6 黄酒的抗氧化活性分析 将制得的两种黄酒用超纯水稀释成0.2、0.4、0.6、0.8、1.0 mL/mL 后,依次按照以下5 种方法进行测定。
1.2.6.1 铁氰化钾还原力实验 参照汪江波等[32]的方法进行测定并稍作改动。取上述浓度的样品溶液各0.1 mL,加入0.5 mL PBS 缓冲液和0.5 mL 1%的铁氰化钾水溶液,摇匀,50 ℃下水浴20 min,加0.5 mL 10%的三氯乙酸,3000 r/min 条件离心10 min,取0.5 mL 上清液于比色管中,加入0.5 mL 超纯水和0.1 mL 0.1%的三氯化铁水溶液,混匀后静置10 min,700 nm 下测定吸光度值。
1.2.6.2 羟自由基清除实验 按照林冰洁等[33]的方法进行测定。
1.2.6.3 DPPH 自由基清除实验 按照苏龙等[34]的方法进行测定。
1.2.6.4 Fe2+螯合实验 按照Decker 等[35]与赵文婷[36]的方法进行测定。
1.2.6.5 酪氨酸酶抑制实验 按照表1 配制反应体系,参照相关文献[27]进行测定,每个样品做三个平行。A~D 代表不同实验组下的吸光度值,酪氨酸酶抑制率的计算公式如下:
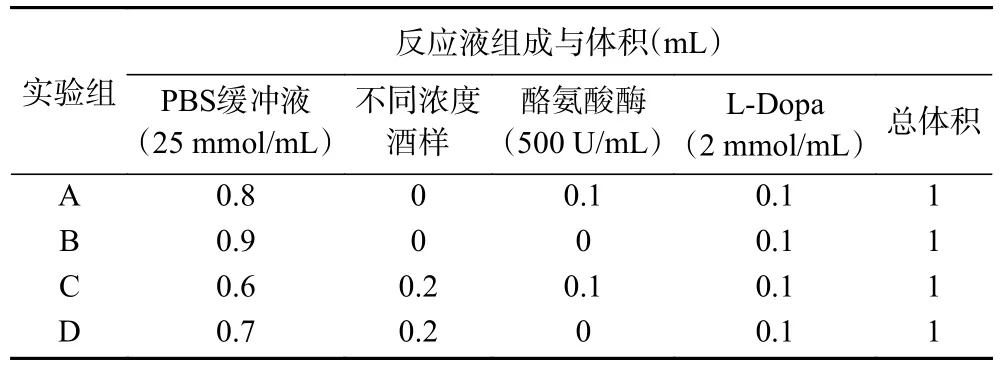
表1 酪氨酸酶抑制实验反应体系Table 1 Reaction system of tyrosinase inhibition experiments
1.3 数据处理
2 结果与分析
2.1 黄酒的理化指标及可能污染物测定
藜麦麸皮黄酒(SPQ)和普通黄酒(SP)的理化指标如表2 所示,SPQ 中皂苷和总酚酸含量明显优于SP(P<0.05),这是因为藜麦麸皮本身就含有一定量的皂苷和酚酸[15],除此之外其余理化指标均无差异。按照理化指标进行划分,两种黄酒均属于传统半干型黄酒。重金属离子检测方面选取了食品中较为常见的铅、铬、砷、汞,在两种黄酒中仅检测到铅(普通黄酒的铅离子含量为1.9×10-2mg/kg,藜麦麸皮黄酒中铅离子含量为1.3×10-2mg/kg)且两种酒样中铅离子含量也均小于国标限量(0.5 mg/kg),这可能是高粱、豌豆和藜麦在生长过程中吸收了来自土壤、大气中的铅所致,两种黄酒中也均未检测到黄曲霉毒素B1。
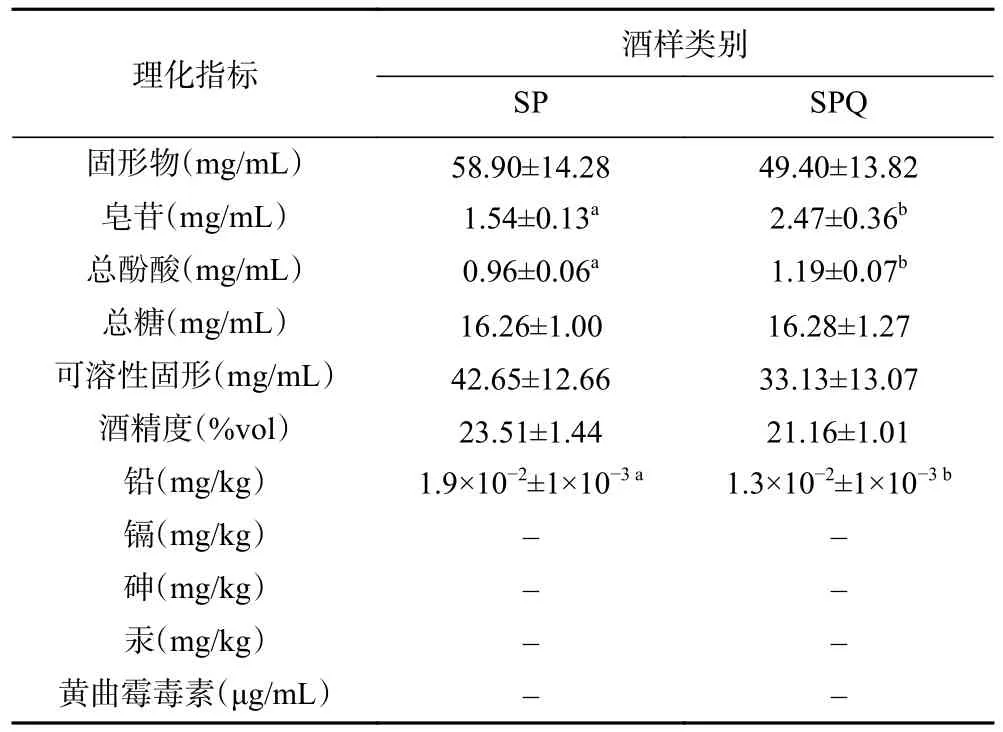
表2 黄酒理化指标Table 2 Physicochemical indexes of Huangjiu
2.2 黄酒中的非挥发性有机化合物差异分析
根据HPLC-MS 分析获得的两种黄酒中的非挥发性有机化合物制作的主成分分析散点图如图2a所示,该图反应样本之间的差异程度,样本之间聚合度越高说明样本相似性越高,反之,表明样本之间差异性越高。根据实验结果,第一主成分(PCA1)和第二主成分(PCA2)的贡献率分别为73.92%和10.34%,代表性较高。对数据进行中心化、归一化处理后发现两种黄酒对应的散点在组内呈现相互聚集的情况,说明组内重复性较好,而组间则有较好的区分度,说明两种黄酒中的化合物差异性较大,这可能是由酿酒辅料藜麦麸皮的加入引起的。火山图的横坐标(log2(FC))反应化合物在两个分组之间差异倍数,其绝对值越大,差异越大,红色代表差异上调,绿色代表差异下调。由图2b 所示,差异化合物共计48 种,其中上调增加23 种,下调减少25 种。其中log2(FC)>2 的化合物共计12 种,1<log2(FC)<2 的化合物有11 种;log2(FC)<-2 的化合物共计19 种,-2<log2(FC)<-1 的化合物共6 种。纵坐标-lg(P-value)反应化合物在两种黄酒之间差异的显著性,P值越小,代表差异越显著,对应的-lg 值就越大,图中纵坐标数值在1.3 以上的所有红色点和绿色点代表的化合物在两种黄酒中都具有明显差异。综上所述,在火山图的左上角和右上角的点分别代表差异非常显著的下调差异化合物和上调差异化合物。
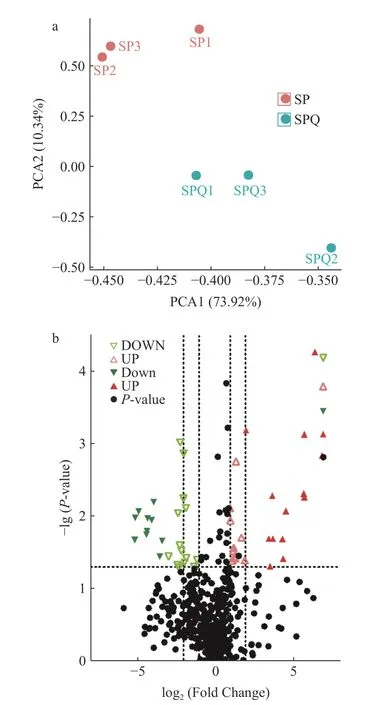
图2 两种黄酒化合物的主成分分析散点图和差异化合物火山图Fig.2 Principal component analysis scatter plot and volcano plot of different compounds in two kinds of Huangjiu
在利用HPLC-MS 对黄酒中的非挥发性有机化合物进行检测分析时,使用了亲水的氨基柱,分离得到48 种非挥发性有机化合物,根据非挥发性有机化合物含量绘制了热点分析图并进行聚类树状分析如图3,该图可以直观反映非挥发性有机化合物在两种黄酒之间的相对含量差异,颜色越红代表对应的非挥发性有机化合物在此样本中的含量越高。上轴树状图是对两种黄酒的聚类分析,左侧SP1、SP2、SP3 被聚类为一组(普通黄酒),右侧SPQ1、SPQ2、SPQ3被聚类为一组(藜麦麸皮黄酒),这说明两种黄酒三个平行样品的相似程度很高。左轴树状图是对差异化合物的聚类分析,两种黄酒的差异有机化合物主要被聚类为5 个组,由数据可视化颜色可知,第1 组和第4 组在两种黄酒中具有较好的区分度,第1 组化合物在SPQ 中的含量较低,其中N,N-二甲基-6-嘌呤胺的含量最低,第4 组化合物在SPQ 中的含量较高,其中L-苏氨酸二氢鞘氨醇的含量最高。
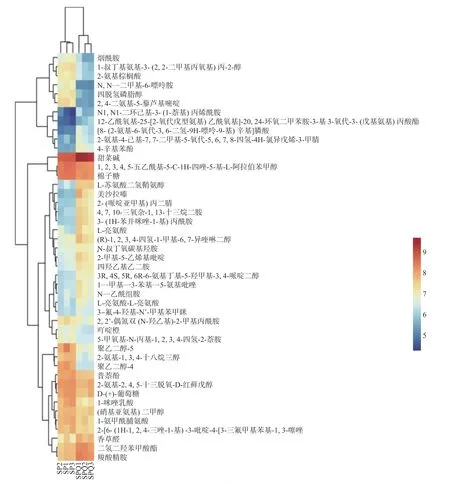
图3 两种黄酒差异化合物聚类分析热点图Fig.3 Cluster analysis hotspot map of different compounds in two kinds of Huangjiu
在48 种非挥发性差异化合物当中,数量最多的为醇类和酰胺类物质,均为10 种,其次为酸类物质4 种以及糖类物质2 种,以log2(FC)值和化合物生理功能等条件为依据,从48 种差异化合物中选取了21 种作为代表,如表3 所示,在藜麦麸皮黄酒中的含量高于普通黄酒的物质有14 种,包括L-亮氨酸、L-苏氨酸二氢鞘氨醇、香草醛、甜菜碱、5-氨基水杨酸等。其中,L-亮氨酸作为一种人体必需氨基酸,可以为机体提供能量,在调节蛋白质代谢,修复肌肉以及降低血糖等方面也有一定作用[37]。L-苏氨酸二氢鞘氨醇是一种PKC-α选择性抑制剂,具有抗肿瘤活性[38]。甜菜碱是一种具有维持细胞渗透压、转甲基、调节脂肪代谢等生理功能的活性物质[39]。5-氨基水杨酸可以治疗轻度、中度溃疡性结肠炎[40]。香草醛是一种特殊风味物质[41],具有香荚兰豆香气及浓郁的奶香,能起到增香和定香的作用。普通黄酒中含量高于藜麦麸皮黄酒的物质共计6 种,以糖类物质为主,相比于普通黄酒,藜麦麸皮黄酒中D-(+)-葡萄糖和棉子糖含量显著降低,其原因可能是加入藜麦麸皮促进了发酵过程中微生物对糖类物质的利用[42],而糖类物质含量的降低也是造成藜麦麸皮黄酒酒精度低于普通黄酒的重要原因,同时,糖类物质含量的降低也会影响高级醇的代谢途径,使高级醇含量降低。研究表明,适量的高级醇可以提高酒的品质,使酒体更加醇厚丰富,而过量的高级醇会有较强的致醉性和有害性[43]。由此可见,加入藜麦麸皮可使发酵后的黄酒拥有更好风味的同时也兼具一定的生物活性,同时饮用藜麦麸皮黄酒相比于普通黄酒更有利于人体健康。

表3 藜麦麸皮黄酒与正常黄酒差异化合物(局部)Table 3 Different compounds of quinoa husks Huangjiu and ordinary Huangjiu (portion)
2.3 黄酒中的挥发性物质
采用GC-MS 技术分别运用顶空进样和直接进样两种方式检测两种黄酒中的挥发性物质,结果如表4~表5 以及图4 所示,利用直接进样共测得12种物质,藜麦麸皮黄酒中有12 种,普通黄酒中有11 种,其中正丁醇只存在于藜麦麸皮黄酒中,其相对含量占比为10.05%,利用外标法测得正丁醇的含量为7.40 μg/mL。除此之外,标定出的物质还包括甲酸丁酯(SP 和SPQ 中含量分别为5.10、9.00 μg/mL)、乙酸(含量分别为4.40、4.50 μg/mL)、丁酸(含量分别为10.80、9.50 μg/mL)。通过各物质在气相色谱当中的峰面积来进行比较发现,在两者共同拥有11 种物质中,甲酸丁酯在藜麦麸皮黄酒中的含量显著高于普通黄酒(P<0.05),另外10 种物质在两种黄酒中均无统计学差异(P>0.05)。直接进样法测得的12 种物质中具有特殊风味的物质有3 种,分别是甲酸丁酯(4 号峰,占比分别为6.45%与11.31%),呈梅子香气和甜味。丁酸(14 号峰,占比分别为17.96%与15.14%),呈强烈的奶油和干酪香气。麦芽酚(17 号峰,占比分别为2.40%与1.95%),有似焦香奶油糖的特殊香气,稀溶液呈草莓香味。
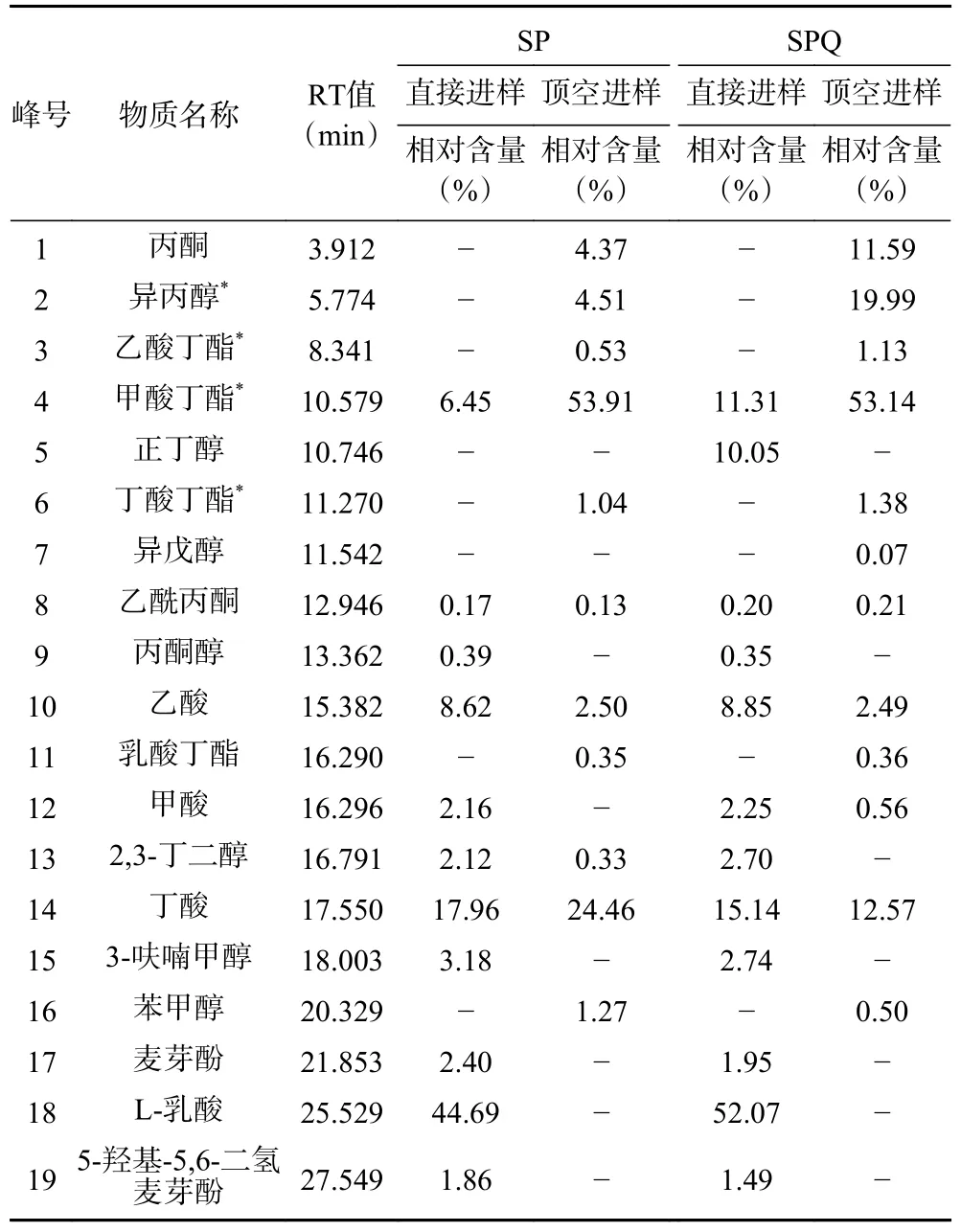
表4 藜麦麸皮黄酒和普通黄酒中挥发性物质的相对含量百分比Table 4 Relative contents of volatile substances in quinoa husks Huangjiu and ordinary Huangjiu

表5 藜麦麸皮黄酒和普通黄酒中部分挥发性物质直接进样定量结果Table 5 Quantitative results of some volatile substances in quinoa husks Huangjiu and ordinary Huangjiu
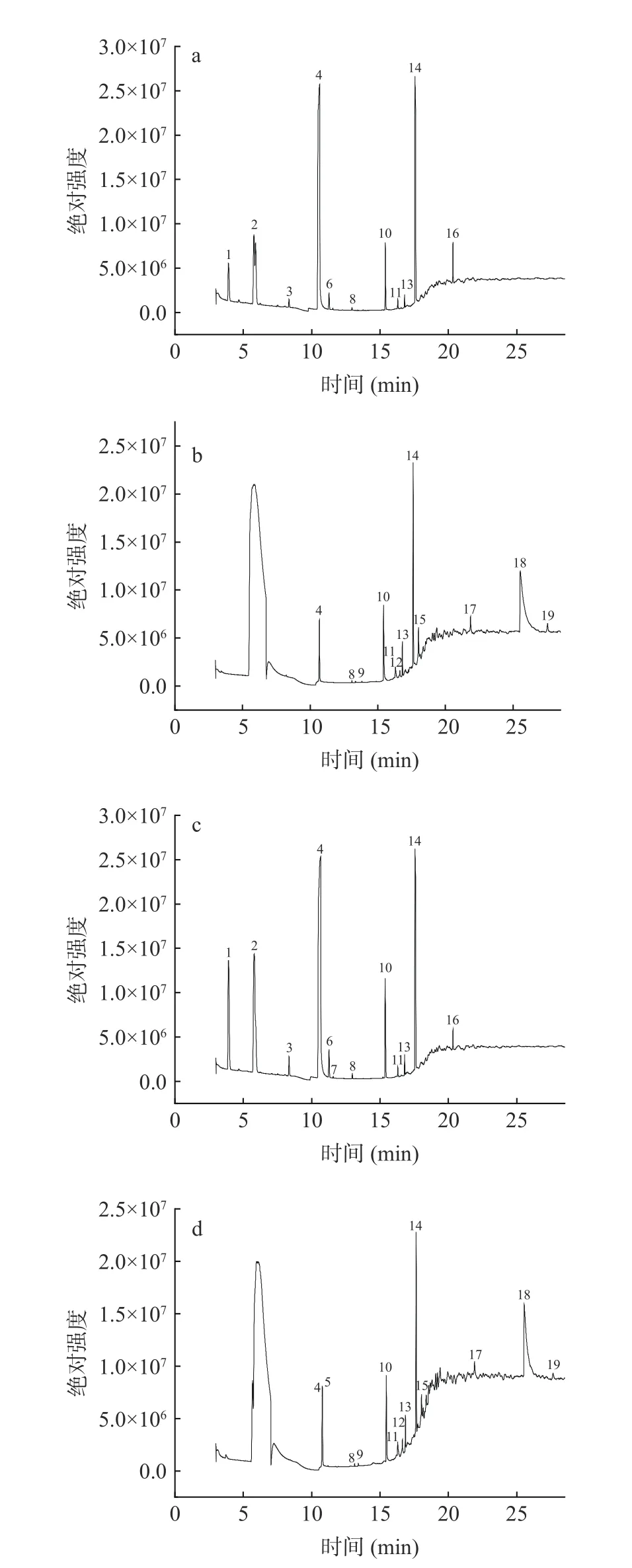
图4 黄酒挥发性物质气相色谱图Fig.4 Gas chromatograms of volatile substances of Huangjiu
顶空进样共测得12 种物质,藜麦麸皮黄酒中有12 种,普通黄酒中有11 种,其中只存在于藜麦麸皮黄酒中的为异戊醇,其相对含量占比为0.07%,异戊醇属于高级醇,它少量存在于藜麦麸皮黄酒中可以使酒体更加醇厚绵密,但过量的异戊醇可以使黄酒产生不良风味如汗臭味以及腐败味。通过各物质在气相色谱当中的峰面积来进行比较发现,在两者共同拥有11 种物质中,异丙醇、乙酸丁酯、甲酸丁酯、丁酸丁酯在藜麦麸皮黄酒中的含量显著高于普通黄酒(P<0.05),另外7 种物质在两种黄酒中均无统计学差异(P>0.05)。顶空进样法测得的12 种物质中具有特殊风味的物质有8 种,分别是丙酮(1 号峰,占比分别为4.37%与11.59%),呈薄荷似香味。异丙醇(2 号峰,占比分别为4.51%与19.99%),属于高级醇的一种,具有类似乙醇气味,可增强酒的风味口感。乙酸丁酯(3 号峰,占比分别为0.53%与1.13%),呈强烈香蕉香味。甲酸丁酯(4 号峰,占比分别为53.91%与53.14%),呈梅子香气和甜味。乳酸丁酯(11 号峰,占比分别为0.35%与0.36%),呈甜奶油香气和牛奶香味。苯甲醇(16 号峰,占比分别为1.27%与0.50%),呈微弱茉莉花香气。另外还有乙酸(10 号峰,占比分别为2.50%与2.49%)和丁酸(14 号峰,占比分别为24.46%与12.57%)。气相结果表明,藜麦麸皮的加入对黄酒中某些挥发性物质的相对含量影响较大,尤其是一些高级醇和脂类物质,其存在可能会改变黄酒的风味。
由于定量分析是以酒样当中的物质为基础,在利用直接进样和顶空进样的外标法进行定量分析时发现,采用直接进样的方法可以更直接的得到各物质的含量,方便快捷,适用于小批量样品的分析,而利用顶空进样的方法还需要测定出挥发性物质在气体和液体中平衡时的比值,换算成在酒样当中的具体含量,容易产生误差,所以本研究采用直接进样方法对黄酒中的挥发性物质进行标定。卫春会等[44]的研究中使用顶空固相微萃取-气相色谱质谱联用技术分析酒中的香气成分,效果较好。后续研究中会采用此方法进一部研究藜麦麸皮黄酒中的挥发性风味物质。
2.4 黄酒的抗氧化活性
2.4.1 铁氰化钾还原能力 由图5A 可知,两种黄酒的还原力表现出一定的浓度依赖性,均随着浓度的升高而增大,但SP 和SPQ 原液的还原力明显低于400 μg/mL VC。经计算,SP 与SPQ 对于铁氰化钾还原能力的IC50值分别为0.36 和0.41 mL/mL,SP 的铁氰化钾还原能力要强于SPQ,说明酿酒时加入藜麦麸皮并不能提高酒样的铁氰化钾还原能力。VC在100~400 μg/mL 之间呈良好的线性关系(Y=0.0054X+0.4095,R2=0.9937),经计算SP 和SPQ 原液的还原力分别相当于142.13 μg/mL VC和119.54 μg/mL VC。与顾逸菲等[45]的研究相比,藜麦麸皮黄酒的还原力优于2000 μg/mL 的发酵型枳椇子黄酒(VC当量为48.39 μg/mL)。
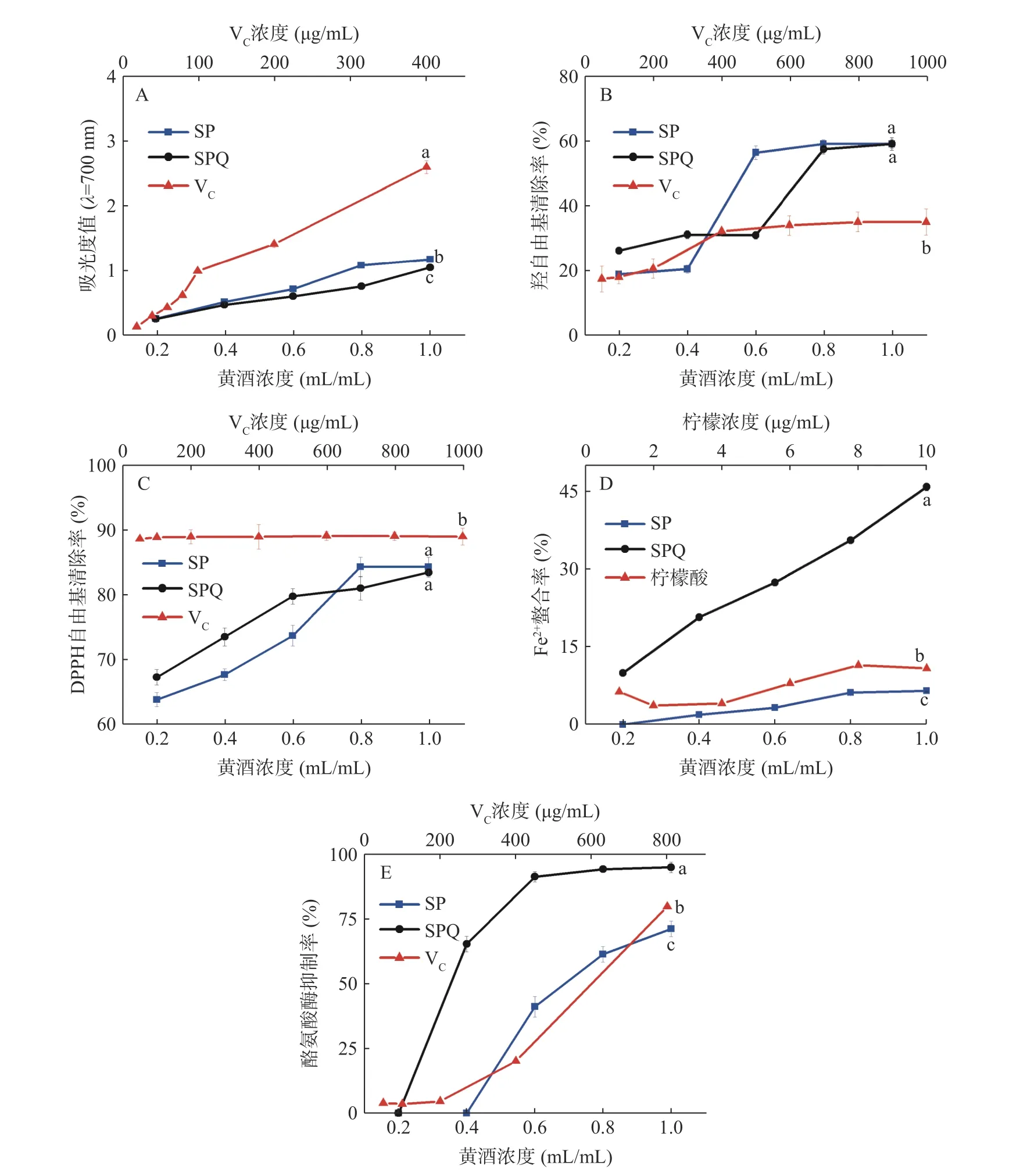
图5 黄酒的抗氧化活性测定Fig.5 Determination of antioxidant activity of Huangjiu
2.4.2 羟自由基清除能力 由图5B 可知,SP 在浓度为0.6、0.8 和1.0 mL/mL 时对羟自由基的清除率较高,SPQ 在浓度为0.8 和1.0 mL/mL 时对羟自由基的清除率较高。经计算,SP 与SPQ 对于羟自由基清除的IC50值分别为0.67 和0.79 mL/mL,SP 对于羟自由基的清除率要强于SPQ,说明酿酒时加入藜麦麸皮并不能提高酒样对于羟自由基的清除能力。与其他类型黄酒相比,乔晓月等[46]酿造的白藜芦醇丹阳黄酒对于羟自由基清除的IC50值为0.80 mL/mL,说明藜麦麸皮黄酒对于羟自由基的清除能力和白藜芦醇丹阳黄酒几乎相同。谢佳艺[47]酿造的香菇小米黄酒在浓度为1.0 mL/mL 时对于羟自由基的清除率为78.83%,明显要高于SP、SPQ 对于羟自由基的清除率(P<0.05),推测其原因可能是在酿造香菇小米黄酒时添加了香菇浆,与小米黄酒中的多酚等抗氧化成分发生协同作用,在一定程度上增强了小米黄酒的抗氧化能力[47]。
2.4.3 DPPH 自由基清除能力 由图5C 可知,两种黄酒均具有一定的DPPH 自由基清除能力,随着浓度的增加呈现先上升后平缓的趋势。经计算,SP 与SPQ 对于DPPH 自由基的清除的IC50值分别为0.11和0.05 mL/mL,SP 对于DPPH 自由基的清除能力稍弱于SPQ,说明酿酒时加入藜麦麸皮可以略微提高酒样对于DPPH 自由基的清除能力。与其他类型黄酒相比,李杰等[48]酿造的红小米黄酒的对于DPPH自由基清除的IC50值为0.45 mL/mL,说明藜麦麸皮黄酒对于DPPH 自由基的清除能力要强于红小米黄酒,这可能与藜麦麸皮黄酒中皂苷、黄酮类的物质含量较高有关[15]。韩惠敏[49]酿造的黑米黄酒在0.5 mL/mL 时对DPPH 自由基的清除率为82.11%±0.76%,与SP 和SPQ 原液的DPPH 自由基清除率相比不存在显著性差异(P>0.05),所以藜麦麸皮黄酒对于DPPH 自由基的清除能力弱于黑米黄酒,推测其原因可能是黑米黄酒中含有大量的花青苷[49]。
2.4.4 Fe2+螯合能力 由图5D 可知,两种黄酒与Fe2+的螯合率会随着黄酒浓度的增大而提高,SPQ 原液(1.0 mL/mL)的Fe2+螯合率达到了45.79%,明显高于SP 原液(6.51%)和10 μg/mL 柠檬酸(10.83%),经检验均有统计学差异。经计算,SP 与SPQ 对于Fe2+螯合能力的IC50值分别9.27 与1.28 mL/mL,SP的Fe2+螯合能力要弱于SPQ,说明酿酒时加入藜麦麸皮可提高酒样对于Fe2+的螯合能力,该发现还可为后续Fe2+螯合补铁剂的开发提供新的思路。
2.4.5 酪氨酸酶抑制能力 由图5E 可知,两种黄酒对于酪氨酸酶的抑制率呈现先急速上升后逐渐平缓的趋势,SPQ 和SP 对酪氨酸酶的IC50值分别为0.27 和0.69 mL/mL,SPQ 对酪氨酸酶的抑制能力要强于SP,说明酿酒时加入藜麦麸皮可以提高酒样对于酪氨酸酶的抑制能力,其原因可能是藜麦麸皮中含有大量可以抑制酪氨酸酶活性的皂苷[27],此外,黄酒本身含有的抗氧化活性物质可能与皂苷产生协同效果,使得藜麦麸皮黄酒对酪氨酸酶的抑制效果更佳。
3 结论
藜麦麸皮黄酒中的总皂苷及总酚酸含量分别为2.47±0.36、1.19±0.07 mg/mL,相对于普通黄酒,总皂苷、总酚酸含量有所提升(P<0.05)。利用HPLCMS 技术检测到黄酒中有48 种差异性非挥发性物质,其中在藜麦麸皮黄酒中含量更高的物质主要有醇类、氨基类、酰胺类等,其含量的升高可以提高藜麦麸皮黄酒的营养功能和活性功能,在藜麦麸皮黄酒中含量降低的物质主要是糖类,其含量的降低可以在一定程度上控制高级醇的产生,增强酒体风味口感的同时也保护人的健康。利用GC-MS 技术检测到12 种挥发性物质,其中异丙醇、甲酸丁酯、乙酸丁酯在藜麦麸皮黄酒中的含量显著高于普通黄酒,此外正丁醇和异戊醇仅存在于藜麦麸皮黄酒中,这些高级醇类和脂类物质可以使藜麦麸皮黄酒变得更加醇厚,提高藜麦麸皮黄酒的特殊风味。抗氧化实验表明,与普通黄酒相比,加入藜麦麸皮发酵的黄酒具有更好的Fe2+螯合能力(c=1 mL/mL 时,螯合率为45.79%)和酪氨酸酶抑制能力(c=1 mL/mL 时,抑制率为94.84%),藜麦麸皮黄酒的Fe2+螯合率和酪氨酸酶抑制率是普通黄酒的7.03 倍、1.33 倍。但在铁氰化钾还原能力、羟自由基清除能力方面,藜麦麸皮黄酒并不优于普通黄酒,造成差异的主要原因是藜麦麸皮中的多酚及黄酮类成分在酿造过程中释放到黄酒中。综合以上结果说明酿造藜麦麸皮黄酒存在可行性,在开发更具营养价值的黄酒以及提高藜麦麸皮的高值化利用方面具有较广阔的应用前景,但藜麦麸皮的加入是否会影响整个原料发酵体系的精白度仍需进一步探讨。后续将针对藜麦麸皮的添加量与发酵体系精白度之间的量效关系以及藜麦麸皮黄酒在发酵过程中微生物的优势菌群及多样性变化方面进行更加深入的研究,为酿造藜麦麸皮黄酒提供更加完善的理论依据。

