mTOR经由自噬途径对骨质疏松的作用影响
王茜 贾麒钰 刘泽彪 王鑫 郭建 阿卜杜萨拉木·阿力木江 马海蓉* 谢增如*
1新疆医科大学第一附属医院,新疆 乌鲁木齐 830054
2华北理工大学附属医院,河北 唐山 063000
1 骨稳态与骨质疏松症
骨稳态是指骨组织通过自身调节,维持骨形成和骨吸收之间的动态平衡,以适应外界的各种应激反应。这一过程由骨髓间充质干细胞(BMSCs)、成骨细胞(osteoblasts,OBs)、骨细胞和破骨细胞(osteoclasts,OCs)介导[1]。然而,当骨形成和骨降解之间的动态平衡被打破时,就会导致病理情况的发生。骨质疏松症 (osteoporosis,OP)是一种全身性骨退行性疾病,其最明显的两大特征是骨量的逐渐减少和骨力学性能的显著退化,最终导致骨脆性增加和骨折的发生[2]。
近期,中国疾病预防控制中心与中华医学会骨质疏松和骨矿盐疾病分会合作,开展了首次中国居民骨质疏松症流行病学调查。结果显示,50岁以上人群骨质疏松症患病率为19.2%,65岁以上人群骨质疏松症患病率达到32.0%[3]。此外,据相关研究报道,2015年中国主要用于骨质疏松性骨折的医疗费用为720亿元,预计到2035年将达到1 320亿元,将会给患者家庭和社会造成沉重的经济负担[4]。随着人口老龄化程度的日趋严重,骨质疏松症已成为中国面临的重要公共健康问题。目前,对于治疗OP 的药物存在治疗效果欠佳、副作用明显、无法改善成骨细胞增殖分化、难以逆转OP 进程等诸多问题[5]。因此,寻找新的治疗靶点针对OP进行靶向治疗以及挽救因OP所致的骨质流失不仅具有重大的科学意义,还存在显著的社会效益和经济价值。
2 mTOR、自噬与骨质疏松症的交联作用
自噬是真核生物进化过程中高度保守的细胞内分解代谢过程,对细胞内受损的蛋白质和细胞器加以循环利用[7]。在生理条件下,自噬促进细胞功能的发挥,在病理条件下则作为细胞保护反应发挥作用自噬过程包括:起始/成核、伸长、成熟、降解四个阶段。当自噬发生后,形成一种囊泡结构,延伸包裹部分的细胞质形成双膜小泡,即自噬体。随后,自噬体与溶酶体膜融合,将运送的“货物”输送到溶酶体内并进行降解。溶酶体将分解产生的氨基酸、脂肪酸等物质分泌到胞质中,用于物质和能量的合成[8]。研究发现,自噬在维持OBs和OCs的正常生理功能方面起着重要作用。它既能参与到破骨前体细胞向OCs分化时线粒体活性氧的生成环节[9],又可促进成骨前体细胞向OBs分化的过程[10]。
哺乳动物雷帕霉素蛋白(mammalian target of rapamycin,mTOR)是一种高度保守的激酶,是磷脂酰肌醇-3激酶(phosphotylinosital-3 kinase,PI3K)家族中的一员[11],也是调节细胞生长的控制中枢。其在两种不同的蛋白质复合体中作为催化亚单位发挥作用:mTOR复合体1(mTORC1)和复合体(mTORC2)[12]。mTOR通过整合多种信号来调节转录和蛋白质合成,进而影响细胞的凋亡、生长、自噬等生理过程[13]。研究表明,mTORC1可激活自噬启动激酶U1k1阻断AMPK的激活从而抑制分解代谢过程,特别是自噬过程[14]。此外,Martina等[15]学者发现mTORC1可通过抑制转录因子EB(TFEB)的核转位和活性来抑制自噬的发生。由此可知,mTOR与自噬之间存在着密切的联系。
近年来大量研究表明,mTOR与OP的发生密切相关,且通过自噬途径发挥调控作用[16-18]。mTOR通过整合自噬过程中的上游信号分子,使得mTOR信号通路激活或抑制,从而影响BMSCs/OBs介导的骨形成、成脂分化、骨细胞稳态和OCs介导的骨吸收,进而导致骨稳态的改变,促进或保护OP的发生[16]。目前,mTOR信号在自噬过程中发挥的多级调控作用是众多学者一致认可的。然而,对于mTOR是如何经由自噬过程将接收的信号转导至骨稳态过程,从而调节骨稳态的研究尚处于早期阶段。因此,深入了解mTOR通过自噬途径参与OP进展过程中所发挥的级联调控机制,能有效地帮助了解OP的发病机制,为OP的治疗提供更加全面的治疗思路,同时也有利于探究新的治疗靶点。
3 mTOR通过自噬途径对骨稳态的作用
3.1 mTOR在成骨细胞中的调控作用
正常生理情况下,自噬的水平对于维持OBs的存活至关重要。体外研究证实,自噬可以抑制氧化应激介导的OBs凋亡[19]。多项研究显示,mTOR信号不仅调节OBs的分化,还在OBs或成骨样细胞的增殖、凋亡、自噬、能量代谢和多效性功能中起到重要的调节作用[16,20]。张森等[21]利用VS-5584抑制剂(PI3K/mTOR激酶抑制剂)对OBs中PI3K/Akt/mTOR信号通路进行抑制,发现OBs中的线粒体功能明显下降,LC3-II(细胞自噬标志物)蛋白活性增加,增强了OBs的自噬。这表明mTOR在调节OBs的自噬水平对于其正常生存至关重要。Chen等的研究证明[22]骨合成因子Wnt7b通过PI3K-AKT信号激活mTORC1来促进成骨分化;而当靶向抑制mTORC1信号时,则会阻止Wnt7b诱导ST2细胞的成骨分化。Xian等[24]发现,胰岛素生长因子IGF-1通过激活mTOR信号来促进BMSCs的成骨细胞分化,从而维持适当的骨微结构和骨密度。类似地,周凡等[18]研究发现,连翘苷可以激活PI3K/AKT/mTOR信号通路,进而促进成骨细胞的自噬,并抑制其凋亡。近期研究发现,mTOR/Raptor-S6K1轴通过激活雌激素受体α来调节Runx2的表达促进成骨分化[25],表明S6K1是成骨细胞mTORC1的主要下游调节因子,揭示了mTOR/Raptor通过调节Runx2表达促进骨形成。
以上研究均表明,mTOR是多个骨合成代谢信号下游的共同效应器,并且通过自噬途径对成骨细胞的增殖和分化发挥关键调控功能。然而,尽管越来越多的研究集中于mTOR信号在骨稳态中的作用,并认为mTOR信号的调控可能是OP发病机制的潜在因素,但是关于mTOR上游信号分子的输入和激活mTOR下游信号通路的相应机制,以及mTORC1与mTORC2在骨稳态过程中发挥着怎样的调控功能尚不明确,仍需进一步的研究去阐明mTOR在骨稳态中的生物调控机制。
3.2 mTOR信号在破骨细胞分化和骨吸收中的作用
骨吸收是由终末分化的多核细胞和破骨细胞完成的,破骨细胞来自造血祖细胞,并从单核细胞分化而来。目前关于mTOR信号在破骨分化方面的研究进展远落后于成骨分化方面,所以mTOR信号在调节破骨细胞分化中的确切作用尚存在一些争议。Raptor是mTORC1的核心亚基,Zhang等[26]在特异性敲除Raptor的小鼠中发现,其表现为骨质减少、骨断裂增强。进一步从该小鼠骨髓来源的巨噬细胞中提取破骨细胞,发现破骨细胞的数量急剧增加。在细胞分子层面的研究中发现,mTORC1在破骨细胞中可以负调控活化B细胞的核因子κ-轻链增强子(NF-κB)和T细胞的核因子细胞质1(NFATc1)的表达。NF-κB和NFATc1是破骨细胞形成的关键转录因子,这表明mTORC1可以促进骨形成,当其缺失后可导致破骨细胞活化增加。Rictor是mTORC2的核心亚基,Liu等[27]发现在成骨前体中敲除Rictor基因会损害其成骨分化。Sun等[28]发现敲除Rictor的BMSCs中RANKL的表达显著下调,但OPG和M-CSF的表达均无显著变化。这表明mTORC2在BMSCs中通过调节RANKL的表达间接调控破骨细胞分化。近期一项研究表明[29],激活mTOR可抑制OCs的分化、融合和吸收活性,但会促进单核细胞和分化成熟的OCs的增殖。以上结论表明,mTOR可能对破骨细胞的分化具有直接和间接的调控作用,但是对于mTOR调控破骨细胞分化以及增殖的具体机制仍需进一步研究去阐明。
3.3 mTOR在成脂分化中作用
众所周知,骨稳态是多方面互相协同发挥作用的过程。据报道,过多的骨髓脂肪细胞产生可能是影响骨骼健康的一个重要的负面风险因素[30],这表明OP可能与骨髓中脂肪组织的增加有关[31]。许多体外研究证实,脂肪诱导因子抑制成骨;反之,骨诱导因子阻碍脂肪生成[32]。因此,在骨稳态过程中抑制骨髓成脂分化,同时促进成骨,可能也是针对OP的一种治疗思路。
核受体过氧化物酶体增殖物激活受体γ (PPARγ)是一种重要的转录因子。研究表明,mTORC1在PPARγ介导的脂肪形成中起关键作用。当OBs靶向过表达PPARγ时,小鼠的骨量显著减少,同时成脂分化增加。此外,体内研究也证实了这一观点,当成骨细胞特异性过表达PPARγ时,可以负性调节雄性小鼠的骨量,并加速雌性小鼠雌激素缺乏相关的骨质流失[33]。另外,Sun等[34]在靶向敲除PPARγ的小鼠中观察到骨小梁数增加,并在体外实验中发现MSCs和OBs中内源性 PPARγ可抑制mTOR信号通路下游因子S6k活性,导致成骨分化降低。这表明PPARγ可以通过直接和间接调控成骨分化和骨形成,其中直接调控涉及mTOR途径的PPARγ调节,而间接途径依则赖于脂肪生成的调节。
因此,基于mTOR信号在骨重建过程中的重要调控作用,开发针对mTOR靶点的药物对于OP以及OP性骨折的患者的治疗有着重大意义。
4 mTOR在骨质疏松症中的治疗潜力
如今,mTOR在骨骼生长和发育过程中的作用逐渐进入研究学者的视野。Shen等[35]对近年来的众多类型的临床证据进行整理发现,mTOR信号是各种疾病的新治疗靶点,如乳腺癌、结节性硬化症、系统性红斑狼疮、类风湿关节炎等。Tchetina等[36]在临床前研究中发现mTOR信号与骨丢失相关,在绝经后OP患者中发现自噬蛋白相关基因上调以及mTOR的下调。依维莫司(BOLERO-2)[37]是一种口服mTOR靶标抑制剂,用于治疗雌激素受体阳性乳腺癌的临床III期药物。Gnant等[38]在一项探索性分析中发现,BOLERO-2可以抑制骨转换水平,并降低乳腺癌骨转移的发生率,提示mTOR是骨骼调控的重要靶点。
综上所述,mTOR信号是调节骨稳态的重要靶点。本文综述了近年来mTOR信号在成骨、成脂以及破骨分化介导的骨稳态中的作用,强调mTOR信号在骨稳态中所发挥的调控作用。此外,mTOR与自噬密切相连,通过介导IGF、Wnt和BMP信号通路深度参与骨内稳态的调节,从而发挥调控BMSCs的成骨、成脂分化以及调节骨吸收的功能(图1)。因此,全面了解mTOR信号通过自噬途径在OP中的调控机制,探索在自噬过程中触发mTOR信号的上、下游效应物,并进一步阐明其在介导骨稳态过程中mTOR复合体的生理或病理功能,对于精准开发预防和治疗OP的药物具有重大科学意义和社会价值,这也必然是未来一段时间内的热点科学问题。
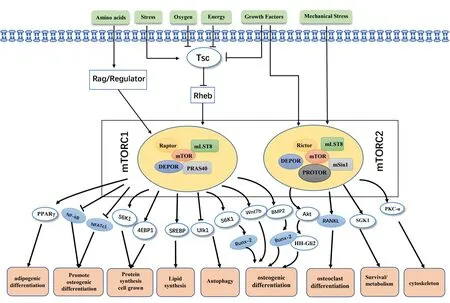
图1 mTOR信号分子转导示意图

