龟板抑制破骨分化改善骨质疏松性骨折
张鹏 陈弘林 伍子贤 余思瑶 招文华 尚奇 何嘉辉 陈桂锋 余富勇 梁德 江晓兵 任辉* 余翔,4*
1.广州中医药大学,广东 广州 510405
2.广州中医药大学第一附属医院,广东 广州 510405
3.广州医科大学第二附属医院,广东 广州 510260
4.广东省中医临床研究院,广东 广州 510405
骨质疏松性骨折(osteoporotic fracture,OF)作为骨质疏松症最严重的并发症,其发病率逐年升高,预计2035年我国髋部、椎体以及腕部OF约有483万例,至2050年将达599万例[1]。临床多使用骨吸收抑制剂来治疗OF,但这些药物的临床运用由于其使用过程中存在的并发症而受到限制[2]。近年来,中医药在治疗OF上展现出良好的疗效,国内外专家学者也逐渐开始关注这一领域[3-4]。
龟板(plastrum testudinis,PT)具有补肾强骨的功效,近年来对龟板抗OF的研究越来越多,但多集中在PT促进骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)成骨分化方面,研究表明龟板提取物及含药血清对大鼠BMSCs有促增殖作用,在临床上有较好的实际运用和发展前景[5]。网络药理学能从多分子、多靶点、多途径的角度阐述药物干预疾病的治疗原理[6]。因此,本文拟运用网络药理学和实验验证探讨PT治疗OF的潜在机制。
1 资料与方法
1.1 龟板化合物及靶点信息的获取
借助BATMAN数据库(http://bionet.ncpsb.org/batman-tcm/)寻找龟板的相关活性物质及其对应靶点,将阀值“Score cutoff”设置为10[7]。
1.2 骨质疏松性骨折靶点集及龟板治疗骨质疏松性骨折的潜在靶点获取
在GeneCards(https://www.genecards.org/)和OMIM(https://www.omim.org)数据库检索得到OF靶点集,并借助R软件将其与1.1中得到的靶点交集映射获取两者的交集靶点。
1.3 龟板治疗骨质疏松性骨折的靶点蛋白互作网络构建
将交集靶点输入至STRING数据库(https://string-db.org/),去除孤立蛋白后得到蛋白互作(protein-protein interaction,PPI)信息,并将其导入到Cytoscape 3.7.2(http://www.cytoscape.org/)软件构建PPI网络,借助网络拓扑学分析进一步筛选核心靶点。
1.4 龟板-活性成分-靶标-骨质疏松性骨折网络的构建
组建“龟板-活性成分-靶标-骨质疏松性骨折”四者之间的对应信息,将其导入至Cytoscape 3.7.2 软件进行网络可视化。
1.5 GO生物过程富集分析
交集靶点的GO生物过程(biological process,BP)富集分析通过R软件完成,以点状图的形式展示显著性排在前20的富集条目。此外,将交集靶点导入Cytoscape 3.7.2 软件中进行GO.BP富集分析,筛选出主要与OF相关的生物学过程(P<0.05),可视化展示上述生物学过程及其对应的交集靶点。
1.6 KEGG通路富集分析
同样利用R软件对交集靶点进行KEGG分析,将富集得到的信号通路(P<0.05)按照显著性进行排序展示,并构建“通路-靶标”之间的对应关系,通过Cytoscape 3.7.2软件进行网络可视化展示[8]。
1.7 实验验证
1.7.1实验动物:SPF级雌性SD大鼠30只,购自广州中医药大学医学实验动物中心。所有动物实验均经广州中医药大学第一附属医院伦理委员会批准(No.TCMF1-2021068)。
1.7.2实验试剂:重组人RANKL(6449-TEC)购于美国R&D Systems公司,重组人M-CSF(11792-H08Y)购于北京义翘神州科技股份有限公司,抗酒石酸酸性磷酸酶(TRAP)染色试剂盒购于美国Sigma公司,胎牛血清(FBS)、α-MEM培养基购于赛业生物科技有限公司,CCK8试剂购于上海碧云天生物技术有限公司,龟板购于广州中医药大学第一附属医院(批号:KG37243537)。
1.7.3龟板水提液的制备:参照本课题组前期研究基础[9]。100 g龟板粉碎后,加1 L纯水,微沸1 h,获得提取液,剩余药渣重复操作微沸2次后获得提取液。所有提取液0.22 μm过滤除菌,分装并密封后放置于-80 ℃冰箱保存。
1.7.4OF大鼠模型的构建及龟板的干预:将30只雌性SD大鼠随机分为3组:假手术组、OF组和OF+PT组,每组10只。其中假手术组仅予术口切开,生理盐水灌胃;根据既往报道的方法[10],OF组大鼠去除双侧卵巢3个月后,于L6椎体侧造一直径为3 mm、深度为3 mm的圆形骨缺损,以模拟骨质疏松性椎体骨折后局部骨缺损状态;OF+PT组予构建大鼠L6椎体OF模型,龟板水提液灌胃,灌胃浓度按照人和动物间体表面积折算的等效剂量比值换算为:3.15 g/(kg·d)。造模成功后,灌胃治疗4周后处死各组大鼠并取材,取L6伤椎行micro-CT、HE染色评估OF模型大鼠骨缺损愈合的情况。
1.7.5实验细胞培养:所有临床实验均通过本院伦理委员会的批准(No.K[2019]129)。在本研究中,从确诊为OF[11-12]的男性患者(n=3)中取外周静脉血10 mL,均经患者知情同意。根据文献报道的方法[13],从血液样本中提取人外周血单核细胞(human peripheral blood monocytes,HPBMs)进行培养。
1.7.6CCK8法检测龟板对HPBMs活性的影响:取HPBMs以1×104/孔的密度接种于96孔板中,培养24 h后分为对照组和龟板干预组,对照组加入含25 ng/mL M-CSF的α-MEM培养基,龟板干预组加入含不同浓度梯度的龟板水提液和25 ng/mL M-CSF的α-MEM培养基,共设置5、10、20、30 μg/mL 4个浓度梯度,置于培养箱中继续培养,分别于给药后0、1、3、5、7 d取出1块培养板,检测HPBMs的吸光度值(OD 450 nm)。
1.7.7TRAP染色鉴定龟板对HPBMs破骨分化的影响:取HPBMs以2×105个/cm2的密度接种于24孔板中,选取CCK8法检测得到对HPBMs无细胞毒性的龟板水提液浓度进行干预,即用含25 ng/mL M-CSF、50 ng/mL RANKL及不同浓度龟板水提液的培养液诱导培养,隔天换液。干预10 d后进行TRAP染色,将具有3个以上细胞核,且细胞质染成酒红色的细胞定义为TRAP染色阳性(TRAP+)的成熟破骨细胞。
1.8 统计学分析
2 结果
2.1 龟板成分及作用靶点信息
通过BATMAN数据库检索去重后得到龟板6个活性成分,包括苯丙氨酸(Phenylalanine)、甲硫氨酸(Methionine)、苏氨酸(Threonine)、碳酸钙(Calcium Carbonate)、亮氨酸(Leucine)、天冬氨酸(Aspartic Acid),以及342个作用靶标。
2.2 龟板治疗骨质疏松性骨折的潜在靶点获取
共获得OF相关靶点840个,与 342个PT靶点交集映射得到34个交集靶点。交集靶点信息见表1。
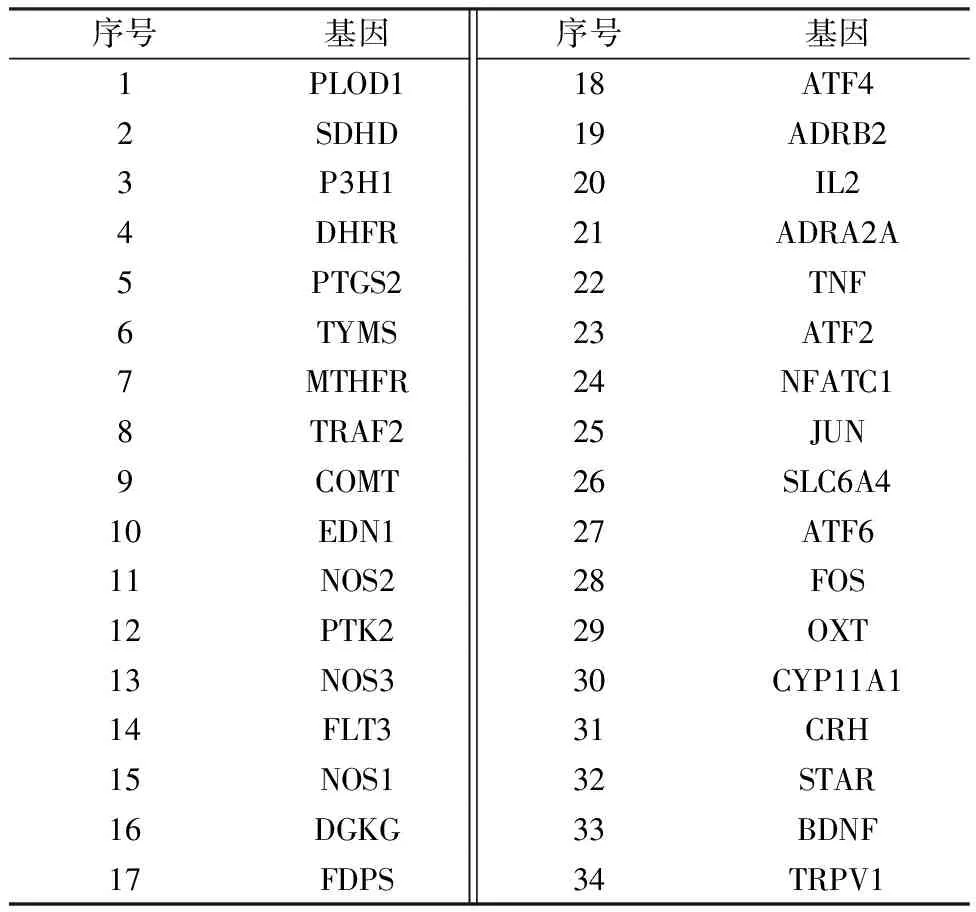
表1 龟板治疗骨质疏松性骨折的潜在靶点基因
2.3 PPI网络和龟板-活性成分-靶标-骨质疏松性骨折网络构建
交集靶点构建的PPI网络图共涉及32个节点,126条边。该网络中有17个靶点蛋白的度值超过平均值(7.875),视其为核心靶点,详见表2。龟板-活性成分-靶标-骨质疏松性骨折网络图由42个节点和79条边组成,线条代表龟板、活性成分、作用靶点和骨质疏松性骨折之间的对应关系,网络拓扑学分析提示度值排名前3位的核心活性成分为苯丙氨酸(Phenylalanine,度值=21)、甲硫氨酸(Methionine,度值=9)、苏氨酸(Threonine,度值=4)。
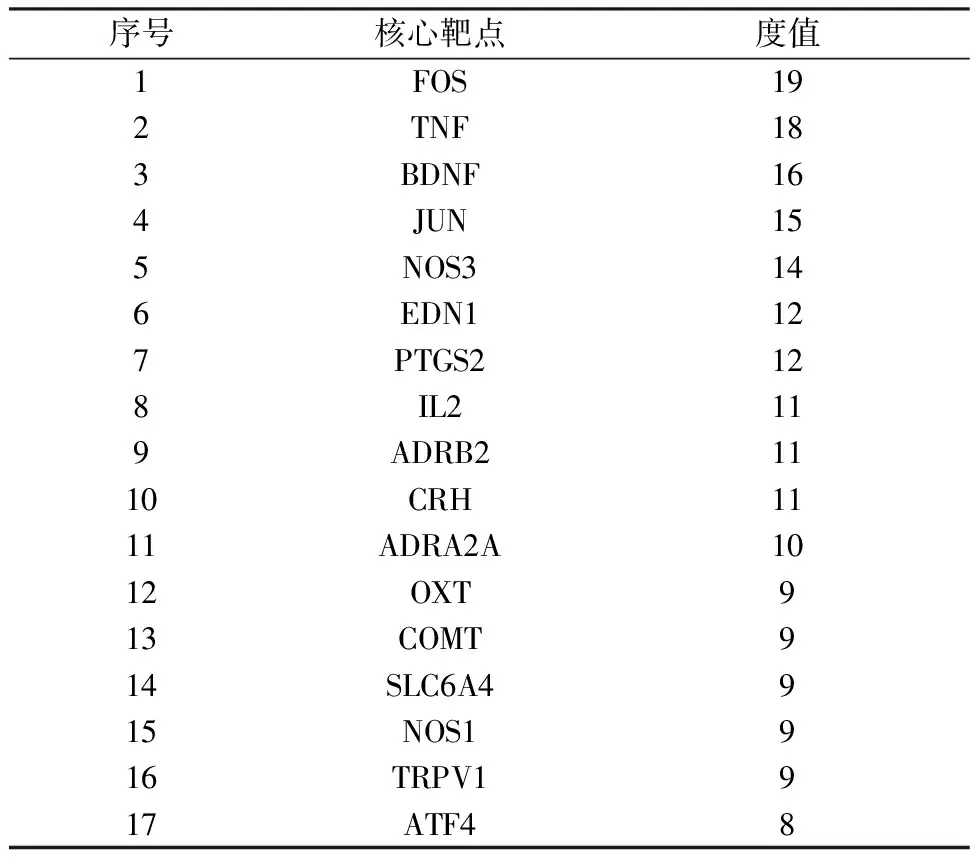
表2 龟板治疗骨质疏松性骨折的核心靶点
2.4 GO.BP富集分析
GO.BP富集分析共获得802个结果,主要涉及破骨分化的调节、氧化应激反应、糖皮质激素反应、NF-κB信号的正向调控、雌激素反应、凋亡信号通路的调控等。此外,利用Cytoscape 3.7.2进行交集靶点的GO.BP富集分析并筛选与OF密切相关的结果,主要涉及调节炎症反应、激素代谢及细胞周期等生物过程。
2.5 KEGG分析
使用R软件对34个靶点基因进行KEGG分析,共得到67个结果,主要涉及与破骨分化、炎症反应、激素代谢密切相关的通路。筛选得到相关信号通路共有22条,详见表3。

表3 富集的信号通路
2.6 Micro-CT及HE染色检测龟板对OF模型大鼠骨缺损愈合的影响
如图1所示,micro-CT结果提示龟板可有效治疗大鼠骨质疏松性椎体骨折骨缺损,HE染色结果显示龟板干预4周后可有更多骨形成,促进OF大鼠椎体骨折骨缺损愈合。

图1 龟板干预4周后micro-CT和HE染色结果
2.7 CCK8检测龟板对HPBMs增殖的影响
通过CCK8法检测发现,龟板水提液浓度在不超过10 μg/mL的情况下对HPBMs无细胞毒性,见图2。
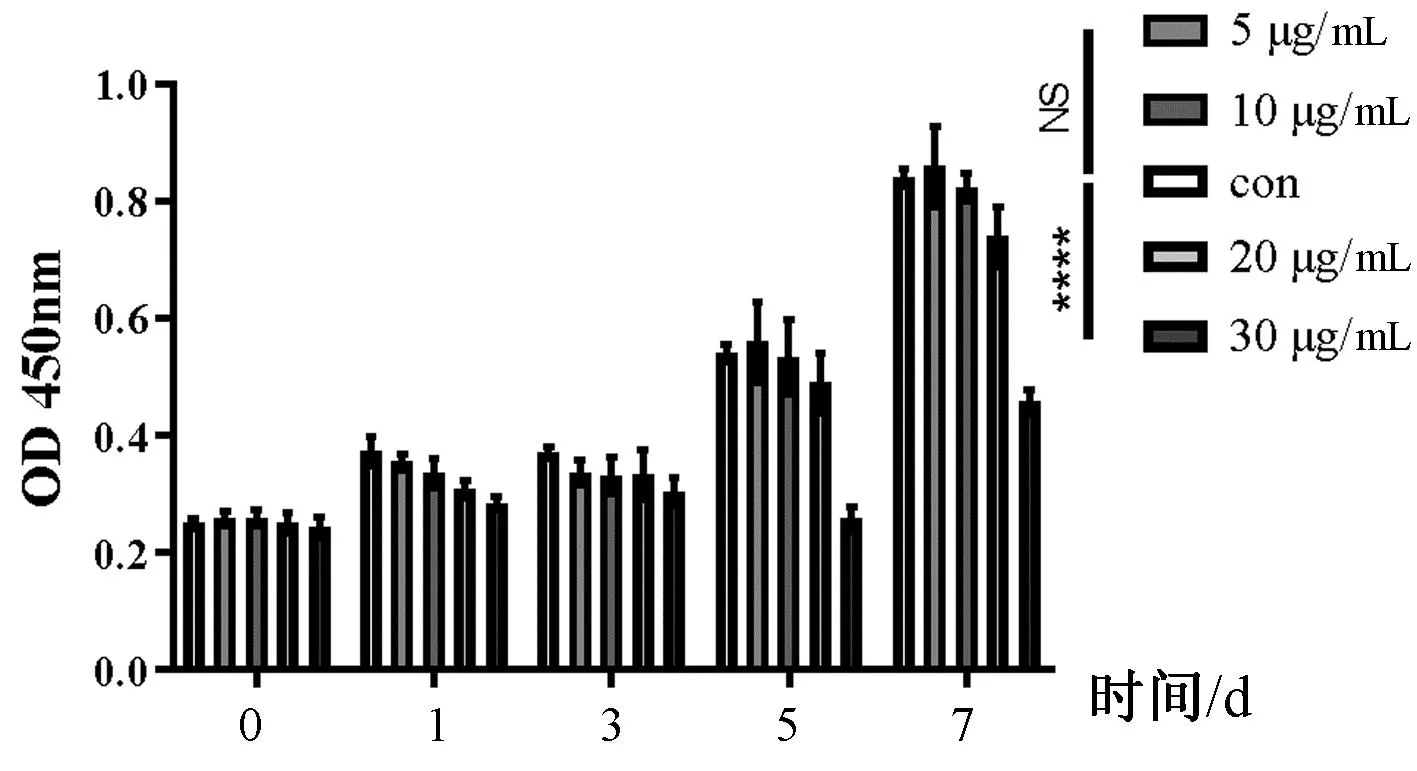
图2 CCK8 检测结果
2.8 TRAP染色鉴定龟板对HPBMs破骨分化的影响
在不影响HPBMs增殖的相应浓度龟板水提液干预下,发现随着龟板水提液浓度的增加,成熟破骨细胞的数量明显减少(图3),差异具有明显的统计学意义(P<0.000 1),这证明龟板能够抑制RANKL诱导的HPBMs破骨分化。
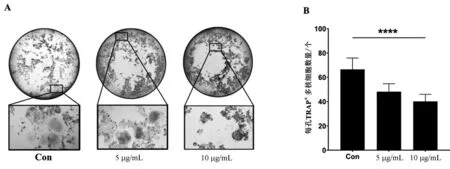
图3 TRAP染色分析及量化
3 讨论
3.1 活性成分、靶标与PPI网络分析
通过对龟板-活性成分-靶标-骨质疏松性骨折网络图进行分析,发现龟板6个活性成分分别调控34个靶点影响其对骨质疏松性骨折的治疗机制。如血浆苯丙氨酸(Phenylalanine)浓度升高可能会对骨骼状况有不利影响,降低骨强度,增加骨折的风险[14]。苏氨酸(Threonine)是AKT(丝氨酸/苏氨酸蛋白激酶)的蛋白底物,活化的AKT磷酸化苏氨酸等多种底物参与调节成骨、破骨细胞信号转导中发挥重要作用的PI3K/AKT通路,影响成骨、破骨细胞的增殖、分化及凋亡,进而影响骨密度[15]。碳酸钙等矿物元素是机体骨代谢平衡的重要底物,可增加骨钙含量和骨密度,对OF有较好的防治作用[16]。
经PPI网络筛选后得到度值位列前三的作用靶点为FOS、TNF、BDNF,推测它们可能在龟板治疗OF过程中起到关键作用。FOS是c-fos基因转录产物编码的蛋白,在调控细胞分裂、增殖、分化、凋亡等方面具有重要作用[17]。FOS与破骨细胞关系密切,FOS表达受抑制时破骨细胞数量随之减少[18]。此外,FOS可通过影响RANKL-RANK介导的破骨细胞生成信号传导途径,抑制破骨细胞生成[19]。因此,FOS对调节骨折愈合骨形成和骨吸收起着重要作用[20]。TNF与炎症反应密切相关,可诱导M-CSF的表达,NF-κB因子可被其激活进而启动RANKL诱导的破骨细胞形成过程,增强骨吸收[21]。BDNF(脑源性神经营养因子)与骨的发育有着密切的联系,BDNF能促进破骨细胞增殖分化[22]。另外,BDNF和IGF-1具有协同作用,它们共同调节ERK/p38 MAPK通路活性,促进软骨细胞增殖和分化[23]。同时,有研究显示BDNF基因可能通过MAPK通路调控成骨分化[24]。
3.2 GO和KEGG分析
GO分析结果所反映的内容类似于PPI网络规律,多涉及炎症反应、激素代谢和细胞周期(如破骨细胞分化)的调节。而KEGG分析结果反映的内容也印证了PPI网络拓扑学分析及GO分析结果所展现的规律。例如,TNF信号通路的相关研究表明,炎性因子TNF-α可促进RANKL表达,诱导破骨细胞形成[21]。MAPK信号通路可通过促进骨保护素(OPG)表达[25],进而与RANK竞争性结合RANKL,最终导致破骨细胞的凋亡[26];Estrogen(雌激素)信号通路可以协同Wnt等多条信号通路共同调控成骨细胞和破骨细胞的增殖、分化和凋亡[27]。
3.3 体内外实验分析
近年来对龟板抗OF的研究越来越多,针对其起效机制的研究也主要集中于促进BMSCs成骨分化方面[5],对于龟板影响破骨分化的机制鲜有报道。而本文通过网络药理学研究结果发现,对破骨分化的调节可能是龟板抗骨质疏松性骨折的重要机制。为了验证网络药理学研究结果的可靠性,本研究开展了动物实验,证实龟板可有效治疗OF模型大鼠的骨缺损,并且通过体外实验首次探究了龟板干预下的OF患者HPBMs表型,发现龟板能显著抑制HPBMs破骨分化。
综上所述,本研究结果提示龟板可能通过多种化合物、靶点和通路调节炎症反应、激素代谢及细胞周期来治疗OF,其中抑制破骨分化可能是龟板抗OF的重要机制。

