龟板促骨髓间充质干细胞肝脏归巢的作用研究
韩克强,李 靖,梁 平,郑 璐,黄小兵 (第三军医大学新桥医院肝胆外科,重庆400037)
既往研究提示,骨髓间充质干细胞(mesenchymal stem cells,MSCs)是肝脏损伤时参与调控肝修复重建的关键因素之一,在肝脏部分切除术后再生,肝纤维化后修复等病理生理过程中发挥重要作用[1]。而龟板是中医治疗肝损伤的各种方剂重要组成部分,中医临床实践已经证实其对促进肝脏再生、修复均有较好的疗效,但是对于其治疗机制一直不够清楚[2]。本研究通过动物在体研究了龟板饲养对MSCs 肝脏归巢的影响,旨在为促进肝脏部分切除术后再生、急慢性肝损伤修复的研究提供新的思路。
1 材料与方法
1.1 骨髓间充质干细胞(MSCs)培养、标记及移植
按张刚庆等[3]方法,脱颈法处死雄性SD 大鼠,取双后肢股骨,DHanks液吹吸骨髓,DMEM-L培养基稀释。密度梯度离心法收集单个核细胞,PBS 洗 2 次后接种于 24 孔板内,以DMEM-L(含10%FBS)培养基,在5%CO2,37 ℃饱和湿度下培养,待细胞生长至瓶底90%融合时,2.5 g/L 胰蛋白酶消化,按1 ×104cm-3传代培养,收集第 3 ~4 代 MSCs 用于后续实验。分别以携带大鼠c-met siRNA 的腺病毒Ad-si/c-met 及空腺病毒载体vector(均由江苏省分子医学生物技术重点实验室惠赠)转染MSCs,腺病毒均携带绿色荧光蛋白GFP,扩增培养后消化、收集,生理盐水重悬后制成单细胞悬液。按移植细胞不同,分为Ad-si/c-met MSCs 移植组、空病毒对照移植组及假手术组,Ad-si/c-met MSCs 移植组取转染了 Ad-si/c-met 的 MSCs 悬液1 mL(含细胞数约1.0 ×106),经大鼠尾静脉注射移植,以同样方式注入等量转染了vector 的MSCs 作为空病毒对照移植组,以同样方式注入生理盐水作为假手术对照。单纯移植MSCs 时,均以携带GFP 蛋白的腺病毒转染作为移植细胞标记。移植MSCs 均2 d 注射1 次,1 周后处死动物观察相关指标。
1.2 实验动物准备及分组
6 ~8 周龄雄性 SD 大鼠(体质量 200 ~250 g)购自第三军医大学实验动物中心。采用水煎法制备含龟板生药量1 kg/L的水煎液,根据成人日服药量10倍折算成大鼠灌胃剂量,4g/kg,灌前稀释成4 mL。根据是否服用龟板水煎液分为龟板组和普食组,2 组均常规饲养,龟板组每天给予龟板口服液4 mL,分上午、下午2 次灌胃1 周;普食组则给予等体积蒸馏水灌胃。
1.3 Western blot 检测 HGF、c-met 蛋白
组织总蛋白提取:脱颈处死动物,取各组肝脏组织100 mg。加入1 mL 冰预冷的蛋白提取液和10 μl PMSF,然后在冰浴上用玻璃匀浆器匀浆。将样品转入1.5 mL EP 管中,4 ℃,20 000 r/min 离心15 min,收集上清。细胞总蛋白提取:4 ℃预冷的PBS 洗细胞3 次,加入预制的含 PMSF 裂解液,冰上裂解30 min,裂解后,用干净的刮棒将细胞碎片和裂解液移至离心管中。4 ℃,16 000 r/min 离心20 min,收集上清。取其中少量测蛋白浓度(BCA 法),其余分装冻存。取等量预处理的蛋白样品上样,恒压60 V 进行 SDS-PAGE 电泳,电转至 PVDF 膜,5%脱脂奶粉-PBST 室温封闭1 h 后,加入羊抗大鼠 HGF 抗体(1︰1 000)、羊抗大鼠 c-met 抗体(1︰1 500)、羊抗大鼠 GAPDH(1︰1 000)、4 ℃孵育过夜,再与 HRP 标记的兔抗羊 IgG 37 ℃孵育1 h,按ECL 发光试剂盒说明书操作,凝胶成像仪(美国Bio-Rad 公司)曝光、照相。目的蛋白量以GAPDH 相对量表示。
1.4 激光共聚焦检测肝脏MSCs 含量
取肝脏组织,做冰冻切片,4%多聚甲醛固定后PBS 洗涤3次,封片。移植MSCs 中均表达GFP,直接激光共聚焦显微镜下观察MSCs 分布(绿色荧光细胞)情况,每张切片随机选10 个视野,计数MSCs 的数量。
1.5 统计学方法
使用SPSS 13.0 软件进行统计分析,定量资料采用均数±标准差(±s)进行描述。2 组间比较使用t 检验,3 组间比较使用单因素方差分析。
2 结果
2.1 龟板水煎液饲养对移植MSCs 肝脏归巢的影响
激光共聚焦法检测定植于肝脏组织MSCs 数量。根据是否使用龟板水煎液饲养及是否移植MSCs,分为龟板移植组,普食移植组,龟板假手术组,普食假手术组。每个视野下MSCs 平均数:龟板移植组(22.62 ±2.03)较普食移植组(15.34 ±1.87)明显增加,差异有统计学意义(P <0.05)。龟板假手术组及普食假手术组均未检测到移植MSCs。
2.2 龟板水煎液饲养对大鼠肝脏HGF 蛋白表达的影响
Western blot 检测龟板移植组、普食移植组、龟板假手术组、普食假手术组肝脏组织HGF 蛋白水平,分别为:龟板移植组(0.64 ± 0.04),普食移植组(0.41 ± 0.03),龟板假手术组(0.60 ±0.05),普食假手术组(0.36 ±0.02)。在正常大鼠及受体大鼠中,龟板水煎液饲养均明显增加肝脏HGF蛋白水平(图1)。
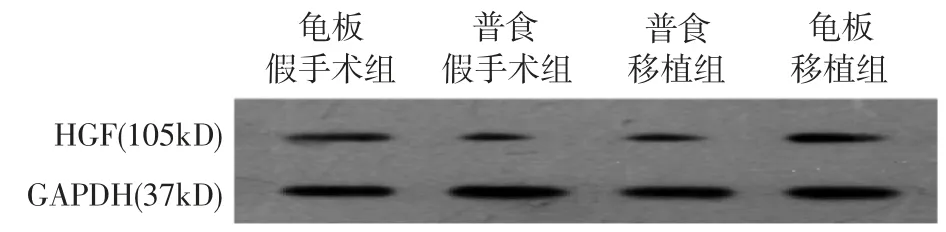
图1 Western blot 检测肝脏组织HGF 蛋白水平
2.3 阻断HGF/c-met 对MSCs 肝脏归巢的影响
使用HGF 受体c-met 的siRNA 腺病毒转染移植MSCs,Adsi/c-met 转染组 c-met 蛋白水平(0.12 ±0.01)明显低于空病毒转染组(0.52 ±0.04)及未转染组(0.54 ±0.05),差异有统计学意义(P <0.05)。同时,各组肝脏组织每个视野下MSCs 平均数:龟板 Ad-si/c-met 转染组(14.84 ± 1.84),龟板空病毒转染组(21.89 ±1.95),龟板未转染组(22.51 ± 2.67)。提示 Ad-si/c-met 转染MSCs 可明显减少龟板水煎液饲养诱导的移植MSCs肝脏归巢。
3 讨论
本研究发现,龟板水煎液饲养与普通饮食相比,可促进静脉移植的MSCs 向肝脏定植,即增加MSCs 的肝脏归巢。龟板是龟科动物乌龟的腹甲,既往研究发现龟板的醋酸乙酯部位分离出来的成分含有地塞米松类似的甾类成分,甾类化合物主要是甾醇脂和甾酮类。具有促进干细胞增殖、迁移等多种作用。近来的研究发现,给予龟板口服液后能促进循环中的MSCs 在损伤脊髓内存活和增殖,减轻脊髓损伤和脑缺血后神经损伤和病理改变,并增强神经干细胞增殖。龟板亦能增强MSCs 移植后分化为神经元。在脑缺血的大鼠给予移植MSCs 并给予龟板口服液,和没有给予龟板口服液的大鼠比较能明显促进MSCs 在缺血脑纹状体内存活和增殖,且能增强MSC 移植后分化为神经元[4]。这些发现均证实,龟板可以影响干细胞的增殖分化并进而参与器官的损伤和修复。除增殖分化能力外,组织特异性的归巢是影响干细胞移植治疗效果的另一重要因素,本研究的发现为寻找促进MSCs 肝脏归巢提供了新的思路。
龟板的化学成分复杂,同时MSCs 趋化、迁移的影响因素众多,因此阐明龟板促MSCs 肝脏归巢的机制相对复杂[5-6]。但近来研究发现,肝细胞生长因子及其唯一受体c-met 在介导干细胞优势分布中扮演重要角色[7]。本研究通过检测肝脏组织局部HGF 水平发现,龟板饲养可增加肝脏组织的HGF 含量,推测HGF 表达增高可能与MSCs 肝脏归巢增多关系密切。通过基因沉默技术低表达移植 MSCs 的 c-met,部分阻断HGF/c-met 轴后,发现c-met 低表达可明显减弱龟板饲养诱导的MSCs 肝脏归巢。HGF 是间质细胞衍生的一种促进细胞有丝分裂多功能因子,具有较强的抗凋亡、抗纤维化,促进血管再生,调节细胞生长和运动,促进多种细胞组织形态的发生的作用,在组织形成、损伤修复中起着重要的作用。HGF 配体为c-met,已经证实 MSCs 表达 c-met[8]。HGF 和 c-met 二者结合后有三条主要的信号途径,分别是PI3K/Akt、P38MAPK 和ERK,且在干细胞内均可表达和活化[9]。Kucia 等[10]发现,在缺血性脑损伤的小鼠模型中,HGF 诱导骨髓干细胞向损伤的神经组织分布并促进神经组织再生,将骨髓干细胞用抗c-met 抗体预处理后,可减少骨髓干细胞向损伤的神经组织分布。Trapp 等[11]研究也同样发现,HGF/c-met 能够介导扩增的骨髓间充质干细胞向损伤组织的优势分布。提示HGF/c-met 轴能够介导干细胞的靶向分布。
综上所述,我们的研究提示龟板治疗可能通过HGF/c-met 轴介导MSCs 优势分布于肝脏组织。但龟板水煎液成分复杂,对其有效成分的探讨,及其在细胞模型中的作用还有待下一步细胞实验研究。
[1]Hwang S,Hong HN,Kim HS,et al.Hepatogenic differentiation of mesenchymal stem cells in a rat model of thioacetamide-induced liver cirrhosis[J].Cell Biol Int,2012,36(3):279 -288.
[2]Chen DF,Zeng HP,Du SH,et al.Extracts from Plastrum testudinis promote proliferation of rat bone-marrow-derived mesenchymal stem cells[J].Cell Prolif,2007 40(2):196 -212.
[3]张刚庆,方驰华,池达智,等.共同培养诱导骨髓基质干细胞向肝细胞分化的研究[J].中华肝脏病杂志,2005,13(9):648 -651.
[4]杜少辉,陈东风,李伊为,等.龟板对脑缺血大鼠骨髓间充质干细胞移植后转分化为神经元的影响[J].中华医学杂志,2005,85(3):205 -207.
[5]李熙灿,谢学明,黄春花,等.龟板醇提物对大鼠骨髓间充质干细胞氧化损伤的修复及其抗脂质过氧化作用[J].中草药,2007,38(7):1043 -1046.
[6]朱志立,米 娜,李 靖,等.趋化因子受体CXCR4 在骨髓间充质干细胞中的表达[J].局解手术学杂志,2010,19(6):462 -464.
[7]Kanemura H,Iimuro Y,Takeuchi M,et al.Hepatocyte growth factor gene transfer with naked plasmid DNA ameliorates dimethylnitrosamine-induced liver fibrosis in rats[J].Hepatol Res,2008,38(9):930 -939.
[8]Liu X,Shen W,Yang Y,et al.Therapeutic implications of mesenchymal stem cells transfected with hepatocyte growth factor transplanted in rat kidney with unilateral ureteral obstruction[J].J Pediatr Surg,2011,46(3):537 -545.
[9]Hua ZY,Song J,Cheng F,et al.The effect of hepatocyte growth factor on the initiation phase of liver regeneration after cold ischemia in a rat model of small-for-size liver transplantation [J].Hepatogastroenterology,2012,59(117):1548 -1552.
[10]Kucia M,Zhang YP,Reca R,et al.Cells enriched in markers of neural tissue-committed stem cells reside in the bone marrow and are mobilized into the peripheral blood following stroke[J].Leukemia,2006,20(1):18 -28.
[11]Trapp T,Kogler G,El-Khattouti A,et al.Hepatocyte growth factor/c-MET axis-mediated tropism of cord blood-derived unrestricted somatic stem cells for neuronal injury[J].J Biol Chem,2008,283(47):32244 -32253.

