度拉糖肽对2 型糖尿病合并非酒精性脂肪性肝病患者肝脂肪及纤维化的影响
邹 琳 马俊花 陈 霞 李映璇 陆建灿 周星璐 孙 菲
上海市浦东新区公利医院内分泌科,上海 200135
随着生活方式的改变,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的患病率逐年上升,据最新数据统计,全球患病率高达25%,而我国NAFLD 患病率高达32.9%[1]。NAFLD 是一类疾病谱,包括非酒精性脂肪肝(non-alcoholic fatty liver,NAFL),非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)和由NASH 进展到肝硬化及肝癌,其中NAFLD 中约1/2 的患者为NASH,近1/4 的NASH 可在10~15 年发展为肝硬化,1/6 的患者将进展为肝细胞癌。NASH 的患病人数也在逐年增加,并导致肝硬化、终末期肝病、肝移植及肝癌的患病人数增加,它也被认为是一类与代谢密切相关的慢性肝病,是2 型糖尿病、心血管疾病、慢性肾病等独立危险因子[2-3]。相关研究表明,糖尿病可以加快NAFLD 的发病病程,一项meta 分析表明糖尿病至少增加2 倍以上的肝硬化及肝脏相关的死亡风险[4]。因此识别和治疗NAFLD 合并糖尿病患者尤其是处于NAFLD 进展期的患者迫在眉睫。
但目前尚无美国食品药品监督管理局获批的药物用于治疗NASH 或肝纤维化。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂为较新的一类降糖药物,研究提示GLP-1 受体激动剂类药物可能对NAFLD 治疗有效,度拉糖肽为GLP-1 受体激动剂的周制剂,与人内源性GLP-1 90%同源,不容易过敏[5]。本研究观察2 型糖尿病合并NAFLD 患者使用度拉糖肽治疗后,患者糖脂代谢指标及肝脂肪、肝纤维化的变化。
1 资料与方法
1.1 一般资料
选取2021 年7 月至2022 年7 月就诊于上海市浦东新区公利医院的2 型糖尿病合并NAFLD 患者共85 例为研究对象。其中男49 例,女36 例,平均年龄为(57.84±11.22)岁,9 例体重指数(body mass index,BMI)<24 kg/m2,35 例BMI 为24~28 kg/m2,41 例BMI>28 kg/m2,平均病程为(6.21±2.17)年。纳入标准:年龄18~79 岁,BMI 19~40 kg/m2,同时符合2018年中华医学会《非酒精性脂肪性肝病防治指南》[6]及2021 年美国糖尿病协会糖尿病医学诊疗标准[7];患者签署知情同意书。排除标准:病毒性、酒精性、免疫性、药物性、遗传代谢性等肝炎、肝硬化;严重心肝肾不全,恶性肿瘤;内分泌腺疾病;孕产妇;精神病;糖尿病急性并发症;1 型糖尿病及特殊类型糖尿病;有胰腺炎病史或甲状腺细胞肿瘤。本研究通过上海市浦东新区公利医院伦理委员会审批(GLYYls2021-008)。
1.2 治疗方法
入选的患者在生活方式干预的基础上加用度拉糖肽1.5 mg,1 次/周,皮下注射,连续使用1 年后(Vetter Pharma-Fertigung GmbH&Co.KG,生产批号:D498843)。生活方式干预同治疗前,仍按照指南要求制订患者的饮食及运动计划,并要求患者严格执行,定期与患者联系,了解其治疗依从性。
1.3 观察指标
所有患者在治疗前后分别记录基本项目(年龄、性别、身高、体重、颈围、腰围、臀围);并采集5~10 ml的空腹肘静脉血。①使用生化分析仪(雅培C16000)检测谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)、GOT/GPT、γ-谷氨酰转移酶(γ-glutamyltransferase,γ-GGT)碱性磷酸酶(alkaline phosphatase,ALP)、白蛋白(albumin,ALB);总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、游离脂肪酸(free fatty acid,FFA);空腹血糖(fasting blood glucose,FBG)、空腹C 肽(fasting C-peptide,C-P)、空腹胰岛素(fasting insulin,FINS)、糖化血红蛋白(glycosylated hemoglobin,HbA1c);尿酸(uric acid,UA)。②使用全自动血液细胞分析仪(罗氏)检测超敏C 反应蛋白(hypersensitive C-reactive protein,hs-CRP);血小板计数(platelet count,PC)。③使用内脏脂肪检测仪(欧姆龙HDS-2000)检测治疗前后内脏脂肪测定(visceral fat volume,VFV)及皮下脂肪测定(subcutaneous fat volume,SFV)。④计算稳态模型胰岛素抵抗指数(insulinresistanceindex,HOMA-IR)指数。其中BMI=体重/身高2,HOMA-IR 指数=FBG×FIN/22.5。⑤肝脂肪变性指数(hepatic steatosis index,HSI):HSI=8×(ALT/AST 比值)+BMI(如果女性+2;如果糖尿病+2)(HSI<30 时,可排除NAFLD,HSI>36 时,可判定为NAFLD);⑥脂肪肝指数(fatty liver index,FLI):FLI=e0.953×logeTG+0.139×BMI+0.718×logeGGT+0.053×WC-15.745/(1+e0.953×logeTG+0.139×BMI+0.718× logeGGT+0.053×WC-15.745)×100(FLI<30 排除脂肪肝,灵敏度为87.0%;FLI≥60 判定肝脂肪变性,特异度为86.0%)。⑦天冬氨酸转氨酶和血小板比率指数(aspartate transaminase to platelet ratio index,APRI)评分:APRI=[AST(U/L)/AST(ULN)×100]/PLT(×109/L)(>1肝硬化;>0.7 进展期肝纤维化);⑧肝纤维化评分(NAFLD fibrosis score,NFS):NFS=-1.675+0.037×年龄+0.094×BMI+1.13×是否糖耐量受损或糖尿病(是为1,否为0)+0.99×AST/ALT 比值-0.013×血小板(×109/L)-0.66×白蛋白(g/dl)(<-1.45 排除晚期纤维化;>0.675 诊断晚期纤维化);FIB-4 评分:FIB-4=年龄(岁)×AST(U/L)/PLT(×109/L)×ALT(U/L)-1/2(<1.45排除进展期肝纤维化,>3.25 进展期肝纤维化)[8]。
1.4 统计学方法
采用SPSS 17.0 统计学软件进行数据分析。符合正态分布的计量资料采用均数±标准差(±s)表示,比较采用t 检验;不符合正态分布的计量资料采用中位数(四分位数)[M(P25,P75)]表示,比较采用Mann-Whitney U 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者治疗前后一般资料比较
治疗后BMI、腰围、臀围低于用药前,差异有统计学意义(P<0.05)。见表1。
表1 患者治疗前后一般资料比较(±s)
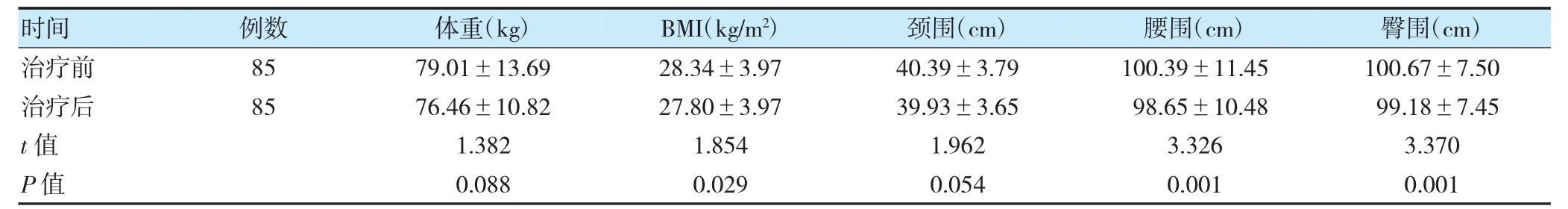
表1 患者治疗前后一般资料比较(±s)
注BMI:体重指数。
2.2 患者治疗前后血糖相关指标比较
治疗后,FBG、HbA1c低于治疗前,差异有统计学意义(P<0.05),治疗后,CP 和FINS 与治疗前比较,差异无统计学意义(P>0.05)。见表2。
表2 患者治疗前后血糖指标比较(±s)

表2 患者治疗前后血糖指标比较(±s)
注FBG:空腹血糖;C-P:空腹C 肽;FINS:空腹胰岛素;HbA1c:糖化血红蛋白;HOMA-IR 指数:稳态模型胰岛素抵抗指数。
2.3 患者治疗前后血脂相关指标比较
治疗后,FFA 低于治疗前,HDL-C 高于治疗前,差异有统计学意义(P<0.05)。治疗后,TG、TC、LDL-C 与治疗前比较,差异无统计学意义(P>0.05)。见表3。
表3 患者治疗前后血脂相关指标比较(mmol/L,±s)
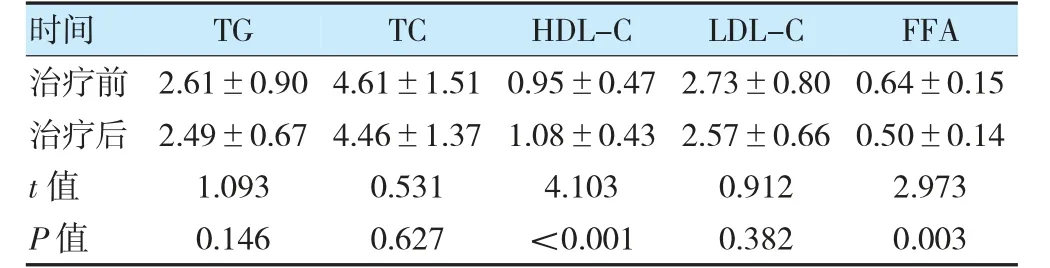
表3 患者治疗前后血脂相关指标比较(mmol/L,±s)
注TG:甘油三酯;TC:胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;FFA:游离脂肪酸。
2.4 患者治疗前后肝脏相关指标变化
治疗后,GPT、GOT 低于治疗前,差异有统计学意义(P<0.05)。治疗后,γ-GGT、ALP、ALB、GOT/GPT 比值与治疗前比较,差异无统计学意义(P>0.05)。见表4。
表4 患者治疗前后肝脏相关指标变化(±s)

表4 患者治疗前后肝脏相关指标变化(±s)
注GPT:谷丙转氨酶;GOT:谷草转氨酶;γ-GGT:γ-谷氨酰转移酶;ALKP:碱性磷酸酶;ALB:白蛋白。
2.5 患者治疗前后内脏脂肪含量及皮下脂肪含量比较
治疗后,PC、VFV 和SFV 低于治疗前,差异有统计学意义(P<0.05)。见表5。
表5 患者治疗前后内脏脂肪含量及皮下脂肪含量比较(±s)

表5 患者治疗前后内脏脂肪含量及皮下脂肪含量比较(±s)
注PC:血小板计数;VFV:内脏脂肪含量;SFV:皮下脂肪含量。
2.6 患者治疗后肝脂肪、肝纤维化相关模型比较
治疗后,肝脂肪中FLI、HSI、APRI 评分、NFS 评分低于治疗前,差异有统计学意义(P<0.05)。治疗后,FIB-4与治疗前比较,差异无统计学意义(P>0.05)。见表6。

表6 患者治疗后肝脂肪、肝纤维化相关模型比较[M(P25,P75)]
3 讨论
NAFLD 是肝脏的代谢综合征,当疾病进展到NASH 时,则进展为肝硬化、肝癌的风险明显升高,NAFL 时期已有炎症反应,尤其是进展期肝纤维化可以预测肝脏的结局,一项meta 分析表明4 期肝纤维化患者发生肝癌的风险更高[9]。但肝纤维和NASH 目前仍是NAFLD 的治疗难点,研究表明2 型糖尿病人群中有47.3%~63.7%合并有NAFLD,两者之间有相似的发病机制,如PNPLA3 和TM6SF2 基因变异不仅存在于进展型肝纤维化或NASH,还存在于糖尿病患者[10-11];同时,两者均有胰岛素抵抗、脂质代谢异常、炎症反应等病理变化,并且两者导致死亡的主要因素均是心血管疾病及脑卒中,这也为糖尿病药物同时用于改善NAFLD 提供理论依据,对于NAFLD 的管理不仅包含疾病本身,应更多考虑代谢合并症的管理[3,12]。诊断NAFLD 严重程度的金标准为肝穿刺,但由于其有创性,大部分患者不能接受,目前已有多种无创检测手段,包括肝酶指标、CK18 及各种评分模型,肝脏弹性超声、磁共振质子密度脂肪含量测定、肝脏磁共振弹力成像等影像手段[13],本研究通过各种评分模型来判断患者治疗后糖脂代谢、肝脏病变的改善情况。目前针对NAFLD 的治疗主要包括饮食、营养、运动指导及一些药物治疗如维生素E、吡格列酮等,但由于药物的副作用,目前尚无确切的安全有效的药物,新的药物仍在研发中,如法尼脂激动剂、甲状腺激素受体、成纤维细胞生长因子21 等[14-16]。GLP-1 受体激动剂是目前较新的糖尿病药物,相关研究表明对心脑血管有保护作用,同时可用于肝功能异常的患者[17]。它是一种肠促胰素,以葡萄糖依赖的方式促进胰岛素分泌,延迟胃排空及食物吸收,达到降低血糖、减重效果[18-19]。研究表明它可以减少脂肪蓄积,还可以抑制炎症反应[20]。研究表明利拉鲁肽持续注射或增加GLP-1 浓度可以激活AMP 依赖的蛋白激酶[21]。而AMPK 是胰岛素信号通路的重要酶并可以抑制胆固醇调节元件结合蛋白,减少碳水化合物反应元件结合蛋白刺激的肝脏从头脂肪生成[22]。利拉鲁肽还可以激活肝细胞脂肪酸β-氧化中的过氧化物酶增殖物激活受体[23]。也有研究表明利拉鲁肽可改善GPT、GOT、γ-GGT 等指标,对NASH 有改善作用[24]。本研究发现,度拉糖肽使用1 年后,患者肝功能、血脂、血糖代谢明显改善,VFV 及SFV 减少,肝脂肪变指数及纤维化指数均有改善,这表明GLP-1 受体激动剂具有改善脂质在内脏中的异常沉积,减少炎症因子IL-6、IL-8、TNF-α 等的表达,减少氧化应激产物,达到抑制肝脏炎症反应作用的可能[25]。
度拉糖肽对2 型糖尿病合并NAFLD 患者具有明显的降糖,减重,减轻内脏脂肪和皮下脂肪,改善血脂,肝功能,肝炎性指标、肝纤维化指标的作用,是2型糖尿病合并NAFLD 患者的良好选择。本研究的不足之处在于未设立对照组,未能排除安慰剂效应,同时,在没有肝穿刺的条件下,可通过弹性超声,磁共振质子密度脂肪含量测定、肝脏磁共振弹力成像等影像学检查联合模型提高诊断,使研究证据更充分,后期会在今后的临床研究中进一步完善。
利益冲突声明:本文所有作者均声明不存在利益冲突。

