大肠杆菌表达高性能融合鱿鱼环齿-类弹性蛋白的发酵优化
姜正日, 殷仁凯, 王泽建, 钱江潮
(华东理工大学生物工程学院, 生物反应器工程国家重点实验室, 上海 200237)
生物力学功能蛋白如蛛丝、类弹性蛋白、鱿鱼环齿蛋白等制备的纤维材料因其机械强度高、易降解、具有生物相容性,广泛应用于医药、组织工程和生物材料等领域[1-5]。利用鱿鱼环齿(Squid Ring Teeth, SRT)蛋白序列(PAATAVSHTTHHAP)和类弹性蛋白(Elastin-like polypeptide, ELP)序列(VPGVG,VPGKG)设计融合蛋白基序(PAATAVSHTTHHAPVPGVG(VPGKG)5),重复该基序得到相对分子质量为192 kDa 的重组蛋白SRT-ELP36,在大肠杆菌(Escherichia coli,E.coli)中表达后,所制备的重组蛋白SRT-ELP36 单丝纤维断裂强度和韧性分别高达630 MPa 和130 MJ/m3,优于重组蛛丝蛋白及化学再生蚕丝纤维[6-7]。在此基础上,需针对重组蛋白SRTELP36 在大肠杆菌中的表达进行优化,提高重组蛋白体积产量,才可实现其工业化应用。
E.coli因遗传背景清楚、生长速率快、培养成本低等特点,已成为最常用的外源蛋白表达宿主[8-10]。目前也有利用大肠杆菌表达力学功能蛋白的研究工作。Pena 等[11-12]将SRT 基因克隆到pET14b 载体系统并转化入大肠杆菌BL21(DE3),可获得纯度约为90%、体积产量约为1 g/L 的SRT 蛋白。Collins 等[13]发现大肠杆菌BL21(DE3)表达类弹性蛋白(Silk-Elastin-Like Protein, SELP)过程中供氧条件和诱导时机对蛋白表达至关重要。在此基础上,Barroca 等[14]利用能够产生毒素的宿主和产生抗毒素的质粒构成的SCS(Separate-Component Stabilization System)系统,解决了大肠杆菌发酵过程中的质粒丢失问题,可确保存活的细胞均含表达质粒,提高了类弹性蛋白的产量。
为了提高重组蛋白SRT-ELP36 的表达水平,本文通过分批培养和补料分批培养的方式考察了宿主菌、培养基、诱导时机、供氧量等条件对重组大肠杆菌生长和蛋白表达的影响,获得了提升大肠杆菌BL21(DE3)表达重组蛋白SRT-ELP36 的最优化控制工艺条件,并在50 L 发酵罐对最优化条件进行验证,为工业化大规模生产重组蛋白SRT-ELP36 奠定基础。
1 实验材料与方法
1.1 原料和试剂
1.1.1 菌株 大肠杆菌BL21(DE3)购自Thermo Fisher Scientific 公司,BLR(DE3)和pET-25b(+)-SRT-ELP36由中国科学院长春应用化学研究所刘凯教授提供[6]。转化了表达质粒pET-25b(+)-SRT-ELP36 的重组大肠杆菌BL21(DE3)和BLR(DE3)由本实验室构建、保藏。
1.1.2 实验仪器 TS-200B 型恒温摇床(上海天呈实验仪器制造有限公司),FA1004 型电子天平(上海天平仪器技术有限公司),UV-1200B 型可见光分光光度计(上海美普达仪器有限公司),Mini Protein 3 型垂直电泳仪(美国Bio-Rad 公司),5 L、50 L 发酵罐(上海国强生化工程装备有限公司),LC-2010A 型高效液相色谱(日本岛津公司),YX280A 型压力蒸汽灭菌器(上海三申医疗器械有限公司),MAX300-LG 型尾气过程质谱仪(美国Extrel 公司)。
1.1.3 培养基 LB(Luria-Bertani)培养基(g/L):酵母提取物5,蛋白胨10,NaCl 10,在LB 培养基中加入15 g/L 琼脂得到固体LB 培养基;TB(Terrific Broth)培养基(g/L):酵母提取物24,蛋白胨12,甘油5,KH2PO42.32, K2HPO412.54; SOB( Super Optimal Broth)培养基(g/L):酵母提取物5,蛋白胨20,NaCl 0.5,KCl 0.19,MgCl20.95;SOC(Super Optimal Broth with Catabolite Repression)培养基(g/L):酵母提取物5,蛋白胨20,葡萄糖3.6,NaCl 0.5,KCl 0.19,MgCl20.95;SB(Super Broth)培养基(g/L):酵母提取物20,蛋白胨35,NaCl 5。M9 培养基(g/L):葡萄糖4,MgSO4·7H2O 0.49, CaCl2·6H2O 0.022, Na2PO4·7H2O 12.8,KH2PO43.0,NaCl 0.5,NH4Cl 1.0;发酵罐中所用初始培养基(g/L):KH2PO46.67,蛋白胨13.0,一水合柠檬酸3.25,CaCl2·H2O 0.05,MgSO4·7H2O 2.5 g/L;葡萄糖补料溶液:650 g/L。
1.2 培养方法
1.2.1 种子制备 将重组大肠杆菌划线接种于含有氨苄青霉素的抗性LB 固体平板中,放置于37 ℃恒温培养箱培养16~18 h。挑取生成的单菌落接种至含有5 mL LB 液体培养基(含有终质量浓度为100 mg/L氨苄青霉素)的无菌试管中,于37 ℃恒温摇床中220 r/min 转速下培养12 h。
1.2.2 摇瓶培养 将培养好的种子液按2%的接种量接种于装有50 mL 培养基(含有终质量浓度为100 mg/L的氨苄青霉素)的250 mL 摇瓶中。于37 ℃恒温摇床中220 r/min 震荡培养,定时取样检测OD600(波长600 nm 处的吸光值)并进行目标蛋白表达量分析。
1.2.3 补料分批培养 5 L 发酵罐中装入3 L 发酵培养基,121 ℃灭菌30 min 后,按3%的接种量接入种子液(氨苄青霉素质量浓度200 mg/L)。初始条件为37 ℃、500 r/min、通气量为1 vvm,待溶氧回升时,流加葡萄糖进行补料培养,至菌体OD600达35.0 后加入终浓度为0.5 mmol/L 的ⅠPTG(异丙基-β-D-硫代半乳糖苷)进行诱导培养。培养过程中使用氨水调节pH 为6.9,同时通过转速调整控制溶氧不低于20%。
50 L 发酵罐中装入30 L 发酵培养基,121 ℃灭菌30 min 后,按1.3%的接种量接入种子液(氨苄青霉素质量浓度200 mg/L)。通气量为1 vvm,通过转速调整控制溶氧不低于20%。。
1.3 检测方法
1.3.1 菌浓的测定 将发酵液稀释适当倍数后, 测定OD600。取1 mL 发酵液、12 000 r/min离心2 min,将得到的菌体洗涤2 次,于105 ℃烘干至恒重后,称量菌体干重(Dry Cell Weight, DCW)。
1.3.2 重组蛋白表达水平的确定 将诱导后的发酵液离心后收集菌体,加入适量蛋白上样缓冲液,沸水浴10 min 后离心取上清液即可上样。用移液枪吸取样品加入蛋白凝胶孔后,电泳仪设置电压为80 V,待样品通过分离胶与浓缩胶交界面时,调整电压为120 V,约45 min 样品距离凝胶底部1 cm 处停止电泳。根据考马斯亮蓝染色法对目标蛋白浓度进行半定量分析,使用Ⅰmage J 软件对SDS-PAGE 电泳图进行目标蛋白条带灰度扫描,分析出每条泳道目标蛋白与定量Marker 的比值,从而计算出目标蛋白的含量。
1.3.3 氧摄取速率(OUR)的检测 通过尾气过程质谱仪对发酵尾气中的二氧化碳、氮气和氧气等气体含量进行检测,通过计算得到OUR[15]。
1.3.4 胞外乙酸浓度的检测 发酵液中的胞外乙酸浓度使用高效液相色谱仪(HPLC)进行测定[16]。首先,吸取不同时间的发酵液样品,离心收集上清液并使用0.22 μm 水相过滤膜过滤至液相瓶中。检测条件如下:液相流动相及对应流速分别为0.01 mol/L 稀硫酸、0.4 mL/min;紫外检测波长为210 nm,保持柱温50 ℃,样品进样量为10 μL,且每个样品检测时间均为45 min。
2 结果与讨论
2.1 摇瓶发酵条件优化
2.1.1 宿主菌的筛选 不同的大肠杆菌宿主菌在生长、表达外源基因、代谢副产物积累以及耐受抑制性代谢物能力等方面都存在较大的差异。BL21(DE3)和BLR(DE3)宿主菌均适用于表达pET-25b(+)质粒,BL21(DE3)是应用广泛的良好表达宿主,发酵过程中具有乙酸积累较少的特点,但质粒稳定性较差。BLR(DE3)质粒稳定性较好,可稳定重复序列的表达,但存在诱导后生长抑制及竞争性质粒不稳定等情况[17-18]。在TB 培养基中,BL21(DE3)和BLR(DE3)培养至OD600约1.0 时进入指数增长期时开始诱导,考察两种宿主菌的生长和蛋白表达情况(图1)。两种宿主菌的生长相差较小,BL21(DE3)表达重组蛋白SRT-ELP36 的最高体积产量达0.2 g/L,约为BLR(DE3)的1.8 倍,且BL21(DE3)表达蛋白的单位菌体产量始终高于BLR(DE3)。 BL21(DE3) 和BLR(DE3)在诱导2 h时单位菌体蛋白产量(Specific production)最高,分别为110、70 mg/g。因此,选择蛋白表达水平较高、生长速度较快的BL21(DE3)为宿主菌进行后续发酵过程优化。
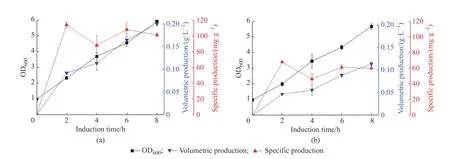
图1 诱导阶段重组菌BL21(DE3)(a)和BLR(DE3)(b)的生长及蛋白表达(n=3)Fig.1 Cell growth and protein production of recombinant BL21(DE3) (a) and BLR(DE3) (b) during induction period (n=3)
2.1.2 培养基的选择 本文选择了常用的6 种培养基:富营养的SB 培养基,低营养的SOC、SOB、LB 和M9 培养基,及含有磷酸缓冲液的富营养TB 培养基,考察不同培养基对BL21(DE3)蛋白表达的影响,结果如图2 所示。营养丰富的TB 和SB 培养基有利于重组菌生长,诱导8 h 后的OD600分别可达5.9 和5.3。TB 培养基中重组蛋白SRT-ELP36 的表达量明显优于SB 培养基,这是由于TB 培养基中添加了磷酸缓冲液,诱导后可长期维持pH 于7.0 左右。在低营养培养基LB、SOB 和SOC 中菌体生长速率普遍低于TB 和SB 培养基,与SOB 培养基相比,SOC 中额外添加了葡萄糖作碳源,重组菌生长稍快,蛋白的表达量比较一致。因此,具有pH 缓冲能力且营养丰富的TB 培养基利于BL21(DE3)生长和表达SRT-ELP36。
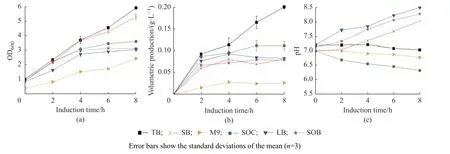
图2 不同培养基对重组菌BL21(DE3)生长、蛋白体积产量和培养液pH 的影响Fig.2 Effects of different culture mediums on the growth of BL21(DE3), protein volumetric production and culture pH
2.1.3 诱导时机的确定 在摇瓶中进行大肠杆菌表达外源蛋白时,通常控制重组菌生长至对数生长初期(OD600为0.6~1.0)时开始诱导,此时细胞代谢旺盛,蛋白合成速率较快,但此时菌体量较低,ⅠPTG 诱导可能会抑制菌体在诱导期的生长速率,限制外源蛋白的大量表达[19-20]。根据重组菌的生长曲线(图3(a)),选择培养2、4、8 h,分别对应于对数生长前期(OD600为1.05)、对数生长后期(OD600为4.0)和稳定期前期(OD600为8.0)这3 个不同的诱导时机进行诱导,考察了不同生长阶段诱导对重组蛋白表达的影响,结果如图3 所示。虽然起始诱导时的菌体量最低,对数生长前期诱导后重组菌在整个诱导的20 h内可持续生长,最终的菌体OD600与对数生长后期诱导时接近。对数生长后期和稳定期前期诱导时,重组菌诱导后6 h 基本停止生长,稳定期前期诱导的 OD600最高可达12.4。对数生长前期诱导时,菌体单位蛋白产量在初始2 h 内快速达到最高,但随着发酵过程的进行不断下降,且菌体量始终最低,导致蛋白体积产量最低。培养4 h 后开始诱导,单位菌体蛋白产量不断上升,诱导6 h 后蛋白产量超过另2 个诱导时机(对数生长后期、稳定期前期),持续至诱导12 h 达到最高产量为140 mg/g,此时蛋白体积产量也达到最高0.39 g/L。稳定期前期诱导,不利于胞内蛋白合成,单位菌体胞内蛋白体积产量的最高值在3 个诱导时机(对数生长前期、对数生长后期、稳定期前期)中最低,由于诱导阶段的菌体浓度始终最高,蛋白体积产量在诱导后8 h 内可保持较高水平,最高达到0.34 g/L,且从诱导10 h 后就开始下降。比较3 个诱导时机的结果,可以发现,在对数生长后期(OD600为4.0)时诱导,蛋白体积产量较高,发酵周期较短,可选为最佳诱导时机。

图3 重组菌BL21(DE3)生长曲线(a)以及起始诱导菌体浓度对菌体生长(b)、蛋白体积产量(c)和单位菌体产量(d)的影响Fig.3 Growth curve of BL21(DE3) (a), effects of initial OD600 at induction on cell growth (b), protein volumetric production (c) and specific production (d)
2.1.4 供氧水平对生长和蛋白表达的影响 培养环境中的溶解氧水平是影响大肠杆菌生长及蛋白表达的一个重要参数,过高或过低的溶解氧都会直接影响菌株生长及产物的合成[21]。在摇瓶中,可以通过降低装液量,即装液比(装液量与摇瓶体积之比),来提高供氧和培养液中的溶氧水平,考察不同溶氧水平对重组大肠杆菌生长及蛋白表达的影响,结果如图4所示。在培养起始的2 h 内,不同装液比条件时菌体均可快速生长,培养2 h 开始诱导后,菌株的比生长速率只在装液比为5%时维持基本不变,装液比越高,比生长速率下降趋势越明显。当装液比为5%时,重组菌比生长速率可维持至培养8 h 后下降,在培养14 h 最高OD600达到22.3,但在培养16 h 后迅速下降。菌株的蛋白体积产量随装液比的下降而增加,装液比为5%时的目标蛋白体积产量最高可达0.6 g/L,分别为10%、20%和33%装液比的1.3、1.5、3.7 倍。由此可见,在BL21(DE3)表达SRT-ELP36蛋白的过程中,维持充足的供氧和溶氧水平对于提高菌体生长和蛋白体积产量都非常重要。当装液比为5%时,诱导过程胞内外蛋白的分析结果显示,诱导12 h 以后,重组蛋白SRT-ELP36 占总蛋白的比例逐渐下降,发酵液上清中的蛋白浓度逐渐增大,说明SRT-ELP36蛋白积累降低,菌体发生了裂解。但是,随着蛋白体积产量的降低和菌体裂解,并未观察到SRT-ELP36 蛋白被释放到胞外,可能是蛋白在胞内发生了降解,此时菌体浓度下降、蛋白水解的出现可能与营养物质的耗竭有关。因此,控制高供氧量促进重组菌生长和蛋白表达的同时,需注意及时补充底物,并确定合理的发酵结束时间以防止细胞衰亡引起的目标蛋白裂解。

图4 不同摇瓶装液比对重组菌BL21(DE3)生长(a)和蛋白体积产量(b)的影响;装液比为5%时菌体裂解液及发酵液上清的蛋白电泳(c)Fig.4 Effects of volumetric ratio of medium to flask on the growth of BL21(DE3) (a) and protein volumetric production (b); SDS-PAGE analysis of the cell lysate and fermentation broth when the volumetric ratio of medium to flask was 5% (c)
2.2 补料分批高密度培养工艺条件优化
在摇瓶中的研究结果证实诱导时机、供氧水平和营养物质的补加是影响BL21(DE3)生长和重组蛋白SRT-ELP36 表达的关键因素。基于这些结果,我们在反应器中考察了补料分批培养模式下最优化的发酵条件,进一步提高重组蛋白SRT-ELP36 的产量。
2.2.1 起始诱导时机的优化 在5 L 发酵罐中进行分批补料培养,通过溶氧串联转速控制溶氧的体积分数范围为20%~30%,在补料阶段流加葡萄糖溶液(650 g/L)维持发酵液中葡萄糖质量浓度在菌体所需范围内(≤2 g/L),可实现重组菌高密度生长。为了实现重组蛋白的高效表达,根据摇瓶中考察诱导时机的结果,选择了补料阶段菌浓OD600分别达到25、35、50 和70 时进行诱导,取样测定菌浓和重组蛋白SRT-ELP36 的表达产量,实验结果如图5 所示。适当提高起始诱导的OD600,有利于诱导期内达到较高密度的菌量,起始诱导OD600为50 时,菌体在充足的补料和供氧条件下,诱导阶段可保持较高的生长速率,OD600最高可达100 以上。当诱导菌浓OD600提高到70 时,重组菌的生长速率明显降低,在诱导4 h 后基本停止生长。而起始诱导菌浓OD600为25 和35 时,重组菌生长速率在诱导2 h 后明显下降,最高OD600仅为50.3 和62.6,这可能与代谢副产物乙酸积累从而抑制菌体生长有关[22-24]。从蛋白体积产量来看,OD600为25 诱导时蛋白体积产量最低,单位菌体的蛋白产量虽然比高菌浓OD600为50 和70 诱导时高,但菌体生长太慢导致无法实现蛋白高产。起始诱导OD600提高到35 以上后,蛋白体积产量均可达到OD600为25 时的1.4 倍以上,起始诱导OD600为50 时蛋白体积产量最高,为1.18 g/L。起始诱导OD600为35 时单位菌体产量最高,达60 mg/g,但菌体生长缓慢限制了蛋白表达量的进一步提高,而OD600为50 和75 时诱导单位菌体产量较低而生长较快,表明菌体更多利用培养基中的营养物质进行菌体生长而非蛋白合成。因此,后续采用起始诱导OD600为35,进一步通过优化补料和供氧促进菌体生长和蛋白合成。

图5 不同起始诱导菌浓时重组菌BL21(DE3)生长(a)、发酵液中乙酸浓度(b)、蛋白体积产量(c)和单位菌体蛋白产量(d)Fig.5 Cell growth (a), acetic acid concentration of the broth (b), protein volumetric production (c) and specific production (d) when cultures were induced at different initial OD600
2.2.2 氧消耗速率(OUR)水平的调控和优化 OUR是表征发酵过程中菌体呼吸代谢强度的重要参数,通过在线测定排出气体成分能够计算发酵过程中菌体的实时OUR,用于指导过程控制和优化。大肠杆菌表达外源蛋白是一个高耗氧过程,然而氧消耗速率与蛋白表达的关系却鲜有报道。在5 L 发酵罐中,我们通过在诱导阶段保持较高的补糖速率来维持菌体较高的OUR 水平(图6),并控制转速和通气保持两种条件下一致的溶氧水平,不同OUR 水平时重组菌生长和蛋白表达如图7 所示。

图6 不同补糖速率对OUR 的影响Fig.6 Effects of different glucose feed rates on OUR value

图7 不同氧消耗速率时重组菌生长与发酵液中乙酸浓度(a)、蛋白体积产量与单位菌体产量(b)Fig.7 Cell growth and acetic acid concentration of the broth (a) and protein volumetric production and specific production (b) when cultures were induced at different OUR levels
诱导开始后,提高葡萄糖的流加速率,可使OUR 持续增长至(180±5) mmol/(L·h),此后由于菌体量增加及设备供氧限制,OUR 逐渐下降并稳定在150 mmol/(L·h)左右。而控制葡萄糖流加速率,也使OUR 维持在较低的水平(130 mmol/(L·h)左右)。较高的OUR 水平有利于菌体生长,最高OD600可达88,约为较低OUR 水平的1.4 倍,且副产物乙酸的积累量下降了58%。此外,开始诱导的1 h 内,重组菌可快速启动蛋白表达,OUR 水平不影响蛋白表达。但随着诱导的持续,较高的OUR 水平更利于重组蛋白SRT-ELP36 的表达,诱导1 h 后,单位菌体蛋白产量可持续缓慢增加直至3 h,而蛋白体积产量虽然在诱导1 h 和3 h 后增速减慢,但可在整个诱导期间持续增加,两者分别达到1.85 g/L 和70 mg/g 的最高水平,分别为较低OUR 水平时的1.6 和1.2 倍。因此,发酵过程中通过控制补料和供氧,维持较高OUR 水平不仅利于菌株生长,还降低了乙酸的积累,可实现重组蛋白SRT-ELP36 的高效表达。
在5 L 发酵罐补料分批培养过程中对起始诱导时机、OUR 和营养物质的补加条件进行了优化,获得了发酵优化条件:起始诱导OD600为35、提高葡萄糖流加速率维持OUR 不断增长至(180±5) mmol/(L·h),可促进重组蛋白SRT-ELP36 的大量合成。
2.2.3 50 L 发酵罐考察 为了后续实现菌株在工业规模的应用,基于5 L 发酵罐中的发酵优化条件,在50 L 发酵罐中,我们以诱导时间、供氧水平、补糖速率和OUR 水平一致为原则,验证重组菌的发酵过程放大特性,实验结果如图8 所示。50 L 发酵罐与5 L发酵罐相比,可实现更高的罐压、供氧条件和溶解氧水平,50 L 发酵罐中培养的菌株生长更快,在批培养结束后,流加葡萄糖约3 h、菌浓OD600达到40 时开始诱导。诱导5 h 最高OD600可达103,约为5 L 发酵罐水平的1.3 倍。同时,蛋白表达水平得到了较大提高,诱导5 h 达到最高蛋白体积产量2.22 g/L,对比5 L 发酵罐最高水平提高了20%,最高单位菌体产量在诱导3 h 达到最高(90 mg/g),比5 L 发酵罐最高水平提高了29%。重组蛋白SRT-ELP36 在50 L 发酵罐中实现较高水平的表达,可经进一步优化放大实现工业化应用。

图8 50 L 发酵罐中重组菌生长、OUR、蛋白体积产量和单位菌体产量时间曲线Fig.8 Time courses of cell growth, OUR, protein volumetric and specific production in a 50 L bioreactor
3 结 论
针对大肠杆菌表达高性能重组蛋白SRTELP36,通过对比大肠杆菌BLR(DE3)和BL21(DE3)生长及蛋白表达能力,确定了生长及蛋白表达水平更高的BL21(DE3)为宿主菌。在摇瓶中,对BL21(DE3)表达SRT-ELP36 的培养基、诱导时机和培养基装液量进行优化,选择TB 为培养基,装液比为5%,在对数生长后期时,采用终浓度为0.5 mmmol/L的ⅠPTG在37 ℃进行诱导,最高OD600和蛋白体积产量分别可达22.3、0.60 g/L。在5 L 发酵罐中采用补料分批培养方式优化发酵过程,基于摇瓶中的结果,考察了起始诱导时机和氧消耗速率对宿主菌生长及蛋白表达的影响,发现在OD600为35 时添加终浓度为0.5 mmol/L的ⅠPTG 诱导表达,提高OUR 水平至(180±5) mmol/(L·h)时,最高OD600可达88,最高蛋白体积产量达1.85 g/L,最高单位菌体产量约70 mg/g。基于5 L发酵罐优化条件,在50 L 发酵罐中培养重组菌BL21(DE3),最高OD600提高至103,重组蛋白SRT-ELP36 的体积产量和单位菌体产量进一步提高至2.22 g/L 和90 mg/g,比5 L 发酵罐最高水平分别提高了20%和29%,与已报道的类似重复序列蛋白表达水平相比(表1),蛋白表达水平位于前列。这些优化结果可用于指导重组菌生产的大规模发酵,有助于实现重组蛋白SRTELP36 的工业应用。

表1 生物合成重复序列蛋白的体积产量比较Table 1 Comparison of biosynthetic production of repetitive sequence proteins

