母亲孕期风险暴露对儿童焦虑症及其亚型脑结构和功能影响的关联分析
赵飘飘,顾薪睿,刘宇,於葛畅,范华鑫,廉正旭,胡叶辰,杨森友,吴欣然,张捷
(1.复旦大学类脑智能科学与技术研究院,上海 200433;2.复旦大学计算神经科学与类脑智能教育部重点实验室,上海 200433;3.上海大学中欧工程技术学院,上海 200072;4.香港中文大学医学院,香港 999077)
目前,全球焦虑症的患病率呈显著增长趋势。流行病学调查显示,与COVID-19大流行前相比,在COVID-19大流行期间全球儿童和青少年焦虑症的患病率增加一倍,上升至25.2%[1]。焦虑症通常开始于儿童和青少年期,持续到成年期甚至持续终生。研究显示,儿童焦虑症患者有32%的几率终生患病[2],并且儿童焦虑与后续的自杀想法和自杀行为有关[3]。本文探究儿童焦虑症的病理机制,以期为预防儿童焦虑症的发生和发展提供依据。
最近30年来,母亲孕期风险暴露对后代精神健康的长期影响受到广泛关注。越来越多的证据表明,母亲孕期风险暴露增加了后代儿童焦虑症的发病率,影响了后代儿童的脑发育,这些结果支持健康和疾病的发育起源(DOHaD)假说。母亲在怀孕期间的风险暴露包括母亲怀孕期间妊娠高血压、严重恶心/呕吐、大出血需要卧床休息或特殊治疗、先兆子痫/子痫或毒血症、严重贫血等。流行病学研究发现,母亲妊娠期子痫或毒血症、高血压显著增加了后代儿童的多动障碍(ADHD)、焦虑抑郁发病率,同时增加了后代儿童的内化问题、外化问题、攻击、注意力不集中等行为问题[4,5]。动物模型研究显示,暴露于母亲孕期肥胖和高脂肪饮食的小鼠表现出更多的多动和焦虑抑郁样行为[6]。脑影像研究发现,焦虑症的焦虑回避、负面情绪偏见以及高级认知控制异常可能与凸显网络和默认网络连接中断有关[7]。据此,我们假设母亲孕期风险因素可能通过影响大脑从而影响后代焦虑症的发病。
尽管母亲孕期风险暴露可能是后代儿童焦虑症的关键病因之一,但是母亲孕期风险暴露对后代儿童焦虑症及其亚型影响的神经机制尚不清楚[8]。先前的研究样本量小,难以得出一致的结论,这阻碍了儿童焦虑症神经机制的探索。因此,本研究利用大型数据库ABCD(adolescent brain cognitive development)研究3.0 版中的精神疾病诊断量表、孕期风险因素量表、静息态脑功能连接和结构态脑成像数据,探究母亲孕期风险因素与后代焦虑症及其潜在脑机制之间的关联。
1 被试与方法
1.1 被试
从ABCD(https://abcdstudy.org)研究中选取美国21个站点的5686名9~10岁的儿童被试。ABCD数据库包含儿童的多模态脑影像、儿童自我报告及其父母或看护人报告的心理健康、神经认知、身体健康、物质使用以及文化环境等数据。所有的父母/照顾者都提供了书面同意书,儿童也向机构审查委员会提供了口头同意。
通过基于父母报告的DSM-5 学龄儿童情感障碍和精神分裂症(K-SADS-5)计算机化诊断量表评分,诊断出分离焦虑症组(separation anxiety disorder)742 人、社交焦虑症组(social anxiety disorder)396 人、广泛性焦虑症组(generalized anxiety disorder)359 人、特定恐怖症组(specific phobia)2189 人。将被诊断为任意一种焦虑症(分离焦虑症、广泛性焦虑症、社交焦虑症、特定恐怖症)的儿童归类为焦虑组。未被诊断为任何一种精神疾病的儿童归类为健康组。此外,将被诊断为患有多种焦虑症的儿童分别纳入各个亚型组。统计上把焦虑组和4种焦虑症亚型组分别编码为1,健康组编码为0,创建5 组分类变量。最终,共计5686名(平均年龄9.95岁,2986名女性,2743名焦虑症)具有年龄、性别、种族、青少年发育水平、身体质量指数、父母受教育程度、父母收入、孕期风险因素、合格的脑影像结构以及静息态功能连接指标的被试被纳入后续分析。
1.2 数据
1.2.1 孕期风险因素 母亲孕期风险因素使用父母或照顾者报告的青少年发育历史问卷(dhx01)评估。一共使用了18个与孕期风险相关的问卷条目:母亲生育年龄、父亲生育年龄;母亲怀孕期间物质暴露(尼古丁、酒精、烟草);母亲怀孕期间并发症风险(持续半年的严重恶心/呕吐、大量出血需要卧床休息、先兆子痫/子痫/毒血症、严重胆囊炎、持续性蛋白尿、风疹、严重贫血、尿路感染、怀孕相关的糖尿病、胎盘前置/胎盘早剥等问题、妊娠高血压、受伤以致需要医疗、其它医疗护理)。孕期风险暴露问卷调查使用二分法计分,1表示“是”,0表示“否”,得分越高表明孕期风险越大。此外,使用R包mice 中随机森林的方法对该量表的缺失值进行插值[9]。
1.2.2 结构MRI与静息态功能MRI的获取 ABCD成像程序参考相关文献[10],主要使用3T 扫描仪(西门子、通用电气和飞利浦)和多通道线圈扫描,收集T1w(T1-weighted image)和静息态功能MRI数据。采用以下参数获得T1w图像:256×256×176(西门子)和256×256×208(通用电气)的矩阵,视野(field of view,FOV)=256×256,体素大小=1.0 mm3,重复时间(repetition time,TR)=2500ms,回波时间(echo time,TE)=2.88ms(西门子)和2ms(通用电气),反转时间(inversion time,TI)=1060ms,翻转角(flip angle,FA)=8°,采集时间7’12”(西门子)和6’09”(通用电气)。fMRI 数据采用: 90×90,60 层,FOV=216×216,体素大小=2.4×2.4×2.4 mm3,TR=800ms,TE=30ms,FA=52°。
sMRI 和rfMRI 的预处理步骤参考相关文献[11],主要包括对T1w 结构图像梯度非线性畸变校正、强度不均匀性校正、非脑组织(如头皮)去除、标准空间中图像重采样和平均脑图像对齐。然后,使用Free-Surfer v5.3 进行皮层表面重建和皮层下脑区分割。基于Desikan模板[12]分类标记皮质区域,分别提取68个皮层脑区的体积、厚度以及表面积指标。基于Fischl 模板[13]分类标记皮质下区域,提取40 个皮层下脑区的体积指标。
大脑静息态功能连接(RSFC,resting-state functional connectivity)是根据Gordon 分区[14]方案预定义的12 个静息状态功能网络计算网络内和网络间的连通性的Pearson相关性,然后Fischer Z变换产生66个网络之间和12 个网络内的RSFC 变量,分别作为网络间和网络内连通性指标。类似地,12个静息状态功能网络和19 个皮层下核团之间产生的228 个RSFC变量也被使用,作为皮层网络与皮层下区域的大脑连通性指标。19个皮层下核团包括:双侧的小脑皮质(cerebellum cortex)、丘脑(thalamus)、海马(hippocampus)、杏仁核(amygdala)、壳核(putamen)、苍白球(pallidum)、尾状核(caudate)、伏隔核(nucleus accumbens)、腹侧间脑(ventral diencephalon)以及脑干(brain stem)。
1.3 统计分析
采用R 包lmerTest 中的线性混合模型(LMM,linear mixed model)[15]进行相关分析。在LMM中,创建的分类变量作为自变量,18 个孕期风险因素、脑结构指标(68个脑体积、厚度、表面积和40个皮层下体积)以及脑功能连接指标(78 个皮层网络内与网络间RSFC 和228 个皮层网络与皮层下核团之间的RSFC)分别作为因变量。年龄、性别、种族、身体质量指数(BMI)、青少年发育水平、父母教育、父母婚姻、扫描头动(对于静息态功能连接)、颅内体积(对于大脑结构)作为固定效应,站点嵌套家庭变量设置为随机效应。使用FDR(False Discovery Rate)矫正对各个模态数据进行P值多重比较矫正。例如,对于大脑68个脑区的厚度指标,FDR矫正次数为68次。
2 结果
2.1 焦虑症组与健康组儿童母亲孕期风险因素、脑结构以及功能连接的比较
总体上,相比于健康组,焦虑症组在多种孕期风险因素、大脑结构以及功能连接上均有显著差异。具体来说,焦虑症组共有7个孕期风险因素与健康组有显著差异(图1)。比如,焦虑症儿童的母亲在怀孕期间有更多的持续6个月严重恶心/呕吐(devhx_10a3_p,t=5.57,Pfdr<0.001)、严重贫血(devhx_10g3_p,t=4.19,Pf-dr<0.001)、尿路感染(devhx_10h3_p,t=4.43,Pfdr<0.001)、接受医疗护理(devhx_10m3_p,t=4.87,Pfdr<0.001)。并且与健康组相比,焦虑症儿童出生时母亲(devhx_3_p,t=-3.38,Pfdr=0.002)与父亲(devhx_4_p,t=-3.58,Pfdr=0.001)的年龄较小。
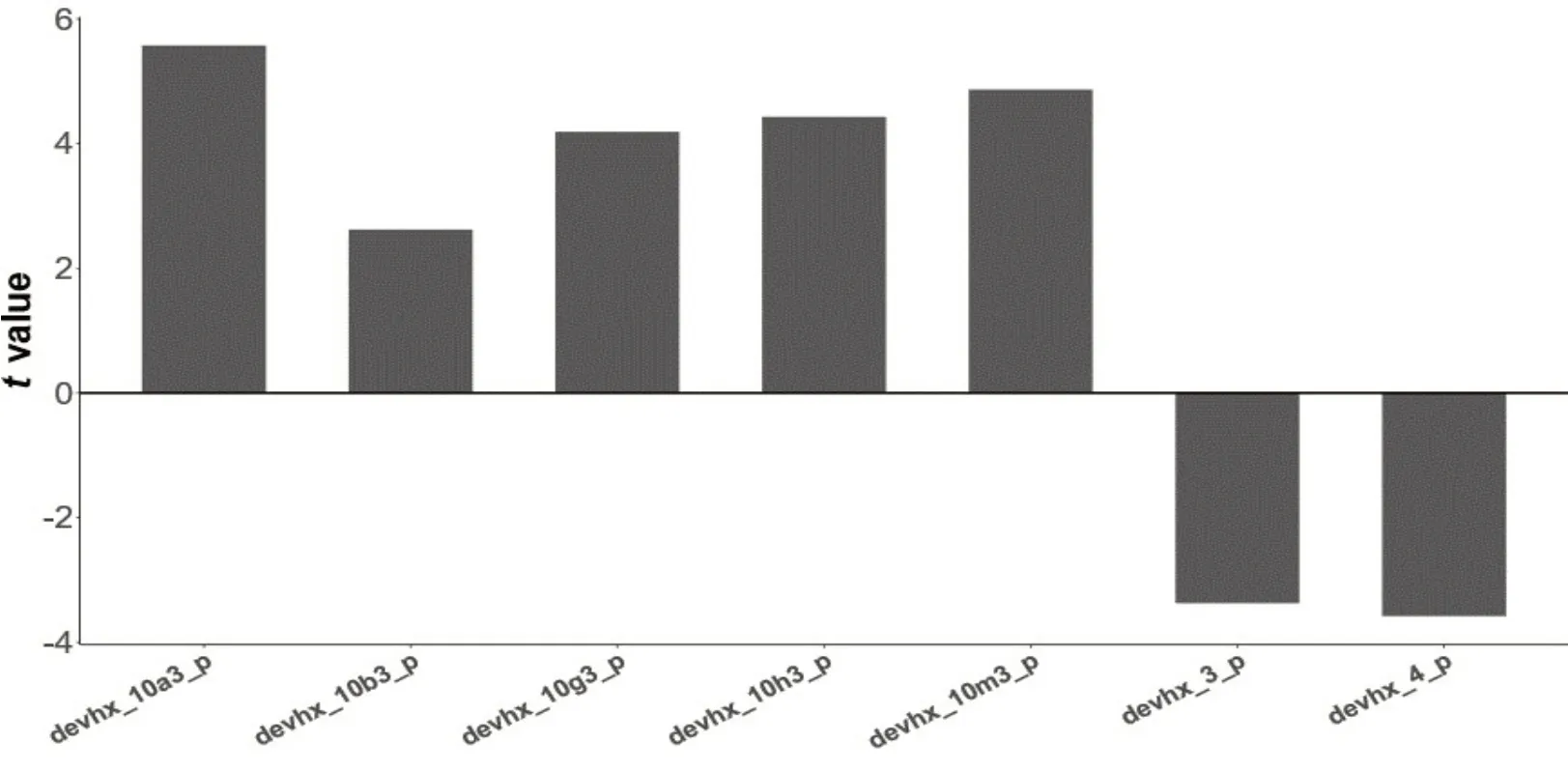
图1 焦虑症儿童与健康组母亲孕期风险因素的差异
在大脑结构上,与健康组相比,焦虑症儿童具有更高的大脑厚度但是更少的大脑表面积。具体来说,皮层总表面积减少(t=-4.00,P<0.001)而皮层平均厚度显著增加(t=3.03,P=0.002)。在大脑表面积方面,焦虑症儿童在22个脑区上显著表现出表面积降低(图2),包括左内侧眶额(t=-2.45,Pfdr=0.043)、左楔前叶(t=-3.26,Pfdr=0.021)、左中央前回(t=-2.73,Pfdr=0.028)、左额极(t=-3.06,Pfdr=0.021)、左脑岛(t=-3.00,Pfdr=0.021)、右楔前叶(t=-3.04,Pfdr=0.021)、右中央后回(t=-2.70,Pfdr=0.028)等脑区。在大脑皮层厚度方面,焦虑症儿童在8 个脑区上显著表现出皮层厚度增加(图3),包括左中央前回(t=2.78,Pfdr=0.049)、右侧下顶叶(t=3.25,Pfdr=0.029)、右颞上回(t=2.82,Pfdr=0.049)等脑区。焦虑症儿童的皮层总体积小于健康组被试(t=-2.64,P=0.008),但具体脑区的体积指标上焦虑症组与健康被试没有显著的差异。
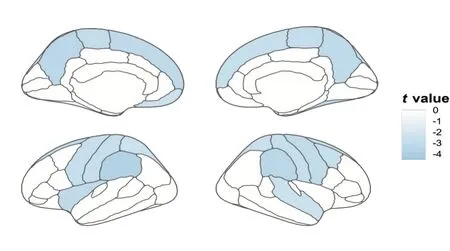
图2 焦虑症儿童与健康组大脑皮层面积的差异图
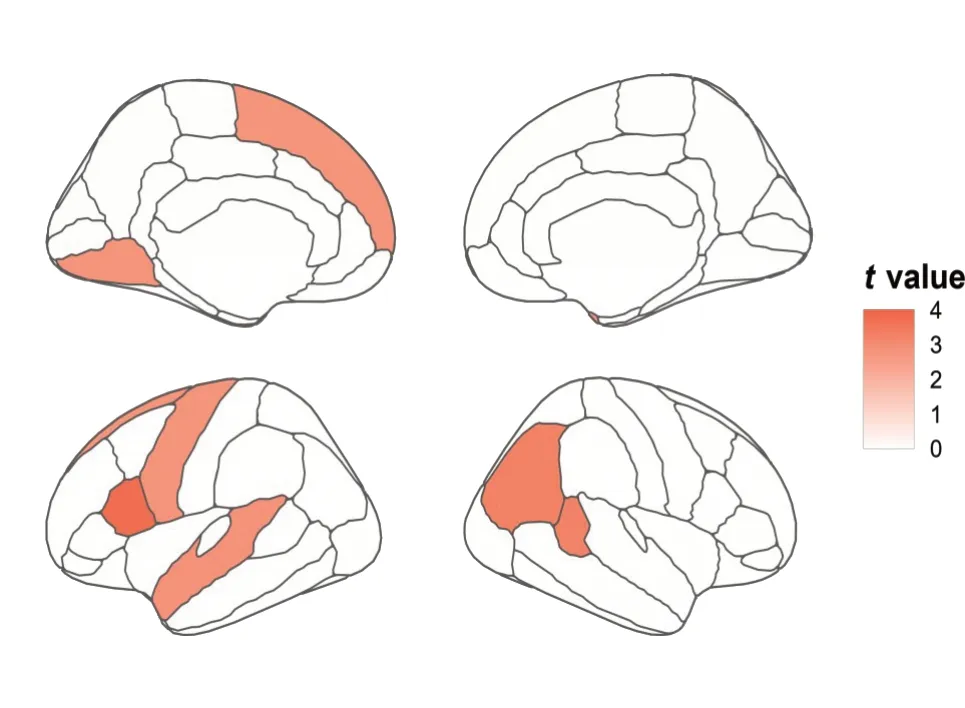
图3 焦虑症儿童与健康组大脑皮层厚度的差异图
在大脑功能连接上,相比于健康组被试,焦虑症儿童在皮层网络到皮层下的RSFC 连接增强(图4)。具体来说,在18条显著的皮层网络到皮层下的RSFC 中,有15 条表现为焦虑症患者连接增强。例如,焦虑症患者具有更高的扣带-盖部网络(CON,cingulo-opercular network)与左侧尾状核(t=3.27,Pf-dr=0.031)、扣带-顶叶网络与右侧海马(t=3.14,Pfdr=0.031)、口部感知运动网络(SMN,sensorimotor mouth network)与腹侧间脑(t=5.23,Pfdr<0.001)的RSFC。在皮层网络RSFC 中,焦虑症儿童仅在手部感觉运动网络(SHN,sensorimotor hand network)内部的RSFC上显著低于健康组(t=-4.14,Pfdr=0.003)。
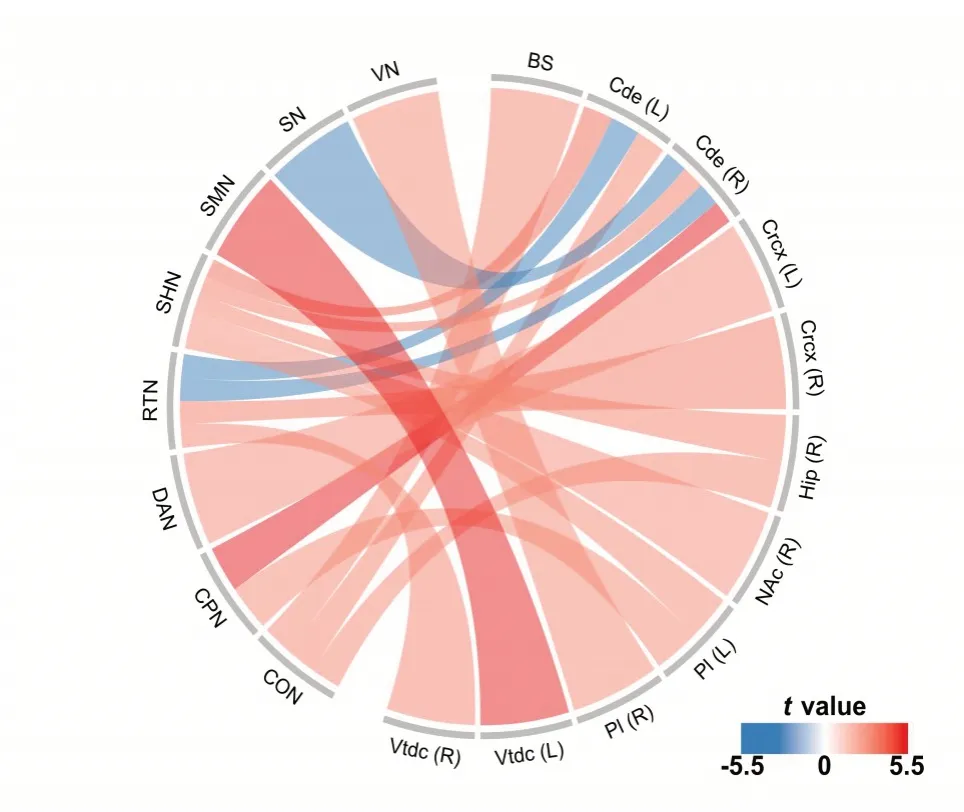
图4 焦虑症组与健康组皮层网络到皮层下核团静息状态功能连接的差异
2.2 母亲孕期风险因素与儿童左侧颞上回厚度的关联
接下来,对焦虑组与健康组儿童关联分析中显著的孕期风险因素(7 个)、大脑功能连接(19 个变量:18 条皮层到皮层下RSFC,1 条网络RSFC)与大脑结构(30个变量:22个表面积、8个厚度脑区指标)进行了关联分析。发现母亲生育年龄以及怀孕期间的医疗护理能够影响大脑脑区结构发育。母亲生育年龄与左侧额极(t=3.61,Pfdr=0.034)表面积增加有正相关关系。此外,母亲怀孕期间的医疗护理经历会增加儿童左侧上颞叶皮层厚度(t=4.16,Pfdr=0.007)。没有发现孕期风险因素与静息态功能连接指标有显著关联。
2.3 不同焦虑亚型组与健康组儿童的孕期风险因素和脑影像的比较
除了比较全部焦虑症儿童与健康儿童的差异,我们还具体探究了四种焦虑亚型与健康组在风险因素和神经影像指标的差异。总体上,在孕期风险因素方面,四种焦虑症亚型与健康组的差异具有较强的一致性,但是在具体大脑结构以及功能连接上与健康组的差异具有较强异质性(图5)。具体来说,在孕期风险因素中,相比于健康组儿童,四种焦虑症亚型儿童的母亲怀孕期间都经历更多的恶心/呕吐(devhx_10a3_p)、严重贫血(devhx_10g3_p)、医疗护理(devhx_10m3_p)。在大脑静息态功能连接上,相比于健康组儿童,特定恐惧症与分离焦虑症都在扣带-顶叶网络(CON)-右侧尾状核(t=4.70,Pfdr<0.001)、手部感觉运动网络(SHN)-腹侧脑岛的RSFC 连接增强(t=4.61,Pfdr<0.001)。在大脑皮层厚度方面,相比于健康组儿童,仅社交焦虑症发现了右侧扣带后回(t=3.13,Pfdr=0.049)等3 个脑区的厚度增加。在大脑皮层表面积方面,仅广泛焦虑症患者与健康组儿童相比,显示出右侧中央前回(t=-3.19,Pfdr=0.025)等6 个脑区的表面积显著降低。而在大脑皮层体积方面,同样发现仅广泛焦虑症的左内侧眶额(t=-3.36,Pfdr=0.027)等2 个脑区的体积显著低于正常儿童。
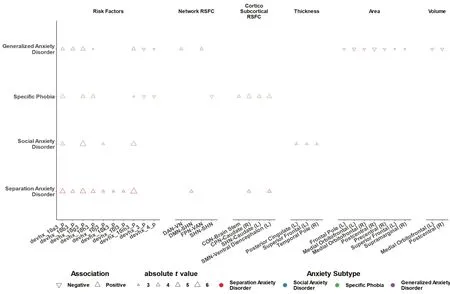
图5 四种焦虑症亚型相比健康组在孕期风险因素、大脑功能与静息态功能连接的差异
3 讨论
本研究利用大规模ABCD队列数据探究了儿童焦虑症的母亲孕期风险因素和相关神经机制,并进一步考察了影响焦虑症及其亚型的具体风险和神经机制。研究结果显示,母亲孕期风险暴露对儿童焦虑症及其亚型的脑发育产生了广泛的影响。总体而言,儿童焦虑症与母亲孕期更差的身体状况暴露有关。焦虑症儿童显示出额叶、颞叶和顶叶区域皮层表面积下降、厚度增加以及皮层功能网络和皮层下神经核团间的功能连接异常,并且关联分析显示焦虑患者的额颞区域的结构异常与母亲怀孕期间医疗护理等因素有关。在亚型层面,本研究发现了每种焦虑症亚型的差异性的孕期风险因素和脑影像改变。
本研究结果表明,孕期风险可以改变与焦虑症相关的大脑特征,这可能是孕期风险影响焦虑症状的生理途径。孕期母体风险因素对后代焦虑症的影响可以通过下丘脑-垂体-肾上腺轴(HPA轴)异常和糖皮质激素受体基因的表观遗传修饰改变解释[16,17]。孕期风险因素作为宫内压力可能影响了胎儿HPA轴的负反馈调节,导致胎儿应对压力的敏感性升高,进而影响到儿童在青春期时对环境风险的易感性。此外,妊娠期风险可能改变了胎儿的糖皮质激素受体基因的表观遗传学修饰,从而影响压力响应激素(糖皮质激素)的合成,进而影响个体对压力的易感性。
本研究发现母亲孕期严重恶心/呕吐、严重贫血和孕期需要特殊医疗护理情况是焦虑症的风险因素。母亲在孕期严重恶心和呕吐(妊娠剧吐)可能会导致母体营养不足,体液和电解质失衡,增加早产和产后抑郁风险,这可能对胎儿的身心健康产生负面影响[18]。产妇供血不足可能导致胎儿缺乏足够的氧气供应,损害胎儿的神经发育和免疫功能,因此对焦虑症有广泛性的影响。流行病学调查证实,怀孕期严重的恶心/呕吐与后代不良后果有关,包括更高的胎儿死亡率以及更高的青春期精神疾病风险,如更高的抑郁症、焦虑症和双向情感障碍的发病率[19-21]。
在脑结构层面,本研究发现儿童焦虑患者表现出中央前回、楔前叶等区域的皮层表面积减少、厚度增加。此外,背外侧前额叶、额下回、颞上回、脑岛和中央后回等区域也表现出表面积的减少。皮层表面积减少一般被认为与减少的神经细胞数量和较小的体积有关,而厚度增加可能代表着神经修剪不足与发育迟缓[22]。背外侧额叶在认知控制和不恰当想法抑制中发挥着重要的作用,并且通过与负责负面情绪处理的杏仁核之间的投射在情绪调节过程中发挥着重要作用[23],而颞叶区域在一些研究中也被发现参与情绪相关的认知重评过程[24]。这些区域的灰质结构异常可能意味着个体对负面情绪的调节能力受损。腹内侧前额叶和楔前叶被认为是默认网络的核心部分,对于处理情绪有重要意义[25]。脑岛能够处理内脏感受信息,调节交感与副交感神经系统的平衡,维持身体的内稳态,脑岛区域的结构异常可能与焦虑患者无法有效处理躯体反应(如心跳加速、呼吸急促)有关。此外,关联分析发现,母亲怀孕期间接受的医疗护理与更大的颞上回皮层厚度有关。更多的母体医疗护理代表着更多的健康问题,这些身体方面的压力会激发母体的压力激素(糖皮质激素)释放,从而影响到胎儿的大脑。一项研究表明,糖皮质激素对颞叶突触可塑性带来负面作用[26],这可能是母体健康问题导致儿童焦虑症状的生理机制之一。
在功能连接层面,本研究发现了以感知运动网络(SMN)与间脑连接的增加以及扣带-顶叶网络(CPN)与尾状核的连接增加为代表的皮层-皮层下连接异常。感知运动网络在一些研究中被报告对情绪处理存在重要意义[27],而间脑和自主神经系统调节及内脏活动相关[28],二者间的连接异常增加可能与焦虑患者增加的躯体症状有关。扣带-顶叶网络与对刺激的警觉[29]和认知控制有关[30],而尾状核属于奖赏网络的一部分[31],这两个区域的连接异常增加可能与个体对恐惧刺激的过度警觉有关。
值得注意的是,与健康组相比,四种焦虑症亚型的脑影像也存在广泛的改变。例如,广泛性焦虑表现出背侧注意网络-视觉网络以及额顶控制网络-腹侧注意网络的连接上升,这与先前研究中报告的广泛性焦虑患者对负性事件表现出过度注意偏向一致[32],为我们指出了注意系统的异常在广泛性焦虑症中的重要作用。社交焦虑表现出后扣带、额上回和颞极的厚度下降。后扣带和颞极均属于默认网络,其中后扣带扮演着重要的核心节点位置,对于个体表征复杂的社交信息意义重大[33],这些区域的结构异常可能与社交焦虑患者处理社交信息能力的缺陷有关。分离焦虑表现出感知运动网络到默认网路连接的异常。感知运动网络在躯体感受信息处理中扮演关键角色,该网络的连接异常可能代表了分离焦虑患者对母亲躯体接触的迫切需求。
本研究存在以下几点不足:1)本研究为关联分析,无法确定母体风险、大脑改变和焦虑症状之间的因果关系,未来研究应利用动物模型更深入探查焦虑症的因果机制。2)本研究采用的焦虑测量为二分诊断标签,无法确定母体环境风险因素和焦虑症状间可能存在的线性和非线性关系。3)各个焦虑症亚型的样本数量较小(仅为数百人),因此统计分析的结果显著性不高。4)基于父母报告的K-SAD 诊断可能造成儿童焦虑症的诊断比例偏高。但是,总体上说,这项大型纵向研究从孕期风险因素、脑影像的多个维度考察了焦虑症及其亚型的脑机制,为探究母亲孕期风险对后代儿童的焦虑症的影响提供了借鉴意义。未来需要进一步探究不同焦虑症亚型孕期风险因素与脑机制的共性和特异性,为有效干预焦虑症提供研究依据。

