实验室自繁大豆菌核萌发影响因素研究
李易初 孟庆林 石凤梅 马立功 刘佳 苏保华 于良斌


摘要 采用人工繁育菌核进行萌发试验,研究人工繁育菌核与自然菌核萌发区别及培养时间、形成菌核的菌龄和保存方式对菌核萌发的影响。结果表明,PDA平板培养菌核萌发时间较少,采集菌核萌发时间最长及萌发率最低;PDA平板15 d形成菌核萌发时间短,培养30和45 d菌核萌发时间无明显差异;不同菌龄形成菌核萌发无差异;繁育菌核直接培养萌发时间最短,干燥储存时间越长,后续萌发培养时间越长。
关键词 核盘菌;大豆;菌核萌发;人工繁育
中图分类号 S435.651 文献标识码 A 文章编号 0517-6611(2024)03-0122-03
doi:10.3969/j.issn.0517-6611.2024.03.029
Study on Influencing Factors of the Sclerotiums Germination in Laboratory Artificial Culture on Soybean
Abstract The artificial breeding sclerotiums were used for germination test. The germination difference between artificial breeding sclerotiums and natural sclerotiums, the influence of sclerotiums of several generations funguses and preservation methods on the germination of sclerotiums was studied.The results showed that the germination time of sclerotiums cultured by PDA substrate was less,the natural sclerotiums germination time was the longest and germination rate was the lowest, the germination time of sclerotiums which culture for 15 days in PDA substrate was shorter , and there was no significant difference between 30 days and 45 days. There was no difference between sclerotiums from different age funguses groups. The germination time of fresh breeding sclerotiums was the shortest, and the longer the dry storage time, the longer the subsequent germination culture time.
Key words Sclerotinia sclerotiorum;Soybean;Sclerotiums germination;Artificial culture
大豆菌核病是由核盤菌Sclerotinia sclerotiorum(Lib.)be Bary引起的主要真菌病害,核盘菌世界范围内可以侵染上百种植物,侵染力强,寄主广泛[1]。有关部门对我国大豆菌核病发生年份统计发现,大豆产量整体减产近34%,严重时减产50%,如遇特殊年份甚至绝收[2]。全球范围内暂未发现免疫大豆品种,对大豆菌核病侵染机理等方面的研究仍是解决核盘菌防治问题的重要研究方向。
核盘菌主要通过2种方式侵染大豆,一种是菌丝直接侵入,一种是通过菌核萌发形成子囊盘弹射子囊孢子侵染[3-4]。野外采集菌核数量有限且存在地域差异,核盘菌子囊孢子致病机理的研究多采用实验室自繁菌核萌发收集子囊孢子为接种菌,试验过程中发现自繁菌核萌发情况多样,菌核间萌发状态难以达成一致,影响子囊孢子的收集时间和数量,进而影响后续试验顺利进行。与此同时,人工繁殖菌核与自然采集菌核萌发情况是否存在差异仍未明确。笔者研究人工培养菌核与自然形成菌核是否存在萌发差异,并初步探索人工繁育的菌核在室内萌发培养的影响因素,为后续菌核萌发机制及子囊孢子致病力研究等提供研究基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株。
实验室内常规方法分离收集自黑龙江省不同地区的菌核JH001、JH002和JH003,得到对应的致病菌株4 ℃保存斜面备用。田间采集菌核常温干燥环境留存,部分菌核按照试验方法直接试验;菌株JH001、JH002和JH003转接在PDA平板,待菌落气生菌丝纠结成团形成菌核,镊子摘取PDA平板表面菌核用于试验;3种菌块分别接种于马铃薯胡萝卜培养基恒温20 ℃培养20 d,形成菌核取出洗净、阴干备用。
1.1.2 试验仪器。
超净工作台(WT-2N)、生化培养箱(SPX-420B)、恒温干燥箱(DGX-9623 BC-1)、样品保存柜(FYL-YS-430L)等。
1.2 方法
1.2.1 菌核来源对萌发的影响。
选择3个菌株3种不同来源的菌核进行萌发试验,挑选合适菌核相同条件培养。观察菌核萌发时间,培养20 d调查每个发芽盒菌核萌发数量,计算萌发率。菌核分别来自PDA平板菌丝团形成菌核,马铃薯胡萝卜培养基培养得到,野外病株体上采集。
1.2.2 培养时间对菌核萌发的影响。
首次分离得到的菌株接种于马铃薯胡萝卜培养基,25 ℃培养15、30、45 d,取出培养时间不同的菌核,洗净备用。
1.2.3 菌龄对菌核萌发的影响。
第一次分离得到的菌株,再次转接得到的第二代、第三代菌株通过室内人工自繁(马铃薯胡萝卜培养基培养)方法获得菌核,冲洗干净后直接进行萌发试验。
1.2.4 保存状态对菌核萌发的影响。
马铃薯胡萝卜培养基培养得到菌核冲洗干净后直接进行萌发试验;菌核阴干后再进行萌发试验;菌核阴干并储存30 d再用于萌发试验。
按照试验设计培养选择不同状态大小均匀菌核,完全浸泡在5%次氯酸钙溶液中,表面消毒30 min,无菌水冲洗3遍,摆放在铺有完全湿润灭菌沙的培养盒中,20 ℃恒温明暗交替条件培养,随时观察菌核的萌发情况,记录萌发时间。
2 结果与分析
2.1 菌核来源对萌发的影响
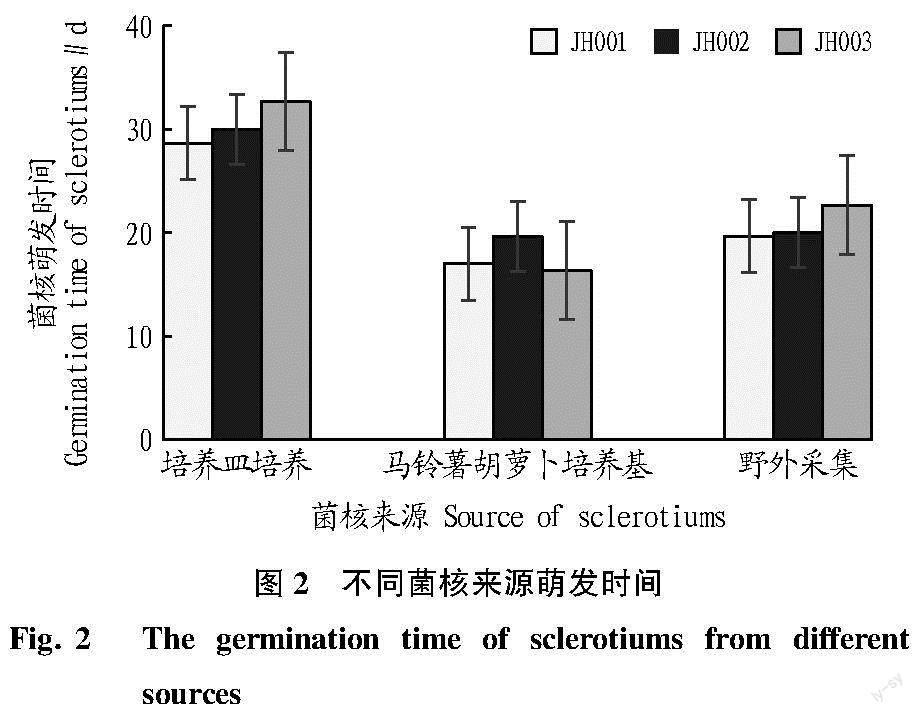
不同来源菌核萌发情况见图1。由图1可知,马铃薯胡萝卜培养的菌核部分形状不规则,处理组中JH001菌核的萌发率可达70%,3种菌株菌核的萌发率平均高于59%,3个来源菌核的平均萌发率最高;PDA平板形成菌核形状多为圆形和椭圆形,菌核一侧接触玻璃皿或培养基,形态扁平,饱满程度不高,其中JH002菌核萌发率最高为30.67%,仍明显低于其他2组处理;野外采集菌核萌发情况介于前2组处理之间,平均萌发率为53.56%。对比发现PDA平板培养的菌核平均萌发率最低,马铃薯胡萝卜培养基培养的菌核平均萌发率最高。
试验菌核的萌发时间比较发现,培养皿培养的菌核萌发所需时间均超过28 d,JH003菌核萌发时间为32.67 d;野外采集的菌核需连续培养近20 d才开始萌发;马铃薯胡萝卜培养基繁育的菌核萌发时间为16.33~19.67 d(图2)。
结合萌发时间及萌发率试验结果可知,PDA培养基培养形成菌落后菌核所需萌发时间较长,相同培养时间菌核的萌发率最低,且在试验中观察到菌核在培养过程中未形成子囊柄及子囊盘,而是形成菌丝,菌核呈菌丝型萌发。野外采集菌核的萌发时间及萌发率次之,推测户外的自然环境影响了菌核本身的水分含量,采集的菌核均十分干燥,萌发需要较长时间。马铃薯胡萝卜培养基培养的菌核萌发时间最短、萌发率最高,是比较稳定的实验室繁育菌核的方法。
2.2 培养时间对菌核萌发的影响
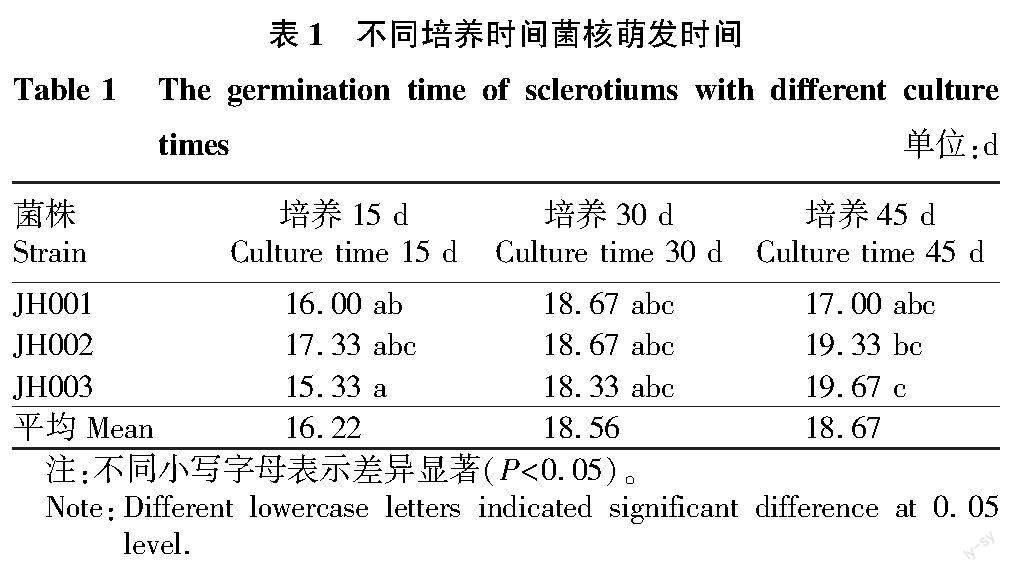
按照试验方法培养菌核,观察记录其萌发时间。由表1可知,萌发时间在15~20 d,不同培养时间的菌核萌发天数相差较小,PDA平板培养15 d得到菌核,需平均培养16.22 d后逐个萌发。JH002所需培养时间最长为17.33 d,较其他2组相对时间较短;对试验数据进行分析,培养30和45 d菌核萌发时间差异不显著。培养15 d的菌核萌发时间最短,培养超过30 d的菌核萌发时间需要18 d以上。
2.3 菌龄对菌核萌发的影响
菌核的萌发率和萌发时间见表2。由表2可知,一代分离菌株菌核平均需要19.00 d,萌发率可达49.33%;第二代菌株形成菌核萌发平均需要18.89 d,与首次分离得到菌株菌核萌发时间无显著差异,萌发率为50.67%,略高于首次分离菌株菌核;第三代繁育的菌核萌发率为50.78%,萌发时间为18.22 d,菌龄不同形成的菌核在培养时间及萌发率方面差异不显著。
2.4 保存状态对菌核萌发的影响
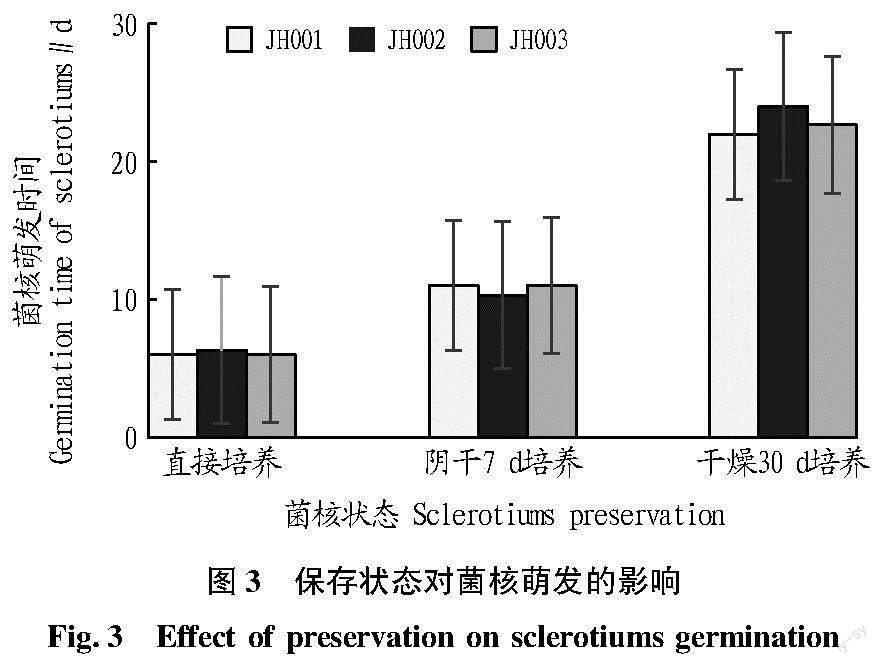
选择3种实验室常见保存方式的菌核进行试验,干燥30 d后的菌核需要培养22 d以上萌发;繁育菌核直接取出培养只需6 d左右即可萌发;阴干7 d的菌核所需萌发时间在10~11 d(图3)。刚刚培养得到的新鲜菌核,没有干燥过程直接培养萌发仅需6 d,随着干燥时间延长,再次萌发培养时间延长,干燥储存时间越长,菌核萌发所需时间越长。
3 讨论
该试验结果表明,通过马铃薯胡萝卜培养基培养的菌核,直接取出清洗,立即进行萌发培养,菌核萌发速度快,萌发率较高;野外采集的菌核和人工繁育存储时间较长的菌核萌发时间较长,间接证明菌核内部含水量与菌核的萌发有十分重要的关系[5-7]。马铃薯胡萝卜培养基繁育的菌核,萌发时间与菌核储存时间[8]及干燥程度有直接关系,刚刚繁育的菌核萌发所需时间仅为6~7 d。PDA平板上形成的菌核较小,萌发时间较长,且部分菌核不形成子囊柄,多数菌核继续菌丝型萌发[9-10]。用于繁育菌核的菌株与形成菌核的萌发时间无明显相关性,不同传代菌株形成的菌核不影响其萌发。
综上所述,PDA平板培养的菌核形状均匀,萌发时间长,还受到形成数量和体积偏小限制,不利于在后续培养中形成子囊柄及子囊盘;马铃薯胡萝卜培养基更适合大量繁育菌核,培养得到菌核数量充足、体积较大,干燥条件封闭保存,提前预留出培养时间,可以保证后续试验顺利进行,是实验室内较为理想的繁育菌核方法。
参考文献
[1] ZHAO X,HAN Y P,LI Y H,et al.Loci and candidate gene identification for resistance to Sclerotinia sclerotiorum in soybean(Glycine max L.Merr.)via association and linkage maps[J].The plant journal,2015,82(2):245-255.
[2] 尹亚清,杨向红,秦瑞芬.大豆菌核病的发生及防治[J].现代农业科技,2021(5):139-140.
[3] BOLAND G J,HALL R.Epidemiology of Sclerotinia stem rot of soybean in Ontario[J].Phytopathology,1988,78(9):1241-1245.
[4] 罗宽.有关Sclerotinia sclerotiorum的研究[J].中国油料作物学报,1981,3(3):60-64.
[5] 刘勇,布朗,特伯德.油菜菌核病菌室内子囊孢子诱导和收集[J].西南农业学报,1993,6(S1):92-94.
[6] MILA A L,YANG X B.Effects of fluctuating soil temperature and water potential on sclerotia germination and apothecial production of Sclerotinia sclerotiorum[J].Plant disease,2008,92(1):78-82.
[7] NEPAL A,DEL RO MENDOZA L E.Effect of sclerotial water content on carpogenic germination of Sclerotinia sclerotiorum[J].Plant disease,2012,96(9):1315-1322.
[8] 母紅岩,郑露,刘浩,等.油菜菌核病病原菌核的菌丝型萌发特性[J].中国油料作物学报,2017,39(2):228-233.
[9] 樊淼.油菜菌核病菌子囊盘和子囊孢子室内诱导方法研究[D].合肥:安徽农业大学,2016:16.
[10] 杨淼泠,张维,韦秋合,等.大豆菌核病研究进展[J].中国农学通报,2021,37(27):90-99.

